痛风宁颗粒对急性痛风性关节炎模型大鼠膝关节 PGE-2、IL-8 及 IκB-α、IKK-α 的影响
2013-12-07苏友新陈宝军赵富强周必洪张子怡
苏友新,陈宝军,赵富强,闫 虎,周必洪,张 庆,张子怡
(福建中医药大学,福建 福州 350122)
本课题组前期研究[1-3]发现,痛风宁颗粒具有较好的抗炎、消肿、镇痛等功效,对急、慢性痛风疗效显著;并通过检测急性痛风性关节炎模型大鼠关节滑膜“TLR-ILR/NF-κB”通路中某些信号分子的表达情况, 已确定 IL-1R、MyD88、TLR-2、TLR-4 等与痛风宁颗粒的消肿、镇痛等作用关系密切[4-5]。为进一步阐明痛风宁颗粒对急性痛风性关节炎模型大鼠抗炎、镇痛的作用机制,本实验选取该信号通路下游起关键作用的 IκB-α、IKK-α 及炎性因子 PGE-2、IL-8作为指标进行观察。
1 材料与方法
1.1 实验动物 45只健康SPF级SD大鼠,均为雄性,体重(200±10)g,由上海 Slacsis lab animal有限公司提供[许可证号:SCXK(沪)2011-0015],委托福建中医药大学实验动物中心代购并饲养。
1.2 试剂及药物 微晶型尿酸钠(美国Sigma公司,批号:108K5309);大鼠 IL-8、PGE-2 的 ELISA 试剂盒(上海西唐生物科技有限公司,批号:1103182、1103251);兔抗大鼠 IκB-α、IKK-α 多克隆抗体(英国 abcam 公司,编号:GR27736-1、GR38675-1);羊抗兔SABC免疫组化试剂盒(武汉博士德生物工程有限公司,编号:SA1022);DAB染色试剂盒(北京博奥森生物技术有限公司,批号:990799);痛风宁颗粒:每克含生药3.2 g(福州辰星药业有限公司提供,产品批号:101024);痛风定胶囊:每粒 0.4 g(成都中汇制药有限公司,产品批号:100701);塞来昔布胶囊:每粒200 mg(由辉瑞制药有限公司进口分包装,分包装批号:95800309)。
1.3 主要仪器 RM2135切片机(德国LEICA公司);AHB-LB-1万能研究显微镜(上海实验仪器总厂);Allegra 64R低温高速离心机(美国 Beckman Coulter公司);ELX808酶联免疫检测仪(美国BIOTEK);Image pro plus 6.0专业图像分析软件(美国Media Cybernetics公司);超纯水制备系统Milli-Q Advantage(美国密理博)。
1.4 实验方法
1.4.1 药品制备
1.4.1.1 尿酸钠悬浊液的制备 用电子天平称取微晶型尿酸钠2.5 g,高温高压,取无菌生理盐水定容至100 mL,混匀,制成2.5%的尿酸钠悬浊液,保存于4℃冰箱,用前摇匀。
1.4.1.2 干预药物的制备 成人每日痛风宁颗粒用量27 g,痛风定胶囊用量4.8 g,塞来昔布胶囊用量400 mg,按照人与大鼠药量关系[6]换算得出大鼠每日以上 3 个药物用量分别为 2.93、520、43.3 mg/kg。然后根据每只大鼠体重得出其具体用药量,加入2 mL蒸馏水,混匀,制成混悬液。
1.4.2 动物的分组及造模 45只大鼠适应性喂养1周后用随机数字表法分为正常组、模型组、痛风宁组、痛风定组、塞来昔布组共5组,每组9只,称重并编号;参照Coderre造模方法[7],各组大鼠均以右膝关节为中心常规消毒,正常组大鼠以右膝关节外侧膝眼进针,向关节腔内注射0.2 mL生理盐水,其余4组以同样方法右膝关节每个关节注射0.2 mL配制好的2.5%尿酸钠悬浊液。
1.4.3 用药干预 造模1 h后,痛风宁组、痛风定组、塞来昔布组大鼠按照体重分别予以相应药物混悬液2 mL灌胃,正常对照组、模型对照组大鼠以2 mL生理盐水灌胃,每天1次,连续灌胃3 d。
1.4.4 标本采集 末次灌胃1 h后,采用300 mg/kg剂量水合氯醛腹腔注射麻醉大鼠,以右膝关节为中心,常规备皮,碘伏消毒,戴无菌手套,然后切开右膝关节囊,用1 mL生理盐水冲洗关节腔,收集冲洗液;切取关节囊,采用4%中性甲醛固定液处理固定。
1.4.5 关节液细胞因子PGE-2、IL-8含量的检测采用酶联免疫试剂盒检测关节冲洗液中PGE-2、IL-8的含量。具体步骤按试剂盒说明操作。
1.4.6 关节滑膜组织中IκB-α、IKK-α表达的检测采用免疫组化技术测定关节滑膜组织中IκB-α、IKK-α的含量。一抗稀释200倍,设PBS替代一抗的空白阴性对照;采用Image Pro Plus 6系统分析免疫组化图像:免疫组化阳性反应为细胞胞浆内呈棕黄色或深棕黄色,阴性反应为胞浆内未着色。每张切片随机分析5个不重叠视野(×400),100细胞以上,检测这5个随机视野内的阳性染色面积及积分光密度值,以5个视野所得的数据的平均值作为最后结果。
2 结 果
2.1 关节液中细胞因子PGE-2和IL-8含量的变化见表1。
表1 5组PGE-2和IL-8含量的比较()pg/mL

表1 5组PGE-2和IL-8含量的比较()pg/mL
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05;与痛风宁组比较,3)P<0.05;与痛风定组比较,4)P<0.05。
IL-8 14.01±3.40 52.81±4.311)20.96±3.081)2)30.02±4.061)2)3)21.61±3.311)2)4)组 别正常组模型组痛风宁组痛风定组塞来昔布组n99999 PGE-2 45.87±16.41 109.56±24.471)3)41.40±9.442)110.91±33.071)3)92.52±14.741)3)4)
正常组、痛风宁组关节液中细胞因子PGE-2含量显著低于其它3组(P<0.05);模型组与痛风定组、塞来昔布组比较无显著性差异。正常组关节液中IL-8显著低于其它各组(P<0.05),而模型组显著高于其它各组(P<0.05);治疗的3组比较,痛风宁组低于痛风定组(P<0.05),痛风宁组与塞来昔布组之间无显著差异;痛风宁组仍高于正常组(P<0.05)。
2.2 关节滑膜组织中IKK-α及IκB-α表达的变化见表2。
表2 5组关节滑膜组织中IKK-α及IκB-α的平均光密度值比较()IOD/单位面积
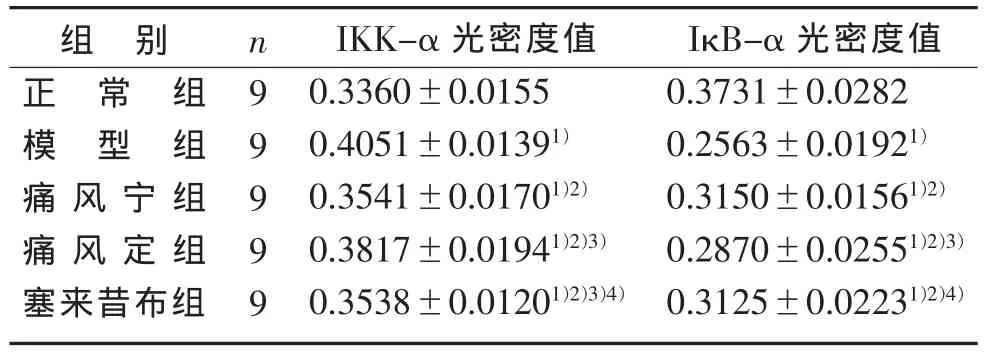
表2 5组关节滑膜组织中IKK-α及IκB-α的平均光密度值比较()IOD/单位面积
注:与正常组比较,1)P<0.05;与模型组比较,2) P<0.05;与痛风宁组比较,3)P<0.05;与痛风定组比较,4)P<0.05。
IκB-α 光密度值0.3731±0.0282 0.2563±0.01921)0.3150±0.01561)2)0.2870±0.02551)2)3)0.3125±0.02231)2)4)组 别正常组模型组痛风宁组痛风定组塞来昔布组n99999 IKK-α光密度值0.3360±0.0155 0.4051±0.01391)0.3541±0.01701)2)0.3817±0.01941)2)3)0.3538±0.01201)2)3)4)
正常组关节滑膜组织IKK-α平均光密度值显著低于其它4组(P<0.05),而模型组较其它组高(P<0.05);痛风宁组和塞来昔布组较模型组及痛风定组低(P<0.05)。正常组关节滑膜组织中IκB-α平均光密度值显著高于其它4组(P<0.05),而模型组较其它组低(P<0.05);治疗的3组比较,痛风宁组显著高于痛风定组(P<0.05),与塞来昔布组比较无显著性差异。
3 讨 论
在急性痛风性关节炎发生阶段,由于尿酸盐结晶的刺激,病变局部出现微小血管充血,促使血管内皮细胞损伤,进而引起血管内壁通透性增加,炎性渗出增多,导致组织水肿,引发局部疼痛,伴随着产生大量炎性因子如 PGE-2、IL-8 等[8-9]。PGE-2 的作用引起剧烈疼痛,IL-8可进一步趋化中性粒细胞、淋巴细胞等到炎症局部,加剧炎症反应[8],形成恶性循环,最终加重痛风性关节炎的急性发作。因此,病变关节液中PGE-2、IL-8等含量的变化可以在一定程度上反映急性痛风性关节炎的炎症程度。
目前研究发现,在急性痛风性关节炎发病过程中伴随着诸多信号通路的激活或抑制,“TLR-ILR/NF-κB”信号通路系统就是其中重要的一个。“TLRILR/NF-κB” 信号通路的激活对 PGE-2、IL-8 等炎性因子的调控起着至关重要的作用[10]。研究表明:尿酸钠结晶(MSU)在痛风性关节炎急性发作时,可同时激活IL-1受体(IL-1R)和Toll受体(Toll-like receptors,TLRs)[11-12],活化的 IL-1R 和 TLRs 通过与胞浆内衔接蛋白MyD88结合而形成复合物,前者可募集结合IRAK(IL-1受体相关激酶)并使之活化;活化的IRAK与TRAF6(TNF受体相关因子)结合后,又活化 TAK1(TGF-β 活化的激酶), 导致 IκB(inhibitor of κB)激酶级联反应,使转录因子 NF-κB 等激活。NF-κB 位于“TLR-ILR/NF-κB”信号通路下游的枢纽位置,作为一个重要的核转录因子,其作用范围广,对该信号通路激活后的效应调控有重要意义。活化的NF-κB进入细胞核,可有效调节细胞因子如PGE-2、IL-8及急性反应期蛋白诱导的效应因子酶iNOS等基因的表达[10]。NF-κB激活过程的环节多,IKK-α和IκB-α是NF-κB活化过程中的2个关键影响因子。IKK-α可促使胞浆中与NF-κB结合成非活化状态三聚体复合物的IκB-αSer32/36磷酸化及泛素化,使得后者易被26S蛋白酶小体降解从而暴露 NF-κB,引起 NF-κB 的激活[13];而 IκB-α 可以抑制“TLR-ILR/NF-κB”信号通路 NF-κB 的活化。有研究证明:小鼠缺失IκB-α后出现各种免疫性疾病与 NF-κB 被过量激活相关[14]。故 IKK-α、IκB-α 的表达高低在一定程度上可以反映 “TLR-ILR/NF-κB”信号通路下游的活动状态,对NF-κB的活化及PGE-2、IL-8的调控发挥了重要作用。
本实验观察到痛风宁颗粒能够降低大鼠病变关节关节液中PGE-2、IL-8的含量,降低病变关节滑膜组织IKK-α的表达,促进IκB-α表达,与模型组及痛风定组比较均有显著差异(P<0.05)。提示痛风宁颗粒对急性痛风性关节炎的抗炎、镇痛作用可能与降低“TLR-ILR/NF-κB”信号通路下游关键信号分子IKK-α的表达,减少IκB-α的降解,进而抑制IL-8、PGE-2的表达有关。
[1]陈伟宏,苏友新,王和鸣,等.痛风宁冲剂活血镇痛抗炎消肿的药效学研究[J].中国中医骨伤科,2002,10(3):26-28.
[2]苏友新,陈伟宏,王和鸣,等.痛风宁颗粒对实验性鸡痛风性关节炎的影响[J].中国骨伤,2003,16(5):275-276.
[3]苏友新,陈伟宏,陈凡,等.痛风宁颗粒对30例慢性痛风性关节炎患者血尿酸、血沉、血脂及血流变的影响[J].中国中医骨伤科,2005,13(1):16-18.
[4]邵明伟.痛风宁颗粒对急性痛风性关节炎模型大鼠TNF-α、IL-6、COX-2 及 NF-κB 影响的实验研究[D].福州:福建中医药大学,2011.
[5]傅玉辉.痛风宁颗粒对SD大鼠急性痛风性关节炎模型TLR/MyD88影响的研究[D].福州:福建中医药大学,2011.
[6]徐叔云.药理学实验方法[M].北京:人民卫生出版社,2002:203-204.
[7]时乐,徐立.痛风性关节炎动物模型的研究现状与展望[J].中国实验动物学报,2006,14(1):71-74.
[8]沈维增,吕红梅,谢峥伟,等.当归拈痛汤对急性痛风性关节炎患者血IL-1、IL-8和TNF-α的影响[J].中国中医急症,2011,20(3):353-354.
[9]王燕燕,陈超,杨洪发.虎参痛风胶囊对大鼠足肿的抗炎作用[J].中国医院药学杂志,2005,25(3):206-208.
[10]BRIKOS C,O’NEILL LA.Signalling of toll-like receptors[J].Handb Exp Pharmacol,2008(183):21-50.
[11]AKAHOSHI T,MURAKAMI Y,KITASATO H.Recent advances in crystal-induced acute inflammation[J].Curr Opin Rheumatol,2007,19(2):146-150.
[12]CHURCH L D,COOK G P,MCDERMOTT M F.Primer:inflammasomes and interleukin 1beta in inflammatory disorders [J].Nat Clin Pract Rheumatol,2008,4(1):34-42.
[13]CARTER R S,GEYER B C,XIE M et al.Persistent activation of NF-kappa B by the tax transforming protein involves chronic phosphorylation of Ikappa B kinase subunits IKK beta and IKK gamma[J].J Biol Chem,2001,276(27):24445-24448.
[14]蒋莉.Toll样受体在痛风发病机制中的作用研究[D].南充:川北医学院,2010.
