猫杯状病毒荧光定量PCR检测方法的建立及初步应用
2013-12-03高玉伟胡桂学杨松涛赵艳丽刘秋燕徐春忠梁秀娟夏咸柱
姜 雪,高玉伟,胡桂学,杨松涛,赵艳丽,刘秋燕,徐春忠,梁秀娟,夏咸柱
(1.吉林农业大学 动物科学技术学院,长春 130118;2.解放军军事医学科学院 军事兽医研究所,长春 130062;3.上海野生动物园,上海 201300;4.吉林省野生动物救护繁育中心,长春 130122)
猫杯状病毒(feline calicivirus,FCV)为单股正链RNA,无囊膜,直径30~40 nm[1],是一种猫和部分猫科动物普遍存在的病原体.易感动物感染FCV后表现为口腔溃疡、上呼吸道感染、慢性口炎、鼻炎、结膜炎、肺炎或跛行等临床症状[2-3],其临床症状的多样性取决于FCV基因的多样性[4],与由猫疱疹病毒(FHV)引起的猫传染性鼻炎相似,二者也常混合感染[5].高致病性FCV可引起动物全身性感染,甚至死亡.感染FCV的猫一部分恢复健康,另一部分成为无症状的病原携带者[6].检测FCV的方法有病毒分离鉴定和血清学实验,对分离的病毒可通过电镜检查、RT-PCR、荧光定量PCR鉴定或与已知抗血清做中和、琼扩、免疫荧光或补结实验进行鉴定[1].其中荧光定量PCR方法应用广泛[7-12],如Sykes等[13-14]建立了对FCV检测的普通PCR方法;Helps等[15]用染料法建立了FCV荧光定量PCR检测方法;Wilhelm等[16]以FCV的ORF2为目的基因建立了荧光定量PCR方法检测FCV,最低检测范围为(5×101~5×102)拷贝/μL.本文通过优化FCV荧光定量PCR条件,为临床样品的检测提供准确而快速的检测方法.
1 材料与方法
1.1 毒株和细胞
FCV由军事兽医研究所于2012年分离自国内某患病死亡的虎;猫鼻气管炎病毒(FRtV)、猫泛白细胞减少症病毒(FPV)和猫肾细胞(F81)均为吉林农业大学动物科学技术学院实验室保存.
1.2 主要仪器和试剂
德国Tiangen公司生产的Agilent Mx3000P型实时荧光定量PCR仪;美国ABI公司生产的PCR仪;德国Bio-Lmaging Systems公司生产的凝胶成像系统;美国Qnawell公司生产的核酸蛋白分析仪.
质粒小提试剂盒(D100)和琼脂糖凝胶回收DNA试剂盒(D100)购自北京索莱宝科技有限公司;反转录试剂盒(AT301)和pEASY-Blunt载体(CB101-01)购自全式金生物技术有限公司;TRIZOL试剂(D9108A)、Pfu酶(D7336)、大肠杆菌感受态DH5α(D9057)、DL 2000 DNA Marker(D501S)和荧光定量PCR试剂盒(DRR390)等均购自大连宝生物工程有限公司.
1.3 引物设计与合成
根据GenBank中编码FCV衣壳蛋白ORF2的保守区基因序列,利用Primer5.0软件,设计并合成一对特异性引物及探针.上游引物:5′-CTGACTTCAAATTTCATCTC-3′;下游引物:5′-TGGGAATTAAGTCAGAGG-3′;探针:5′-(FAM)ATCTATGCTCACTCATGGATCTGTC(Eclipse)-3′.探针以FAM为报告基团,以Eclipse为淬灭基团.引物及探针均由大连宝生物工程有限公司合成.
1.4 标准阳性模板的制备
用FCV病毒接种F81细胞,待细胞出现80%病变(CPE)后,反复冻融3次,收获细胞毒.用TRIZOL法提取细胞毒RNA,提取产物直接进行反转录获得病毒cDNA作为扩增模板.反转录体系:总RNA模板5 μL,随机引物1 μL,2×TS反转录预混液10 μL,反转录酶RT 1 μL,去RNA酶水(DEPC)处理水补到20 μL.反应条件:25 ℃孵育10 min,42 ℃孵育30 min,85 ℃加热5 min.PCR扩增体系:cDNA模板3 μL,5倍Pfu缓冲液10 μL,dNTP 3 μL,上游引物F 1 μL,下游引物R 1 μL,Pfu酶0.5 μL,DEPC处理水补到29.5 μL.PCR反应参数:95 ℃ 2 min;95 ℃ 20 s,59.3 ℃ 20 s,72 ℃ 75 s,30个循环;72 ℃ 5 min,4 ℃保温.以质量分数为1%的琼脂糖凝胶电泳鉴定正确后,利用凝胶回收试剂盒获得FCV病毒ORF2基因PCR扩增产物,将回收的产物连接pEASY-Blunt载体,转化大肠杆菌DH5α感受态细胞,挑取阳性克隆菌摇菌,提取质粒,经PCR和测序鉴定.测定其OD值,并根据公式计算重组质粒的DNA质量浓度与纯度.将重组质粒进行10倍梯度稀释,保存备用.
分子拷贝数(个/mL)=DNA质量浓度/DNA分子量,DNA分子量=DNA碱基数×660,DNA质量浓度=A260g/μL×稀释倍数×6.02×1023.
1.5 实时荧光定量PCR检测方法的建立
反应体系:DNA模板2 μL,EXTaq酶预混液12.5 μL,上游引物0.5 μL,下游引物0.5 μL,探针1.0 μL,DEPC处理水补到25 μL.在Agilent Mx3000P型实时荧光定量PCR仪上反应,反应条件:95 ℃ 30 s,94 ℃ 5 s,55 ℃ 10 s,72 ℃ 20 s,45个循环;退火期收集荧光信号.用矩阵法在引物浓度为0.16,0.20 μmol/L,探针浓度为0.32,0.40,0.48,0.56 μmol/L的反应体系筛选引物和探针的最佳使用量,以获得最低Ct值、典型荧光扩增曲线、较高荧光强度的引物和探针最佳浓度.
1.6 标准曲线的建立
实验采用已优化的荧光定量PCR反应条件,分别以梯度浓度稀释的含目的基因质粒为模板进行荧光定量PCR扩增,并利用Agilent Mx3000P型实时荧光定量PCR仪软件进行分析,选取最佳浓度建立标准曲线.
1.7 特异性实验及灵敏度与重复性实验
用所建立的荧光定量PCR方法检测FCV,FRtV,FPV,用双蒸馏水作为阴性对照,以检测其特异性.
将已计算出拷贝数的含目的基因质粒做10倍梯度稀释,稀释至用荧光定量PCR仪不能检出的稀释倍数,计算荧光定量PCR所能检测的最低模板拷贝数.对同一阳性样品进行4次重复检测,通过组内重复的荧光扩增曲线变化及Ct值变化评估该方法的重复性.
1.8 疑似临床样本的检测
用所建立的荧光PCR方法,对从长春市某宠物医院收集的24份疑似FCV患病猫的咽试子样本进行检测.
1.9 病毒的分离与鉴定
将荧光定量PCR方法检测结果为阳性的咽试子加适量DMEM稀释后,于12 000 r/min离心10 min,取上清液加每毫升1 600单位的双抗处理后接种单层F81细胞,盲传5代观察细胞是否产生特征性病变.对产生特异性病变的细胞反复冻融3次收取病毒液,进行RT-PCR鉴定.根据GenBank中已发布的FCV病毒ORF3基因序列设计一对特异性引物,预期扩增片段为550 bp,由北京博士生物公司合成.上游引物5′-TCCTTYGCAGTYTATAGAATAATTG-3,下游引物5′-TTATATCCCTGGGGTTAGGC-3′,Y: C/T.用TRIZOL法提取细胞毒的RNA,提取产物直接进行反转录获得病毒cDNA作为扩增模板.反转录过程按说明书操作.PCR扩增体系:DNA模板2 μL,10×Taq缓冲液2.5 μL,dNTP 2 μL,上游引物F 0.5 μL,下游引物R 0.5 μL,ExTaq酶0.3 μL,DEPC处理水补到25 μL.PCR反应参数:95 ℃ 4 min;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 10 min,4 ℃保温.反应结束后,取3 μL PCR产物进行质量分数为1%的琼脂糖凝胶电泳鉴定.
2 结 果
2.1 荧光PCR反应条件优化

图1 引物和探针浓度的优化Fig.1 Optimization of the concentrations of primer and probe
采用矩阵法选取引物和探针的最佳浓度,结果如图1所示.在c(引物)=0.20 μmol/L和c(探针)=0.40 μmol/L的条件下,对含目的基因质粒的检测可获得较合适的Ct值和较大的ΔRn.优化的荧光定量PCR反应条件为: 95 ℃ 30 s,95℃ 5 s,55 ℃ 10 s,72 ℃ 20 s,循环数为45,退火阶段收集荧光信号.
2.2 标准曲线的建立
按已优化反应条件,对103,104,105,106,107和108六个梯度含目的基因的质粒进行荧光定量PCR实验,结果如图2所示.由图2可见,反应结束后所产生的标准曲线呈较好的线性关系.相应的拷贝数X与Ct值的线性关系为Ct=-3.288xlgX+46.72.
2.3 特异性实验
用建立好的方法对FCV,FRtV,FPV的核酸及双蒸馏水进行荧光定量PCR检测,结果如图3所示.由图3可见,仅FCV产生荧光信号,呈现良好的特异性.
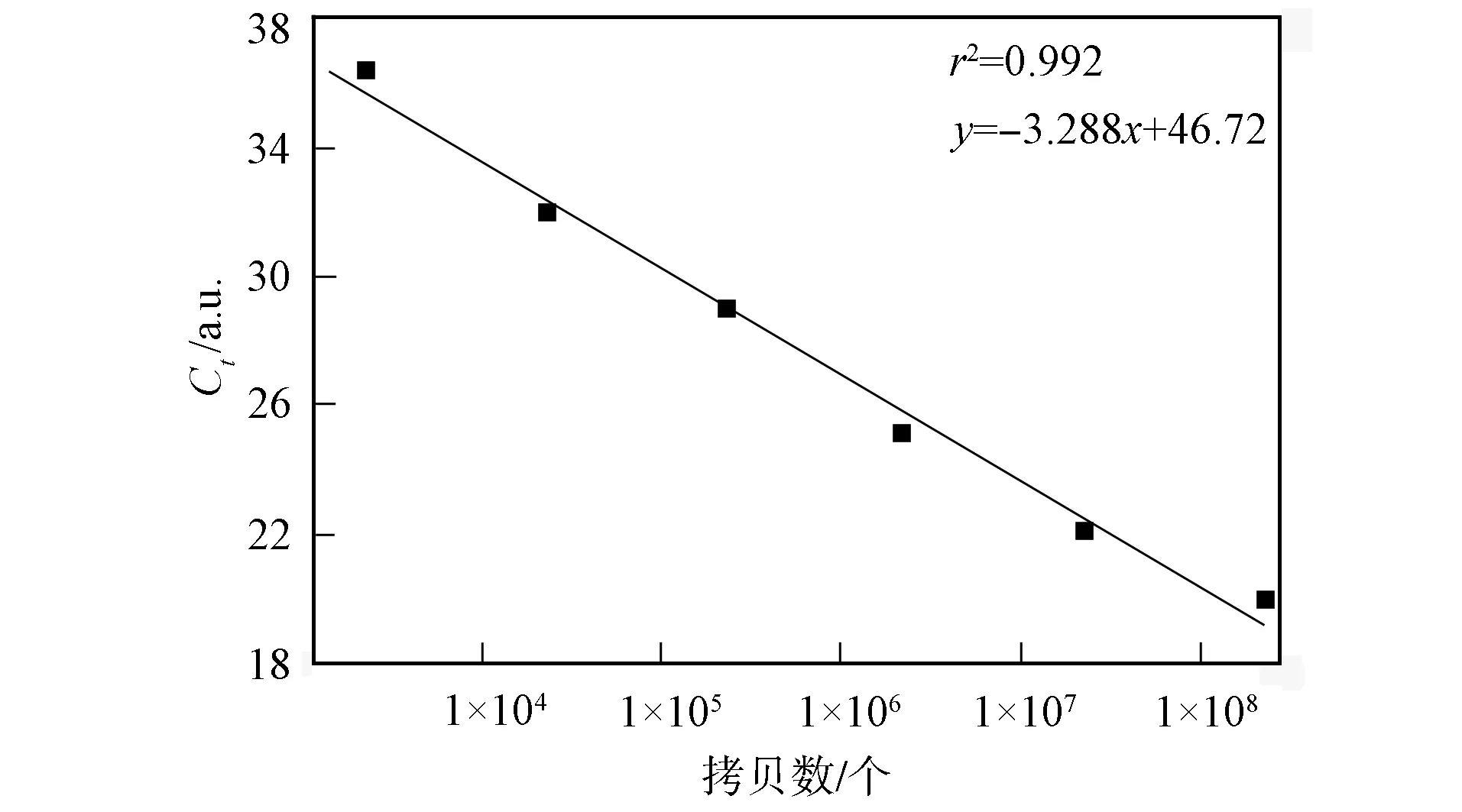
图2 实时荧光定量PCR方法的标准曲线Fig.2 Standard curve of real time PCR
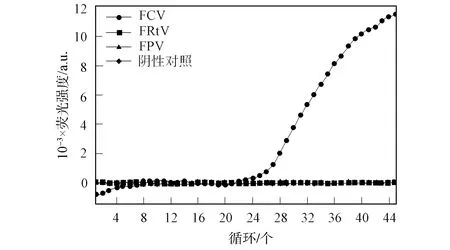
图3 特异性实验结果Fig.3 Test of specificity
2.4 敏感性实验结果
将计算出拷贝数的质粒做10倍系列稀释,进行荧光定量PCR实验,结果如图4所示.由图4可见,荧光定量PCR检测到的最低浓度为2.26×101拷贝/μL,表明该方法具有较高的灵敏度.
2.5 重复性实验结果
对阳性样品进行4次重复检测,结果如图5所示.通过统计分析可得变异系数为2.158%,表明该方法具有较好的准确性和重现性.

图4 敏感性实验结果Fig.4 Test of sensibility
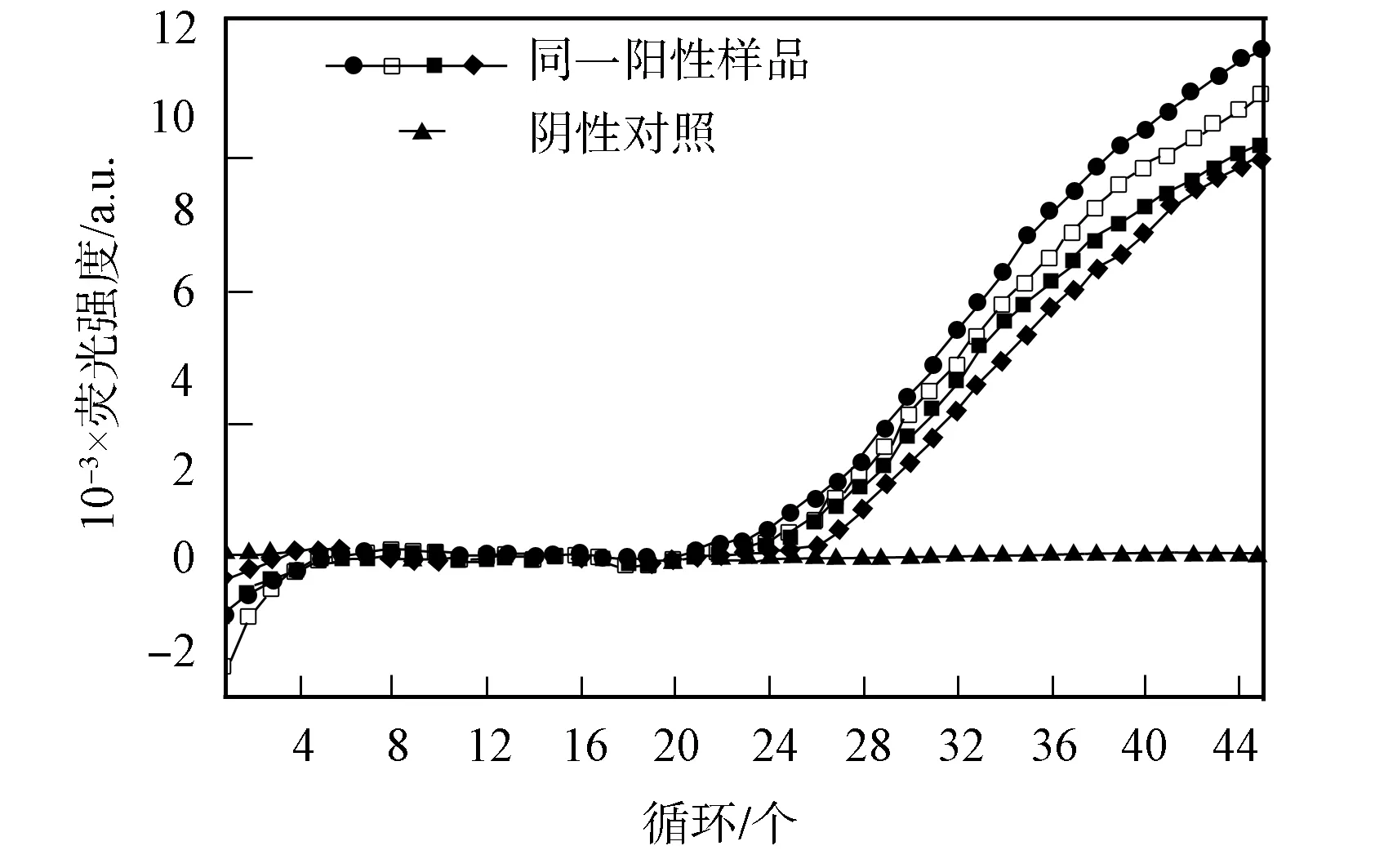
图5 重复性实验结果Fig.5 Curves of repeat test
2.6 疑似临床样品的检测及病毒分离鉴定结果

M:DL 2000分子量标准;1,2,3:PCR产物;4:阴性对照.图6 RT-PCR结果Fig.6 Result of RT-PCR
用优化后的荧光定量PCR方法对24份疑似患FCV病猫的唾液样品进行检测,结果为阳性样本3份,阴性样本21份,FCV的检出率为12.5%.采用F81细胞从荧光定量PCR阳性样本中分离病毒,3 d后,细胞均出现圆缩、葡萄串样和细胞脱落等病变.采用普通RT-PCR鉴定细胞培养物,结果均获得预期核苷酸片段,如图6所示.因此,本文建立的荧光定量PCR方法可较敏感地检测出阳性样本.
综上可见,本文建立的FCV荧光定量PCR方法,检测标准品的线性关系为0.992,最低检测为2.26×101拷贝/μL,具有较高的敏感性;特异性实验结果表明,该方法仅能检测FCV,无法检测其他相关病毒,呈现出良好的特异性;重复性实验表明,批内变异系数为2.158%,重复性较好;临床疑似样品的检测率为12.5%,与文献[17]结果相符.
[1] 殷震,刘景华.动物病毒学 [M].2版.北京: 科学出版社,1997: 329-354.
[2] Waters L,Hopper C D,Gruffydd-Jones T J.Chronic Gingivitis in a Colony of Cats Infected with Feline Immunode Ficiency Virus and Feline Calicivirus [J].Vet Rec,1993,132(14): 340-342.
[3] Pedersen N C,Laliberte L,Ekman S.At Ransient Febrile Limping Syndrome of Kit Tens Caused by Two Differentst Rains of Feline Calicivirus [J].Feline Practice,1983,13(1): 26-36.
[4] Dowers K L,Hawley J R,Brewer M M,et al.Association ofBartonellaSpecies,Feline Calicivirus and Feline Herpesvirus 1 Infection with Gingivostomatitis in Cats [J].Journal of Feline Medicine &Surgery,2010,12(4):314-321.
[5] Williams E S,Barker I K.Infectious Diseases of Wild Mammals [M].3rd ed.Des Moines: Iowa State University Press,2001: 280-291.
[6] Dick C P,Johnson R P.Sites of Persistence of Feline Calivirus [J].Res Vet Sci,1989,47(3): 367-373.
[7] NIU Wei,DING Zhuang,WANG Xiao-li,et al.Development of Quantitative PCR Assay for Detection of Classical Swine Fever Virus (CSFV) and Porcine Reproductive and Respiratory Syndrome Virus (PRRSV) [J].Chin J Vet Sci,2011,31(2): 174-177.(牛伟,丁壮,王晓莉,等.实时荧光定量PCR方法检测猪繁殖与呼吸综合征病毒和猪瘟病毒 [J].中国兽医学报,2011,31(2): 174-177.)
[8] CHEN Zhong-ming,ZHANG Zhi-cheng,FANG Guang-yuan.Detection of PRRSV and CSFV Using Real-Time PCR Assay [J].Progress in Veterinary Medicine,2011,32(2): 14-18.(陈钟鸣,张志成,方光远.实时荧光定量PCR检测猪病料中的PRRSV与CSFV [J].动物医学进展,2011,32(2): 14-18.)
[9] FAN Qing,XIE Zhi-xun,LIU Jia-bo,et al.Establishment of Real-Time Fluorescent Quantitative PCR for Detection of Bovine Viral Diarrhea Virus [J].Progress in Veterinary Medicine,2010,31(10): 10-14.(范晴,谢芝勋,刘加波,等.牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立 [J].动物医学进展,2010,31(10): 10-14.)
[10] ZHANG Chun-ming,QIAO Chuan-ling,CHEN Yan,et al.Development of Real-Time Fluorescent Quantitative PCR for Detection ofMGene of Swine Influenza Viruses [J].Chinese Journal of Preventive Veterinary Medicine,2008,30(10): 805-810.(张春明,乔传玲,陈艳,等.猪流感病毒M基因实时荧光定量PCR诊断方法的建立 [J].中国预防兽医学报,2008,30(10): 805-810.)
[11] WANG Kai,PEI Zhi-hua,LI Fei.Estabilishment of Double RT-PCR for Detection of Classical Swine Fever and Porcine Reproductive and Respiratory Syndrome Virus [J].Journal of Jilin Agricultural University,2011,33(1): 64-68.(王开,裴志花,李菲.CSFV和PRRSV二联RT-PCR检测方法的建立 [J].吉林农业大学学报,2011,33(1): 64-68.)
[12] WANG Liang-yan,HONG Qi-hua,ZHANG Yao-zhou.Real-Time Quantitative PCR and Its Applications [J].Chinese Journal of Cell Biology,2004,26(1): 62-67.(王梁燕,洪奇华,张耀洲.实时定量PCR技术及其应用 [J].细胞生物学杂志,2004,26(1): 62-67.)
[13] Sykes J E,Allen J L,Studdert V P,et al.Detection of Feline Calicivirus,Feline Herpesvirus 1 andChlamydiapsittaciMucosal Swabs by Multiplex RT-PCR/PCR [J].Vet Microbiol,2001,81(2):95-108.
[14] Sykes J E,Studdert V P,Browning G F.Detection and Strain Differentiation of Feline Calicivirus in Conjunctival Swabs by RT-PCR of the Hypervariable Region of the Capsid Protein Gene [J].Arch Virol,1998,143(7):1321-1334.
[15] Helps C,Lait P,Tasker S,et al.Melting Curve Analysis of Feline Calicivirus Isolates Detected by Real-Time Reverse Transcription PCR [J].Journal of Virological Methods,2002,106(2):241-244.
[16] Wilhelm S,Truyen U.Real-Time Reverse Transcription Polymerase Chain Reaction Assay to Detect a Broad Range of Feline Calicivirus Isolates [J].Journal of Virological Methods,2006,133(1):105-108.
[17] Wardley R C,Gaskell R M,Povey R C.Feline Respiratory Viruses: Their Prevalence in Clinically Healthy Cats [J].J Small Anim Pract,1974,15(9): 579-586.
