肥大细胞Toll样受体4在人慢性牙周炎牙龈组织中的表达*
2013-12-01吕芳丽陆达明黄世光
蓝 田, 吕芳丽, 李 娟, 陆达明, 黄 博, 黄世光△
(1暨南大学医学院口腔医学系,广东广州510632;2中山大学医学院寄生虫教研室,广东广州510080)
传统认为肥大细胞主要参与IgE介导的过敏反应,肥大细胞作为效应和调节性免疫细胞在固有免疫的建立和适应性免疫反应的调节中发挥重要作用近年来受到了重视[1-2]。然而,肥大细胞在牙周炎免疫病理中的作用一直为人们所忽视。Toll样受体(Toll-like receptors,TLRs)是一类识别病原相关分子模式的识别受体(pathogen-associated molecule patterns,PMAPs),在固有免疫防御中起重要作用[3]。TLR4作为Toll样受体家族的重要成员,是革兰氏阴性菌细胞壁脂多糖成分的天然受体分子。我们在前期的研究中报道了人慢性牙周炎牙龈组织中肥大细胞的表达不仅数量显著增加,并见明显脱颗粒现象,提示肥大细胞的募集和脱颗粒可能参与宿主牙周感染免疫反应的病理过程[4-5]。然而,关于肥大细胞TLRs与牙周炎关系尚未见报道。本实验通过免疫荧光双染色的方法观察不同病变程度牙周炎牙龈组织及肥大细胞上TLR4的表达情况,分析肥大细胞TLR4与牙周炎症程度的相关性,探讨肥大细胞TLR4在牙周炎发病中的可能作用。
材料和方法
1 研究对象
1.1 牙周炎病例选择 选择2010年~2012年在暨南大学荔湾口腔教学医院牙周科门诊就诊的自愿接受本研究的牙周炎患者,年龄为25~65岁,其中男性37名(47岁±12岁),女性31名(43岁±12岁),各实验组在年龄、性别上差异无统计学意义。受试者均无糖尿病和其它系统疾病;6个月内无服用抗生素药物治疗;无食物、药物过敏史;非孕妇或服用避孕药的妇女;1年内没有进行牙周手术治疗。纳入标准依据美国牙周病学会1999年的牙周病新分类指南[6];所有受试者均签署知情同意书。
1.2 分组 (1)正常对照组:无牙周袋,无附着丧失,X线片显示无牙槽骨吸收,牙龈无炎症;(2)轻度牙周炎组:牙龈有炎症,探针出血,牙周袋≤4 mm,附着丧失≤2 mm,X线片显示牙槽骨吸收不超过根长的1/3,可有或无口臭;(3)重度牙周炎组:牙周袋>6 mm,附着丧失≥5 mm,X线片显示牙槽骨吸收超过根长的1/2,甚至达根长的2/3,多根牙有根分叉病变,牙齿多有松动,牙龈炎症明显或发生牙周脓肿。
1.3 取材 轻度牙周炎组23例,为需要接受临床牙冠延长术者;重度牙周炎组25例,取自无保留价值或预后极差的重度牙周炎需要拔除者;正常对照组20例,取自因正畸治疗需要拔除的牙周健康的前磨牙。
2 方法
2.1 组织标本采集、处理与观察 牙龈组织标本于4%中性甲醛液中固定48 h以上,制成颊舌向5μm厚度连续切片,HE染色,光学显微镜下观察牙龈组织学改变。由2名病理医师盲法观察,并对牙龈组织的炎症细胞浸润情况进行评分,求其平均值。炎症程度评分标准参照Huang等[7]的方法:0:无炎症细胞浸润;1:轻度炎症,炎症细胞局部呈小灶状浸润;2:中度炎症,炎症细胞呈灶状及片状浸润;3:重度炎症,炎症细胞在牙龈组织内呈弥漫性浸润。
2.2 TLR4免疫组织化学SP法染色及结果处理 免疫组化染色:采用免疫组织化学SP法对牙龈组织切片进行染色,Ⅰ抗TLR4(武汉博士德),稀释浓度为1∶100。采用SP法(试剂盒为 PV9002,北京中杉金桥生物技术有限公司)染色、DAB(DAB染色试剂盒,北京中杉金桥生物技术有限公司)显色剂显色,阴性对照采用PBS缓冲液代替I抗,苏木素复染。组织化学法染色阳性信号为棕黄色细小颗粒,定位于细胞核或细胞浆。对每个切片标本中阳性细胞进行记数。每个切片记数5个400倍视野下总细胞数及阳性细胞数,计算阳性细胞比例(%),取其平均值。
2.3 肥大细胞和TLR4免疫荧光双染色法及结果处理 采用免疫荧光双染色法对牙龈组织切片进行染色。Ⅰ抗:tryptase抗体(Abcam),稀释浓度为1∶200;TLR4抗体(武汉博士德),稀释浓度为1∶100。Ⅱ抗:山羊抗鼠IgG(H+L)Alex Flour® 555和山羊抗兔IgG(H+L)Alex Flour®488(Cell Signaling Technology),稀释浓度为1∶200。免疫荧光阳性信号为肥大细胞表达绿色荧光,TLR4表达红色荧光,定位于细胞核或细胞浆,同一视野肥大细胞与TLR4重叠后为黄色荧光。染色切片由2名病理医师于免疫荧光显微镜观察表达TLR4的肥大细胞数量,取其平均值。每张切片在高倍视野(×400)下选取黄色荧光细胞数目最多的5个视野进行计数,计算5个视野中表达TLR4的肥大细胞的总数。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件分析。牙龈组织炎症程度评分的组间比较采用Kruskal-Wallis检验;牙龈组织TLR4阳性细胞比例和TLR4阳性肥大细胞数量的组间比较采用完全随机设计的单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 组织学分析
牙龈组织的组织学改变见图1,正常对照组未见炎症细胞浸润(图1A);轻度牙周炎组见少量散在炎症细胞浸润(图1B);重度牙周炎组有明显的炎性细胞浸润,出现大范围的淋巴细胞、浆细胞和肥大细胞浸润,可见散在分布的巨噬细胞样细胞及多形核细胞(图1C)。重度牙周炎组炎症程度评分明显高于轻度牙周炎组(P<0.05)。
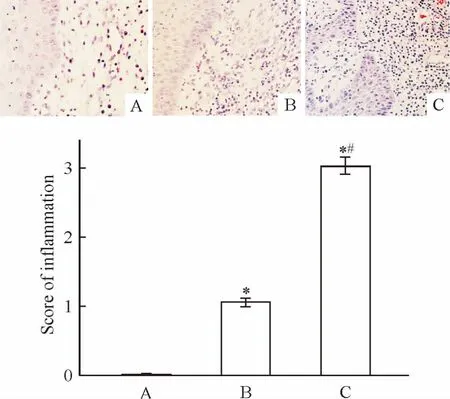
Figure 1.Histological changes of human gingival tissues(HE staining,× 400)and their scores of inflammation.A:healthy control group(n=20);B:mild chronic periodontitis group(n=23);C:severe chronic periodontitis group(n=25).Mean±SD.*P<0.05 vs A;#P<0.05 vs B.图1 各组牙龈组织的组织学变化和炎症程度评分
2 牙龈组织TLR4免疫组织化学染色结果
牙龈组织TLR4免疫组化染色结果见图2,正常对照组牙龈组织可见散在分布数量较少的TLR4表达(图2A);轻度牙周炎组牙龈组织中TLR4阳性细胞数明显增加(图2B);重度牙周炎组牙龈组织见大量的TLR4表达(图2C)。与正常对照组相比较,牙周炎组的TLR4明显上升(P<0.05);重度牙周炎组的TLR4阳性细胞比例显著高于轻度牙周炎组(P<0.05)。
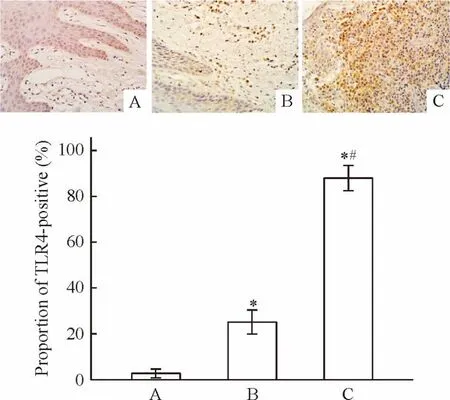
Figure 2.Expression of TLR4 in human gingival tissues(immunohistochemical staining,×400).A:healthy control group(n=20);B:mild chronic periodontitis group(n=23);C:severe chronic periodontitis group(n=25).Mean±SD.*P<0.05 vs A;#P<0.05 vs B.图2 免疫组织化学染色检测各组牙龈组织中TLR4的表达
3 肥大细胞和TLR4免疫荧光双染色结果
各组牙龈组织肥大细胞和TLR4免疫荧光双染色结果见图3。正常对照组牙周组织中可见小量散在分布的肥大细胞和TLR4阳性表达的肥大细胞(图3A);轻度牙周炎组牙龈组织中肥大细胞数和TLR4阳性肥大细胞数明显增加(图3B);重度牙周炎组牙龈组织中见大量的肥大细胞和TLR4阳性肥大细胞(图3C)。与正常对照组相比,牙周炎组TLR4阳性表达的肥大细胞数量明显上升(P<0.05);重度牙周炎组TLR4阳性表达的肥大细胞的数量显著多于轻度牙周炎组(P<0.05)。
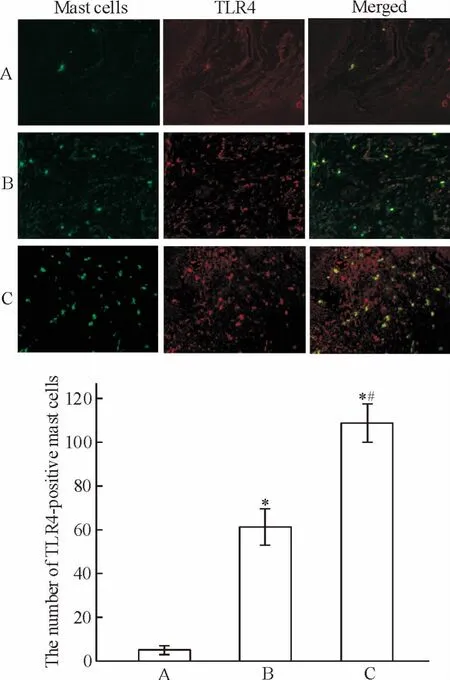
Figure 3.Expression of TLR4 on mast cells in human gingival tissues(immunofluorescet staining, × 400).A:healthy control group(n=20);B:mild chronic periodontitis group(n=23);C:severe chronic periodontitis group(n=25).Mean±SD.*P<0.05 vs A;#P<0.05 vs B.图3 免疫荧光染色检测各组牙龈组织中肥大细胞TLR4的表达
讨 论
Toll样受体是一类广泛存在于哺乳动物细胞内的生物模式识别受体,能够识别各种微生物表面的高度保守结构,如细菌脂多糖、肽聚糖、脂蛋白、细菌DNA、双链 RNA等。TLRs信号通过上调抗原提呈细胞(antigen-presenting cell,APC)表面的共刺激分子及APC分泌的炎症细胞因子,诱导T、B淋巴细胞向效应 T、B淋巴细胞分化,调节适应性免疫反应[8-9]。研究发现中性粒细胞、淋巴细胞、巨噬细胞及单核细胞均表达TLRs,可识别不同的病原体,并在病原体入侵时快速激活固有免疫,引起炎症反应,杀灭入侵的病原体[10]。TLR4是Toll样受体家族中最早被发现的成员之一,主要识别革兰氏阴性菌细胞壁脂多糖结构[11]。牙周病主要是革兰氏阴性厌养菌如牙龈卟啉单胞菌(Porphyromonas gingivalis)等对牙周组织所致慢性病理损害的结果。研究显示,牙周炎患者牙周组织中TLR2、3、4和9的表达均高于牙周健康者[12-13],其中TLR2基因多态性与日本人群侵袭性牙周炎密切相关[14],而TLR2和TLR4在血脂异常性牙槽骨破骨细胞分化中起着重要作用[15]。在牙周炎组织中,研究发现TLR4主要表达于结缔组织中;而在牙周炎患者临床相对健康的牙龈组织和健康牙龈组织中,未发现TLR4的表达,提示TLR4参与了牙周炎的免疫过程[16]。研究还显示TLR4在人牙龈成纤维细胞上的表达水平影响牙龈组织的炎症反应程度[17]。本研究采用免疫组化方法观察到TLR4阳性细胞在慢性牙周炎结缔组织中的比例较正常对照组明显增大,重度慢性牙周炎组TLR4表达的程度明显高于轻度慢性牙周炎组,提示TLR4与牙周炎症程度密切相关。
近年人们认识到肥大细胞具有独特的免疫性能,除了在过敏和自身免疫性疾病中发挥重要作用外,还是重要的效应和调节性免疫细胞,能够启动快速而持续的免疫反应,对固有免疫和适应性免疫均有重要作用[18-19]。肥大细胞膜表面的TLRs受体,能够识别广泛的病原体产物以及损害相关分子模式[20];而且,肥大细胞被激活后除了可新合成介质外,还预先储备了大量的介质如组胺、蛋白酶、细胞因子(如 IFN-γ、TNF-α、IL-4、IL-5、IL-6、IL-10、IL-13、IL-16)和趋化因子等,一旦遇到相应的刺激,肥大细胞立即释放介质并启动固有免疫反应,引起炎症反应或参与机体的防御反应[21-22]。细菌成分和炎症细胞因子均可调节肥大细胞表面TLR4的表达,肥大细胞TLRs被激活后,不仅与其抗菌防御和炎症反应的进展有关,也影响过敏反应的进程[23]。研究发现,TLRs被激活后可导致Th1型细胞因子的产生以及Th1细胞极化[24];人和小鼠肥大细胞表面的TLR4受体可协同作用调节FcεRⅠ介导的肥大细胞信号通路,促进肥大细胞脱颗粒以及释放Th2细胞因子[25]。本研究采用免疫荧光双染色法证实了人慢性牙周炎牙龈组织的肥大细胞表达TLR4,我们的观察发现重度牙周炎牙龈组织中,肥大细胞TLR4的表达率远高于轻度牙周炎组,提示肥大细胞TLR4可能参与牙周组织的炎症反应,在牙周炎的发病和疾病进程中起着重要的作用。但牙周炎组织内的肥大细胞如何通过TLR4识别牙周致病菌抗原而调节牙周病,以及肥大细胞如何通过TLR4信号转导途径调节牙周病发生和发展的作用机制尚需进一步研究。
