急性白血病细胞系中SFRP基因启动子甲基化及去甲基化诱导表达的研究
2013-12-01徐成波皇甫真萍陈毅宁陈佳薇沈建箴
徐成波, 冯 敏, 廖 斌, 皇甫真萍, 齐 彦, 陈毅宁, 陈佳薇, 沈建箴
(1福建中医药大学附属人民医院血液科,福建福州350004;2福建省立医院北院,福建省老年医院内分泌科,福建福州350001;3福建医科大学附属协和医院血液科,福建福州350001)
Wnt信号通路的过度激活参与了人类多种肿瘤的形成,被认为是肿瘤发生过程中的关键信号通路。分泌型卷曲相关蛋白(secreted frizzled-related protein,SFRP)作为Wnt信号通路的胞外拮抗物,能通过多种机制抑制经典和非经典的Wnt通路[1],阻断异常激活的Wnt信号,促进肿瘤细胞凋亡,达到抑制肿瘤的形成与发展。为了探讨SFRP基因家族启动子CpG岛异常甲基化状态在急性白血病(acute leukemia,AL)发生发展中的作用,本研究拟采用甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction,MSP)的方法检测白血病细胞系和不同浓度的5-氮杂-2’-脱氧胞苷酸(5-aza-2’-deoxycytidine,5-Aza-CdR)作用下 Jurkat细胞中 SFRP1、SFRP2、SFRP4和SFRP5基因启动子区的甲基化,并检测 SFRP1、SFRP2、SFRP4、SFRP5、DNA 甲基转移酶(DNA methyltransferase,DNMT)1、DNMT3A 和 DNMT3B mRNA表达的变化,以期从表观遗传学水平揭示AL的发病机制。
材料和方法
1 材料
实验用急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)细胞为Molt-4和 Jurkat细胞,急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)细胞为HL-60和NB4细胞,均由福建省血液病研究所传代保存。
小牛血清(杭州四季青公司);RPMI-1640培养基(Gibco);5-Aza-CdR、蛋白酶K、RNA酶、亚硫酸氢钠和氢醌(Sigma);淋巴细胞分离液和酚-氯仿DNA抽提液(上海生物工程公司);焦碳酸二乙酯(DEPC)和Trizol试剂(上海生物工程公司);Wizard DNA树酯纯化试剂盒(Promega);Platinum® SYBR® Green qPCR SuperMix-UDG试剂盒(Invitrogen);2×Taq PCR Master Mix试剂(北京博迈德生物公司);DNA marker(厦门鹭隆生物有限公司)。引物由Invitrogen合成。
37℃、饱和湿度、5%CO2培养箱(Heal Force);DU-640紫外分光光度仪(Beckman Coulter);Gel Doc 1000凝胶图像分析仪(Bio-Rad);7700型PCR扩增仪和7500型荧光定量PCR仪(Applied Biosystems)。
2 方法
2.1 细胞培养及干预实验 所用AL细胞均常规复苏后,用含10%胎牛血清的RPMI-1640培养液(pH 7.2),于37℃、饱和湿度、5%CO2培养箱中培养,隔天传代1次,实验用细胞为对数生长期细胞。SFRP基因去甲基化实验中,取对数生长期的Jurkat细胞,调整细胞浓度为1×109/L,并接种于培养瓶中,未处理组细胞即不加药培养72 h作为空白对照,其余分别加入5-Aza-CdR 1μmol/L、2μmol/L和4μmol/L处理,共培养72 h,用药结束后,收集各组细胞,进行DNA和RNA的提取,用于进一步的研究。
2.2 正常人骨髓或外周血单个核细胞的提取 骨髓穿刺检查或抽取外周血时,留取骨髓标本或外周血2 mL,肝素抗凝。在离心管中加入2倍体积的淋巴细胞分离液,颠倒混匀。将骨髓标本或血标本离心20 min。离心后,上层为血清,中间层为单个有核细胞,下层为红细胞和血小板。小心吸取中间层的单个核细胞,洗涤离心后备用。
2.3 细胞基因组DNA的提取 收集各实验组细胞以及正常人骨髓或外周血单个核细胞,常规酚-氯仿法提取细胞基因组DNA,并通过紫外分光光度仪鉴定其含量及纯度。用去离子水溶解后于-20℃保存。
2.4 基因组DNA的亚硫酸氢盐修饰与纯化 参考Herman等[2]的方法并加以改进,取1~2μg DNA溶解于50μL去离子水中,加3 mol/L NaOH 5.5μL,37℃水浴30 min。向碱变性的DNA中加入新配置的10 mmol/L氢醌30μL和3 mol/L亚硫酸氢钠520 μL,以矿物油3滴覆盖液面,50℃水浴16 h。再用Wizard DNA Clean-Up System纯化,纯化后的DNA加3 mol/L NaOH 5.5μL,室温放置15 min,用预冷的70%乙醇沉淀DNA,并以30μL去离子水溶解,-20℃储存备用。
2.5 MSP检测 取经亚硫酸氢钠修饰后的DNA 3 μL为模板,采用25μL体系进行扩增,体系包含12.5μL的2×Taq PCR Master Mix,甲基化或非甲基化的上、下游引物各0.5μL,补足水至25μL。反应条件为95℃预变性4 min,95℃ 45 s,60℃ 30 s,72℃ 30 s,共35个循环,72℃ 10 min。同时,以修饰后的正常人骨髓或外周血单个核细胞DNA为非甲基化阴性对照,将已经证实均存在 SFRP1、SFRP2、SFRP4和SFRP5基因高甲基化的人结直肠癌细胞系RKO细胞DNA为甲基化阳性对照[3],H2O作空白对照。将PCR产物于2%琼脂糖凝胶电泳,在凝胶图像分析仪上自动分析成像。应用甲基化引物扩增出基因甲基化产物的细胞,定为该基因完全甲基化;应用非甲基化引物扩增出基因非甲基化产物的细胞,定为该基因完全非甲基化;同时可扩增出甲基化和非甲基化产物的细胞,定为该基因部分甲基化。
2.6 实时荧光定量RT-PCR检测SFRP mRNA的表达水平 各组细胞至培养终点后以Trizol试剂一步法提取细胞总RNA,并鉴定RNA的完整性。以2μg RNA为模板逆转录合成cDNA,实时定量RT-PCR采用7500型荧光定量PCR仪和Platinum® SYBR®Green qPCR SuperMix-UDG试剂盒进行PCR扩增,以GAPDH为内参照。采用与GAPDH比较Ct值的方法来定量mRNA表达水平,实验重复3次。
2.7 半定量RT-PCR检测DNMT1、DNMT3A和DNMT3B mRNA的表达水平 采用7700型PCR扩增仪和2×Taq PCR Master Mix试剂盒进行PCR扩增,以GAPDH为内参照,将PCR产物于2.0%琼脂糖凝胶电泳,在凝胶图像分析仪上自动分析成像,以目的条带与GAPDH条带的吸光度比值进行半定量分析,实验重复3次。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示,SPSS 17.0统计软件分析数据,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 AL细胞系中SFRP基因的甲基化状态
在 Molt-4、Jurkat、HL-60 和 NB4 细胞中,应用甲基化引物可扩增出的 SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化产物特异性条带,同时应用非甲基化引物在HL60细胞中可扩增出SFRP4基因的非甲基化产物,表明 SFRP1、SFRP2、SFRP4和SFRP5基因在Molt-4、Jurkat和NB4细胞中均呈完全甲基化状态,而 HL-60细胞中 SFRP1、SFRP2和SFRP5呈完全甲基化状态,而SFRP4基因呈部分甲基化状态,见图1。正常人骨髓或外周血单个核细胞应用非甲基化引物可扩增出SFRP1、SFRP2、SFRP4和SFRP5基因的非甲基化特异性条带,而甲基化引物不能扩增出特异性产物,表明正常人细胞中SFRP基因均呈非甲基化状态。
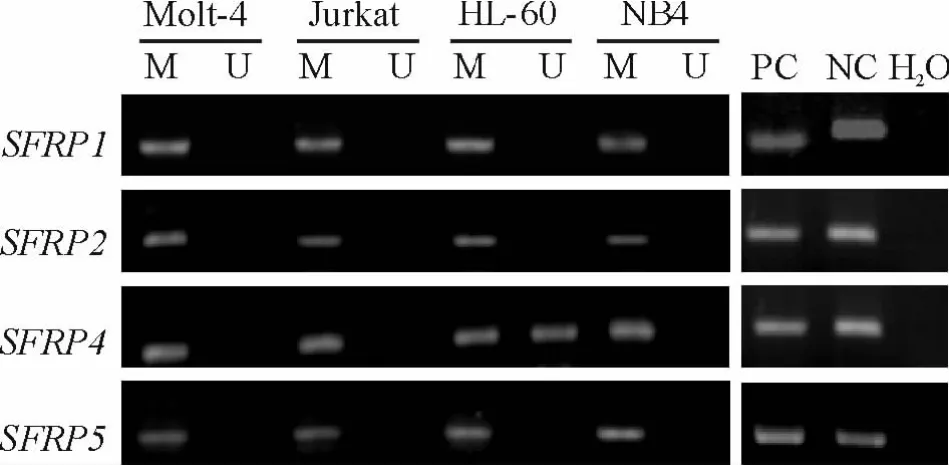
Figure 1.MSP analysis of SFRP1,SFRP2,SFRP4 and SFRP5 genes in Molt-4,Jurkat,HL-60 and NB4 cell lines.M:methylated;U:unmethylated;NC:negative control;PC:positive control;H2 O:blank control.图1 4种AL细胞中SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化分析
2 SFRP2基因甲基化MSP产物的序列分析
为了证实MSP分析基因甲基化的可靠性,随机挑选了SFRP2基因甲基化引物扩增的PCR产物,经T-A克隆后测序。测序结果证明该MSP产物是野生型(wild-type)SFRP2基因启动子区的部分序列,其分析结果完全可靠。甲基化的SFRP2基因,其CpG岛二核苷酸中的胞嘧啶(C)碱基未被亚硫酸氢盐硫化改变,仍为C碱基;而在非CpG岛中的C碱基经亚硫酸氢盐修饰后都转变成胸腺嘧啶(T)碱基,见图2。
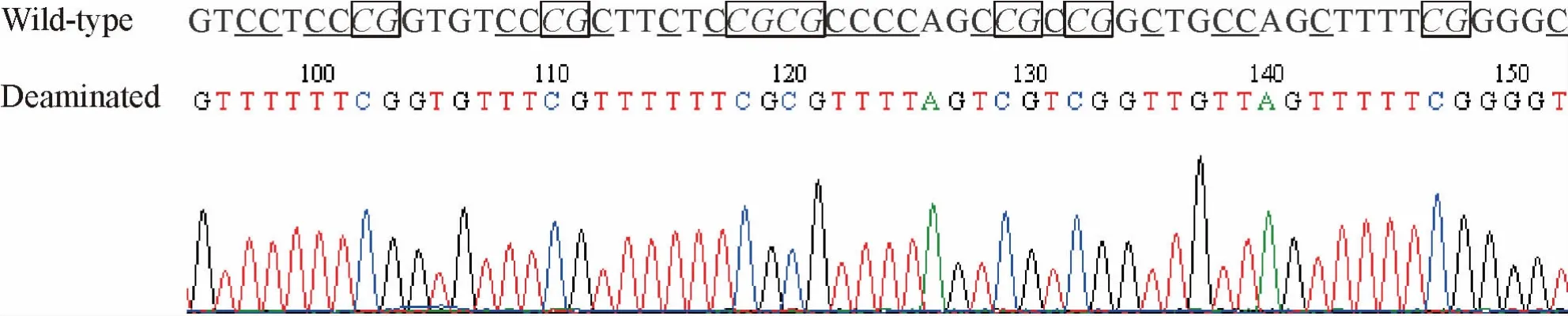
Figure 2.Sequence analysis of the MSPproduct of methylated SFRP2 gene after bisulfite treatment.Wild-type cytosine(C)residues that were methylated in CpGislands(framed)remained unchanged,and Cresidues that were unmethylated were changed to thymidine(T)by bisulfite-induced deamination(underlined).图2 SFRP2基因甲基化MSP产物的序列分析
3 Jurkat细胞经5-Aza-Cd R处理后SFRP基因甲基化水平的改变
用不同浓度5-Aza-CdR处理Jurkat细胞72 h后,MSP分析显示,随着5-Aza-CdR浓度的升高,SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化水平(吸光度值)逐渐降低,见图3,提示SFRP基因的高甲基化状态被逆转。
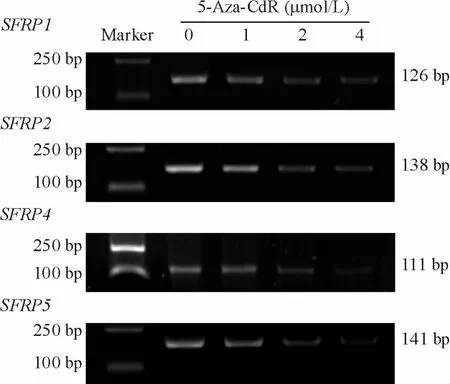
Figure 3.MSPanalysis of SFRP genes in Jurkat cell line before and after treatment with 5-Aza-CdR for 72 h.图3 5-Aza-Cd R处理Jurkat细胞后SFRP基因甲基化水平的变化
4 Jurkat细胞经5-Aza-Cd R处理后SFRP mRNA表达水平的改变
4 μmol/L 5-Aza-CdR 组中SFRP1、SFRP2、SFRP4和SFRP5 mRNA表达水平均明显升高,分别是未处理组中表达水平的4.6、3.5、2.3和4.2倍(均P<0.01),见图4,提示SFRP基因的高甲基化状态被逆转后,甲基化沉默的SFRP基因被激活转录。
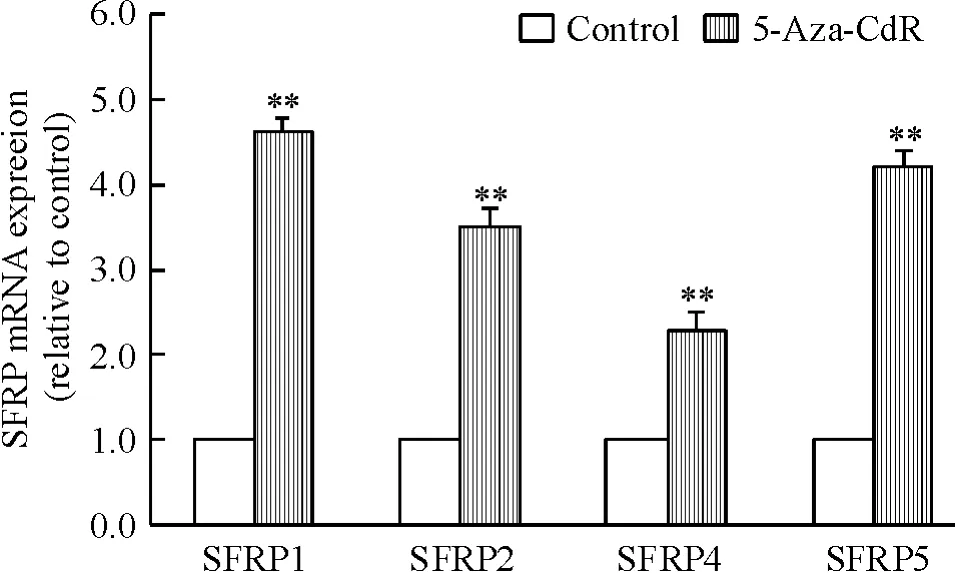
Figure 4.The mRNA expression levels of SFRP in Jurkat cell line before and after treatment with 5-Aza-CdR at the concentration of 4 μmol/L.Mean±SD.n=3.**P <0.01 vs control.图4 5-Aza-CdR处理Jurkat细胞72 h后SFRP mRNA表达水平的变化
5 Jurkat细胞经5-Aza-Cd R处理后DNMT1、DNMT3A和DNMT3B mRNA表达水平的变化
半定量RT-PCR检测发现,随着5-Aza-CdR浓度升高以及SFRP基因甲基化水平的降低,DNMT1、DNMT3A和DNMT3B mRNA的表达水平均有下调,且呈剂量依赖性,各药物作用组与未处理组比较,差异均有统计学意义(P<0.05),见图5。
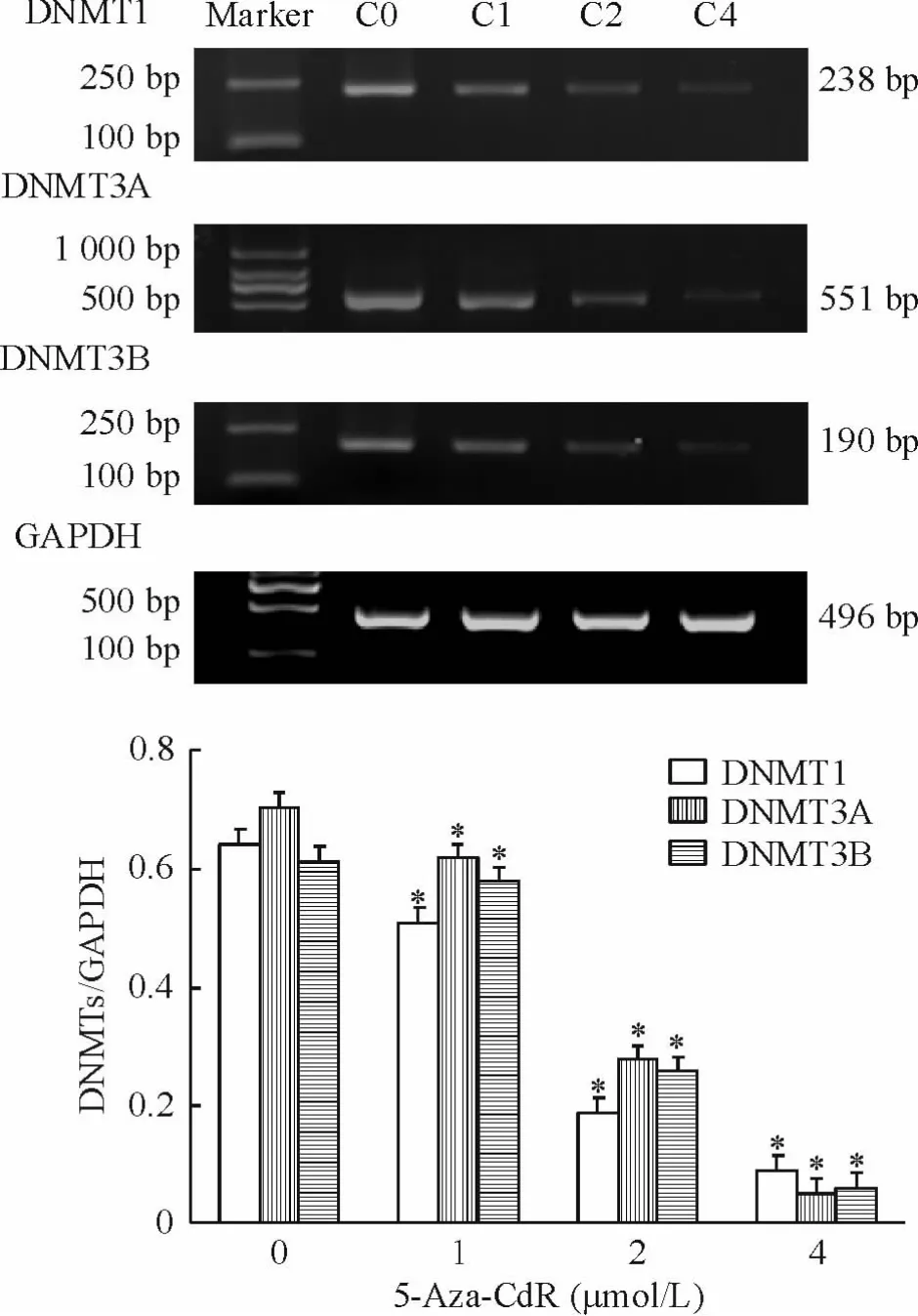
Figure 5.Semiquatitative RT-PCR analysis of DNMT1,DNMT3A and DNMT3B mRNA expression in Jurkat cell line before and after treatment with 5-Aza-CdR for 72 h.Mean±SD.n=3.*P<0.05 vs 0μmol/L.图5 5-Aza-CdR处理Jurkat细胞后DNMT1、DNMT3A和DNMT3B mRNA表达水平的变化
讨 论
DNA甲基化是真核生物基因组最常见的一种表观遗传学修饰方式,它对X染色体灭活[4]、基因组印迹[5]、DNA 修复[6]和基因表达调控[7]等起着非常重要的作用。基因组特定序列的低甲基化或高甲基化都会使基因的表达发生变化。大约90%的DNA甲基化发生在启动子区的CpG岛,正常生理条件下绝大部分启动子CpG岛均处于非甲基化状态,一旦基因的CpG岛发生高甲基化将直接导致基因的转录失活。
Wnt信号通路调控着细胞的增殖、分化、极化、凋亡与抗凋亡等许多生命过程[8]。研究表明,Wnt异常信号通路激活癌症的重要机制是一种或多种可溶性Wnt抑制基因的甲基化沉默所致,SFRP作为Wnt信号通路的负调控因子,其基因表达下调可引起Wnt信号通路持续异常激活,从而最终引起包括胃肠道肿瘤、黑色素瘤、非小细胞肺癌、乳腺癌及间皮瘤等肿瘤的发生,被认为是肿瘤发生过程中的关键信号通路[9]。
SFRP作为Wnt信号途径的“门户”,在正常情况下能有效地抑制Wnt途径的异常激活。但是,在SFRP基因发生甲基化沉默后则失去这种作用[10]。Chim等[11]利用骨髓瘤细胞株及原发性骨髓瘤标本研究Wnt信号通路的激活情况,发现在4组细胞株中,LP1及WL2细胞株存在Wnt信号的异常激活,且与多种Wnt抑制基因超甲基化沉默有关,去甲基化后抑制基因可重新恢复表达,Wnt通路活化水平也开始下调。同时,在初发多发性骨髓瘤(multiple myeloma,MM)患者中,有42%的患者存在至少一种抑制基因的甲基化,其中61.9%有2种以上抑制基因的甲基化。Jost等[12]对76例初治MM患者的SFRP基因进行甲基化检测,发现有35.5%的 SFRP1、52.6%的SFRP2、1.3%的SFRP4和6.9%的SFRP5存在高甲基化,而且SFRP5的高甲基化可能与疾病的进展有关。Liu等[13]在对20例慢性B淋巴细胞白血病患者的研究中发现,SFRP基因普遍存在DNA甲基化沉默,SFRP1、SFRP2和SFRP5基因基因的甲基化比率分别是100%、55%、30%和15%。
本研究应用 MSP技术检测发现,SFRP1、SFRP2、SFRP4 和 SFRP5 基因在 Molt-4、Jurkat和NB4细胞中均呈完全甲基化状态,而HL-60细胞中SFRP1、SFRP2和SFRP5基因呈完全甲基化状态,SFRP4基因呈部分甲基化状态,因此推测,SFRP基因在AL中发生高频率甲基化。
白血病的DNA去甲基化治疗已成为AL治疗研究的新热点[14]。去甲基化药物5-Aza-CdR是美国FDA批准的第一批用于治疗MDS的表观遗传药物。5-Aza-CdR过去主要作为抗肿瘤细胞毒药物使用,阻断细胞向S期转化。本实验发现5-Aza-CdR作用Jurkat细胞72 h后,随着药物终浓度的增加,SFRP mRNA的表达水平随着甲基化程度的降低而增高,这表明SFRP基因去甲基化后重新恢复表达。与此同时,DNMT1、DNMT3A和DNMT3B mRNA表达水平也呈剂量依赖性的表达下调。由于5-Aza-CdR是核苷类似物,磷酸化后能与DNMT形成共价复合物,抑制其与DNA结合发挥甲基化活性,从而诱导DNA去甲基化[15]。因此,推测5-Aza-CdR可能通过抑制DNMT表达,阻断DNMT转移S-腺苷蛋氨酸的甲基于CpG岛的5-胞嘧啶上而逆转DNA启动子区CpG岛的甲基化,重新激活因高甲基化而处于沉默的SFRP基因,而达到去甲基化激活转录的作用。但是由于5-Aza-CdR对基因的去甲基化作用缺乏细胞特异性,它在治疗异常甲基化的同时,可能会引起处于抑制状态的某些基因恢复活性,导致正常基因调控机制的紊乱,所以5-Aza-CdR广泛应用于临床还需要进一步的探索。
