慢病毒介导的caspase-3沉默对大鼠骨髓间充质干细胞增殖和凋亡的影响*
2013-12-01刘家良杨淞然江慧琦杨艳旗
华 平, 刘家良, 杨淞然, 江慧琦, 王 萌, 陶 俊, 杨艳旗
(1中山大学孙逸仙纪念医院心胸外科,广东广州510120;2广州市第一人民医院脑内科,广东广州510180)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,能分泌多种生物活性因子,且来源丰富,免疫原性低,是治疗心肌梗死的理想种子细胞,可阻止心室重构,改善心功能[1-2],在心肌梗死的的细胞治疗和基因治疗中有着巨大的应用价值。但移植后缺血缺氧的局部微环境导致MSCs增殖和存活能力受限[3],从而限制了干细胞移植的治疗效果。因此,促进细胞在非理想环境下的增殖能力,尤其是抗凋亡能力成为目前的研究热点。半胱氨酸天冬氨酸蛋白酶3(caspase-3)是细胞凋亡过程中的关键执行者[4]。本实验采用前期研究中筛选出来的针对caspase-3干扰效果最好的靶点序列构建shRNA表达载体[5],通过慢病毒介导的方法转染MSCs,观察沉默caspase-3后MSCs的增殖能力、细胞周期变化和抗凋亡能力。
材料和方法
1 材料
SPF级3周龄Sprague-Dawley大鼠由中山大学北校区动物中心提供。胎牛血清和DMEM/F12培养基(HyClone),小鼠抗大鼠CD29流式抗体(BD),小鼠抗大鼠CD45和CD90流式抗体(eBioscience),慢病毒载体GV115(上海吉凯基因),MTS试剂盒(Promega),细胞周期检测试剂盒(南京凯基),SYBR Green PCR Master Mix(Toyobo),Trizol(Invitrogen),兔抗大鼠 caspase-3单克隆抗体(Anbo),Hoechst 33258(碧云天生物技术研究所)
2 方法
2.1 MSCs的培养与鉴定 颈椎脱臼法处死SD大鼠,75%乙醇浸湿5 min。超净台上取双侧股骨、胫骨,去除骨骺,注射器吸取培养基反复冲洗骨髓腔。收集冲洗液制成单细胞悬液,离心(1 500 r/min,10 min),弃上清,加入含10%胎牛血清的DMEM/F12完全培养基,吹打细胞,计数,以1×1010/L的密度接种,置37℃、5%CO2培养箱中培养。接种48 h后首次换液,以后每3 d换液,直至细胞长满80% ~90%,0.25%胰酶消化并按1∶3传代。经多次换液传代纯化MSCs。流式细胞术检测P2代CD29、CD45和CD90的表达以鉴定MSCs。
2.2 构建慢病毒载体与细胞感染 根据前期实验结果,选取针对caspase-3干扰效果最好的靶点序列:5'-GCCGACTTCCTGTATGCTTAC-3',合成表达 shRNA的2条互补DNA单链:5'-CCGGGCCGACTTCCTGTATGCTTACCTCGAGGTAAGCATACAGGAAGTCGGC-TTTTTG-3',5'-AATTCAAAAAGCCGACTTCCTGTATGCTTACCTCGAGGTAAGCATACAGGAAGTCGGC-3'。上述单链退火形成双链,连接到线性化载体GV115后转化DH5α感受态细胞,提取质粒进行酶切鉴定并测序。再用293T细胞包装病毒。取良好生长状态的MSCs以(3~5)×106/L的密度接种,细胞融合率为30%~50%时进行病毒感染。同时制备空载体作为对照,并将实验分为空白对照组、空载体组和转染组(由广州莱德尔生物科技有限公司完成)。
2.3 Real-time PCR 检测 caspase-3、bcl-2和 bax mRNA的表达 收集细胞,Trizol试剂盒抽提总RNA,逆转录合成cDNA,取5μL逆转录产物进行扩增反应。使用荧光定量PCR仪,采用SYBR Green染料法,以β-actin为内参照。引物设计见表1。反应条件:95℃预热5 min,95 ℃变性15 s,60℃退火15 s,72 ℃延伸32 s,40个循环。

表1 引物序列Table 1.Primer sequences
2.4 Western blotting检测caspase-3蛋白的表达 收集细胞离心(1 000 r/min,5 min),弃上清,根据细胞量加入相应的提取缓冲液,收集裂解液,BCA法测定蛋白浓度。配置5%浓缩胶和10%分离胶进行SDS-PAGE电泳。电泳产物转移至PVDF膜,5%脱脂奶粉溶液封闭,加入兔抗大鼠 I抗(caspase-3 1∶1 000,GAPDH 1∶1 000),37 ℃孵育2 h,TBST 洗膜5 min×3次,加山羊抗兔 IgG II抗(1∶5 000),37 ℃孵育1 h,TBST洗膜5 min×3次。DAB显色。用Quantity One软件对蛋白条带进行半定量分析。
2.5 MTS检测细胞增殖 取对数生长期的细胞配置成1×108/L细胞悬液接种,每孔100μL,放置37℃、5%CO2培养箱中培养。待细胞贴壁后,收集各个时点的细胞(24 h、48 h、72 h、96 h 和 120 h)加入MTS,比例为1∶10。孵育4 h后,酶标仪读取 A490数据。细胞增殖率=(实验组A490值-A0)/A0×100%。A0为实验组第1天的A490值。
2.6 流式细胞术检测细胞周期 常规消化细胞,用预冷PBS洗2次,加入预冷70%乙醇,4℃固定过夜。离心收集细胞,以1 mL PBS洗细胞1次,加入500μL PBS含50 mg/L溴化丙啶,100 mg/L RNase A,0.2%Triton X-100,4℃避光孵育30 min。以标准程序用流式细胞仪检测,计数(2~3)×104个细胞,结果用细胞周期拟和软件ModFit分析。
2.7 流式细胞术检测细胞凋亡率 用PBS溶液轻轻润洗培养板内细胞,去除PBS溶液;加入0.5 mL不含EDTA的0.25%胰酶,孵育,直至显微镜下观察到细胞开始从培养板壁脱落;轻轻连续拍打使细胞从培养板壁上完全脱落;将细胞轻轻重悬于预冷的缓冲液中,密度为1×109/L;转移0.5 mL细胞悬液到干净的离心管内;加入1.25μL Annexin V-APC,室温避光反应 15 min;室温离心(1 000 r/min,5 min),去除上清;0.5 mL预冷结合缓冲液将细胞重悬;加入10μL溴化丙啶,冰上避光保存,流式细胞仪检测分析。
2.8 Hoechst染色检测细胞凋亡 细胞以5×104/L密度接种于用12孔培养板中,每孔1 mL,37℃、5%CO2孵箱中培养,至细胞爬片。加入1 mL 4%甲醛溶液,4℃固定细胞10 min。去固定液,PBS洗5 min×3次,自然晾干。滴加100μL Hoechst 33258工作液(1 mg/L),室温染色10 min。PBS洗5 min×3次。滤纸沾去多余液体,加抗荧光淬灭封片液,封片后荧光显微镜下观察并拍照。
3 统计学处理
采用SPSS 13.0软件处理,数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 细胞培养与鉴定
首次换液后见大量贴壁细胞,部分伸出伪足呈短棒状。3~4 d贴壁细胞增多,细胞集落形成。9~10 d细胞融合成片,沿胞体长轴有序排列,呈旋涡状。通过传代逐渐纯化MSCs,见图1。免疫表型鉴定显示表面标志 CD29和 CD90的阳性率分别为 93.31%和93.45%,造血系统细胞表面标志物CD45的阳性率为5.69%,见图2,表明获得的细胞为MSCs。

Figure 1.Morphology of MSCs(×40).The third-generation MSCs were morphologically consistent,long spindle,arranged in a radial or spiral shape and showed colony growth under phase-contrast microscopy.图1 MSCs的形态

Figure 2.Identification of MSCs图2 MSCs鉴定结果
2 Real-time PCR和Western blotting检测caspase-3 mRNA和蛋白表达水平
经慢病毒介导方法导入质粒后,转染组、空载体组和空白对照组mRNA相对表达量分别为0.39±0.06、1.66 ±0.17 和1.91 ±0.31(P <0.01),转染组的表达量仅为对照组的23.49%和20.31%,干扰效率为76.51%和79.69%,见图3。通过灰度值分析,转染组、空载体组和空白对照组的蛋白表达量分别为0.19 ±0.09、0.49 ±0.16 和 0.48 ± 0.14(P <0.05),转染组的蛋白表达量降低了61%和60%,见图4,说明caspase-3的表达得到了很好的抑制。
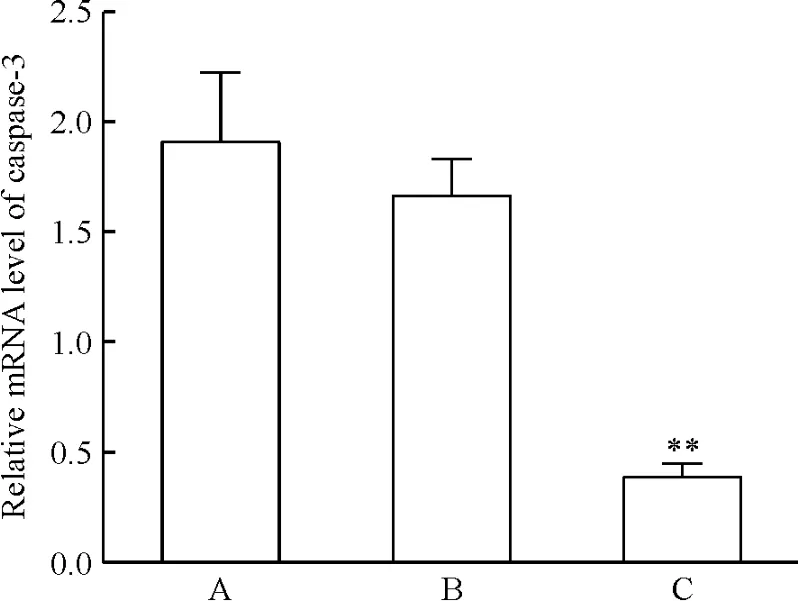
Figure 3.Expression of caspase-3 mRNA.A:MSCs;B:MSCsvector;C:MSCs-shRNA.Mean ± SD.n=3.** P <0.01 vs A or B.图3 Caspase-3 mRNA的表达
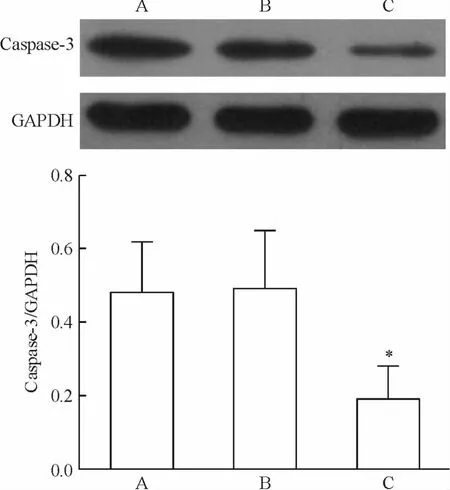
Figure 4.Expression of caspase-3 protein.A:MSCs;B:MSCsvector;C:MSCs-shRNA.Mean ± SD.n=3.*P <0.05 vs A or B.图4 Caspase-3蛋白的表达情况
3 细胞增殖
除第1天外,转染组的增殖率在各时点均明显高于对照组(均P<0.05),而两对照组之间无明显差异(P>0.05),见图5,证实慢病毒系统本身对MSCs的增殖能力无显著影响,而沉默caspase-3能加快细胞生长。

Figure 5.Proliferative curves of MSCs-shRNA,MSCs-vector and MSCs.Mean ± SD.n=3.*P < 0.05 vs MSCs or MSCs-vector.图5 细胞增殖曲线
4 细胞周期
与空载体组和空白对照组相比,转染组S期细胞百分比明显升高(P<0.01),G0/G1期和G1/G2期细胞百分比下降(均P<0.05),对照组之前差异无统计学意义(P>0.05),沉默caspase-3后MSCs主要停留在S期,见图6和表2。

Figure 6.Cell cycle detected by flow cytometry.A:MSCs;B:MSCs-vector;C:MSCs-shRNA.图6 流式细胞术检测细胞周期

表2 细胞周期变化Table 2.Changes of cell cycle(%.Mean±SD.n=3)
5 Real-time PCR检测bcl-2和bax mRNA表达水平
沉默caspase-3后,除caspase-3表达降低外,还观察到bcl-2表达上调(P<0.01),bax表达下调(P<0.01),bcl-2/bax比值升高(P <0.05),见图7。
6 细胞凋亡
流式细胞术检测各组细胞凋亡率显示,转染组的凋亡率低于对照组,见图8。Hoechst 33258染色后在荧光显微镜下观察到所有细胞的细胞核都呈现蓝色荧光,凋亡的细胞核染色质凝聚,细胞核浓缩,见图9。400倍镜下,各组细胞选取6个不同的视野进行阳性细胞计数,得出转染组的细胞凋亡率为(15.01 ±1.73)%,低于空载体组(25.67% ±3.05%)和空白对照组(23.67% ±1.16%)(P <0.05),两对照组之间无明显差异(P>0.05)。
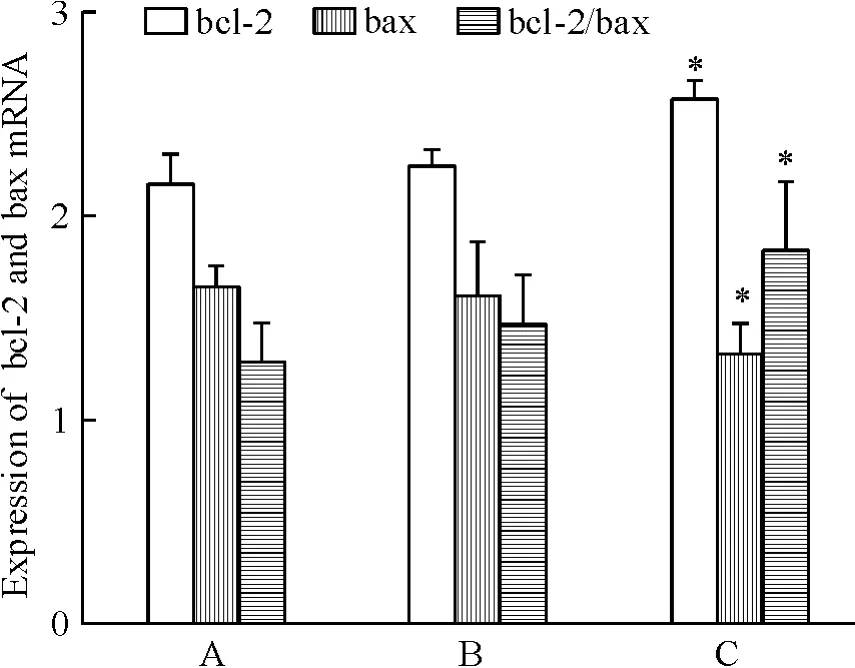
Figure 7.Expression of bcl-2 and bax mRNA.A:MSCs;B:MSCs-vector;C:MSCs-shRNA.Mean±SD.n=3.*P<0.05 vs A or B.图7 bcl-2和bax mRNA的表达
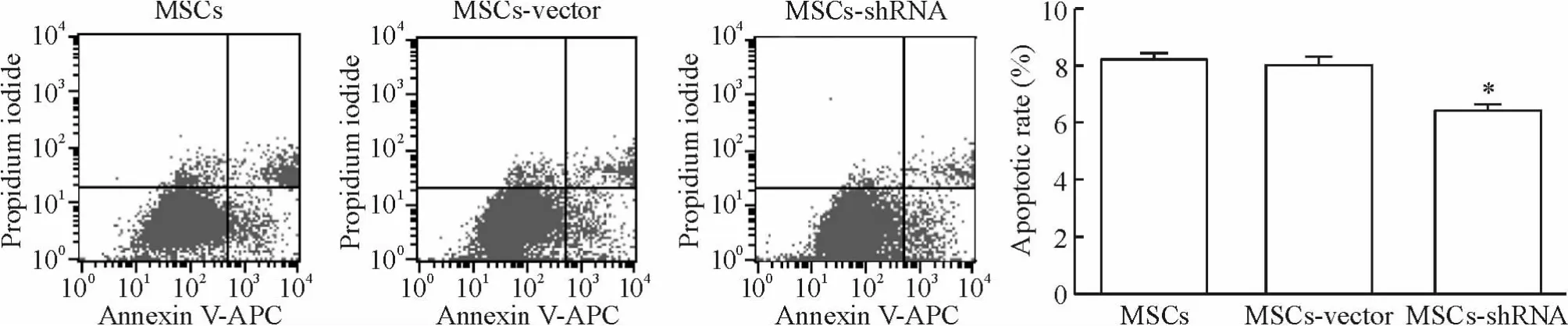
Figure 8.Apoptosis of MSCs detected by flow cytometry assay.Mean ± SD.n=3.*P <0.05 vs MSCs or MSCs-vector.图8 流式细胞术检测MSCs凋亡

Figure 9.Apoptosis of MSCs detected by Hoechst 33258 staining(×400).A:MSCs;B:MSCs-vector;C:MSCs-shRNA图9 Hoechst 33258染色检测MSCs凋亡
讨 论
尽管MSCs移植用于治疗心肌梗死具有发展潜力,但是移植后的低存活率使得治疗效果并不理想,成为其临床应用的瓶颈。心肌微环境是植入的MSCs赖以生存的空间位置和相互关系。微环境中的细胞外基质和生物活性分子不但对MSCs起着支持、连接、营养和保护等作用,还对其增殖、分化和迁移有着重要的信号调节作用。细胞外基质与MSCs黏附,通过整合素-FAK-ERK信号通路促进MSCs生长、增殖和迁移[6]。MSCs能旁分泌多种细胞因子,尤其是碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)通过ERK的活化,具有相对较强的促增殖作用[7]。心肌梗死后,局部的缺血缺氧、炎症反应和再灌注损伤使植入的细胞面临一个复杂、失稳态和恶劣的微环境[8]。缺乏基质中的存活信号,细胞毒性因子的产生导致细胞在移植后增殖能力受限,短时间内大量凋亡[9]。同时,心肌的机械刺激也对MSCs的增殖和存活造成一定的影响。
Pouzet等[10]率先提出了“线性关系”理论,认为增加注射细胞的数量能够提高移植效率。但随后的几项研究结果得出了与此相悖的结论,甚至有报道称,细胞数量的增加可导致左心室射血分数(left ventricular ejection fraction,LVEF)的恶化[11]。由于用于动物实验和临床实验的移植细胞种类各不相同,而每种细胞的生物学特性都有所差别,加上其它研究因素不尽一致,很难单纯分析数量对疗效的影响。
细胞凋亡是由基因控制的程序性死亡,涉及一系列基因的激活、表达以及调控。Caspase家族在凋亡过程中起着关键作用。Caspase-3处于凋亡有序级联反应的下游,内源性和外源性通路最后都有caspase-3的激活[12],它的活化是凋亡进入不可逆阶段的标志。bcl-2基因家族也与细胞凋亡密切相关。家族成员包括促凋亡基因(bax和bag)和抗凋亡基因(bcl-xL和bcl-2)两大类。任何因素破坏促凋亡和抗凋亡2组基因或相关蛋白之间的平衡都会导致细胞对外界刺激的敏感性增加,而破坏细胞的结构与功能。bcl-2 mRNA和bax是研究最广泛的凋亡相关基因,两者的比值往往决定了细胞的命运[13]。
本实验针对caspase-3这一凋亡过程中的关键执行者构建了shRNA表达载体,通过慢病毒介导成功转染了MSCs,在mRNA和蛋白水平对目的基因的表达起到了有效的干扰,同时观察到bcl-2 mRNA表达上调,bax mRNA表达下调,bcl-2/bax比值升高。沉默caspase-3后的MSCs增殖率明显提高,原因可能为细胞周期受到调控,更多的细胞停留在S期和凋亡的细胞数量减少。凋亡的细胞染色质凝聚,细胞核浓缩,细胞体积缩小,转染组的凋亡率明显低于对照组。然而,心肌梗死区域是一个以缺血缺氧为主要特点的复杂微环境,下一步需进行体外缺血缺氧模拟或体内细胞移植才能进一步验证沉默caspase-3能否提高MSCs的抗凋亡能力。
