NF-κB在脓毒症血浆诱导的内皮细胞损伤和凋亡中的作用*
2013-12-01梁英健张晓娟刘志永马晓春
梁英健, 李 鑫, 张晓娟, 刘志永, 马晓春
(中国医科大学附属第一医院重症医学科,辽宁沈阳110001)
脓毒症的发生发展打破了机体细胞增生和死亡之间的精确平衡,细胞凋亡的变化是病原体和宿主之间相互作用的结果。近年来研究显示细胞凋亡变化是脓毒症重要的病理变化之一[1]。脓毒症时免疫细胞和组织细胞的凋亡发生异常与病程和预后密切相关,同时纠正凋亡异常的治疗措施逐渐发展并且在动物实验中也取得了很好的疗效[2]。内皮系统功能失调是脓毒症器官衰竭和死亡的一个重要特征,从细胞水平上说这种内皮功能丧失主要是由于内皮细胞凋亡的增加[1]。核因子κB(nuclear factor kappa B,NF-κB)作为一类具有多向转录调节作用的核蛋白因子,在细胞凋亡中同样具有重要的作用。本文就NF-κB在脓毒症引起的内皮损伤和细胞凋亡中的作用做进一步的探讨。
材料和方法
1 脓毒症患者和健康对照者血浆的获得
选取2008年6月~2008年11月在中国医科大学附属第一医院重症医学科住院治疗的腹腔感染患者22名,其中男性13名,女性9名。年龄36~90岁,平均(65.7±13.9)岁。对照组为8 名健康者,男性5名,女性3名,年龄(60.2±11.3)岁。所有患者均符合美国胸科医师学会和危重病学会提出的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)诊断标准的全部或至少2项。每名患者在发生脓毒症24 h内采血10 mL,对照组每名采血5 mL。枸橼酸钠抗凝,4℃ 1 000 r/min 15 min,获得血浆。分装后-70℃保存。每个病例都填写了知情同意书。
2 方法
2.1 内皮细胞的培养 人脐静脉内皮细胞系(human umbilical vein endothelial cells,HUVECs)购自复旦大学医学部。细胞复苏后于20%胎牛血清的DMEM(Gibco)培养液中传代,所有实验细胞在体外扩增均不超过15代。
2.2 脓毒症血浆刺激HUVECs上清液的制备 HUVECs经胰蛋白酶消化后,调整细胞数为5×108/L,种植于24孔板中,在培养箱中培养36~48 h,再换用无酚红无血清的DMEM培养液培养24 h,使细胞同步于G0期。阴性对照组分别加入10%、20%和30%正常人血浆;实验组分别加入10%、20%和30%脓毒症患者血浆;拮抗剂组加入NF-κB拮抗剂PDTC(Sigma)100μmol/L,1 h后再加入20%脓毒症患者血浆,收集上清液,1000 r/min,离心10 min),分装,-70℃冻存。
2.3 ELISA应用ELISA方法检测von Willebrand因子(von Willebrand factor,vWF)和肿瘤坏死因子α(tumor necrosis factorα,TNF-α)。人 vWF 的 ELISA试剂盒购自ADL,人TNF-αELISA试剂盒购自晶美生物工程有限公司。具体方法严格按说明书进行。每组样品做3孔。
2.4 免疫荧光 将制成的细胞悬液种植于由0.2%明胶包被的玻片上,培养24 h;换用无血清的DMEM培养液培养24 h,使细胞同步于G0期。实验组加入20%脓毒症患者血浆,拮抗剂组在加入血浆前1 h加入PDTC 100μmol/L;经过4%多聚甲醛固定,0.2%Triton X-100打孔,3%BSA封闭后,加入30μL I抗NF-κB抗体,4℃过夜;PBS冲洗干净,加入30μL TRITC标记的II抗(北京中杉生物试剂有限公司),37℃孵育1 h;在荧光显微镜下拍照。
2.5 MTT比色法 HUVECs经胰蛋白酶消化后制成细胞悬液,以5×103cells/well的细胞数接种于96孔板中,在培养箱中培养36~48 h,再换用无酚红无血清的DMEM培养液培养24 h,使细胞同步于G0期。实验组加入10%脓毒症血浆;拮抗剂组加入二硫代氨基甲酸吡咯烷(pyrrolidine dithiocarbamate,PDTC)(25 μmol/L、50 μmol/L、100 μmol/L 和 200 μmol/L)作用1 h后,再加入10%脓毒症血浆作用18 h;阴性对照组为正常的HUVECs。每个实验组设3个平行孔。每孔加入20μL无菌MTT(5 g/L)孵育4 h,再加入150μL DMSO,于微量振荡器充分振荡10 min,用酶标仪于490 nm波长条件下测定吸光度值。
2.6 流式细胞术 培养瓶中细胞基本融合后,加入无血清DMEM作用24 h;实验组加入10%脓毒症血浆;拮抗剂组加入PDTC 100μmol/L 1 h后,再加入10%脓毒症血浆,作用18 h;制成细胞悬液并收集于离心管中,2 000 r/min离心5 min,弃上清;PBS洗涤细胞2次后再次2 000 r/min离心5 min,弃上清;依次加入500μL binding buffer、5μL AnnexinV-FITC 和5μL碘化丙啶(propidium iodide,PI);混匀后过滤;室温、避光、反应5~15 min,1 h内在流式细胞仪检测。Annexin V+/PI-为凋亡细胞。
3 统计学处理
数据以均数±标准误(mean±SEM)表示。组间差异采用One-way ANOVA和SNK-q检验分析。以P<0.05为差异有统计学意义。
结 果
1 脓毒症患者和正常人血中TNF-α和vWF的变化
脓毒症患者血中TNF-α和vWF明显高于正常人(P<0.01),表明脓毒症患者存在内皮细胞损伤,见表1。

表1 vWF和TNF-α在脓毒症患者和正常人中的检测Table 1.The concentrations of plasma TNF-α and vWF in septicpatients and healthy controls(Mean±SEM.n=3)
2 脓毒症患者血浆引起的内皮细胞损伤呈时间-剂量依赖关系
分别用10%、20%和30%脓毒症患者血浆刺激HUVECs,10%、20%和30%正常人血浆做阴性对照,脓毒症患者血浆刺激HUVECs释放vWF在120 min达到高峰,随之下降。10%、20%和30%脓毒症患者血浆刺激HUVECs均可引起vWF的升高,30%脓毒症患者血浆引起内皮细胞损伤最强。在10~120 min内,vWF和TF的升高与脓毒症血浆呈时间-剂量依赖关系,见图1。
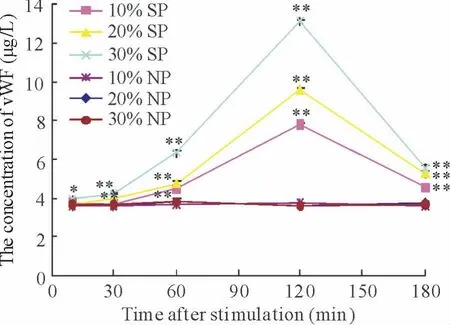
Figure 1.Increased production of vWF from HUVECs treated with septic plasma(SP).NP:normal plasma.Mean±SEM.n=3.*P <0.05,**P <0.01 vs NP at the same concentration.图1 脓毒症患者血浆引起vWF升高
3 脓毒症患者血浆刺激HUVECs后NF-κB活化
用20%脓毒症患者血浆刺激HUVECS,应用免疫荧光的方法观察NF-κB活化。在10 min时即可看见NF-κB的活化(由胞浆转移到胞核),30 min达到高峰,见图2。

Figure 2.Septic plasma(SP)activated NF-κB in HUVECs.A:control;B:20%SP for 10 min;C:20%SP for 30 min.Mean ±SD.n=3.**P <0.01 vs A.图2 脓毒症患者血浆刺激HUVECs后NF-κB活化
4 NF-κB参与脓毒症患者血浆引起的内皮细胞损伤
在脓毒症患者血浆刺激HUVECs之前加入NF-κB拮抗剂PDTC,PDTC的浓度为100μmol/L时,细胞活力受到明显影响,见图3。在加入20%脓毒症患者血浆刺激HUVECs之前1 h加入NF-κB拮抗剂PDTC 100μmol/L,可以看到PDTC抑制了HUVECs中vWF的升高,表明NF-κB参与脓毒症的内皮损伤,见图4。
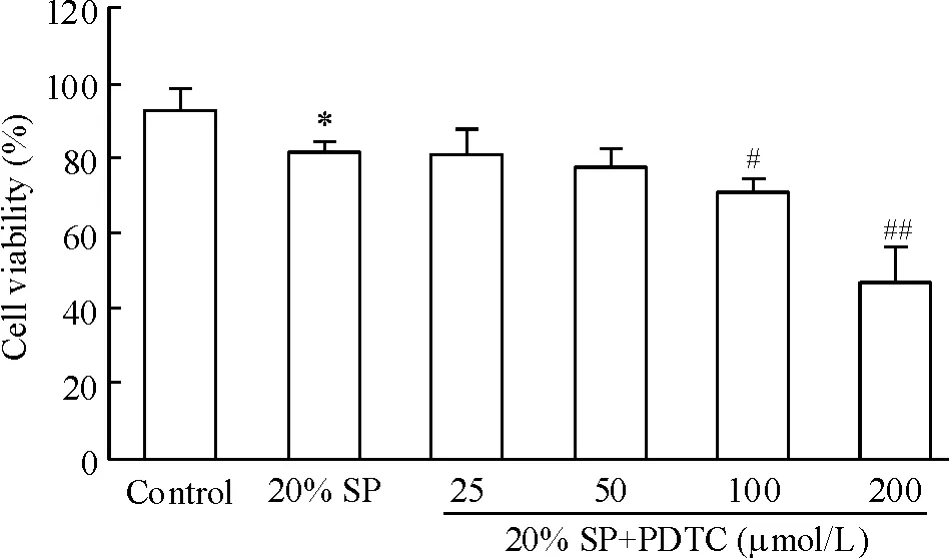
Figure 3.The viability of HUVECs treated with septic plasma(SP)and pyrrolidine dithiocarbamate(PDTC)determined by MTT.Mean±SEM.n=3.*P <0.05 vs control;#P <0.05,##P <0.01 vs 20%SP.图3 MTT比色法检测PDTC浓度
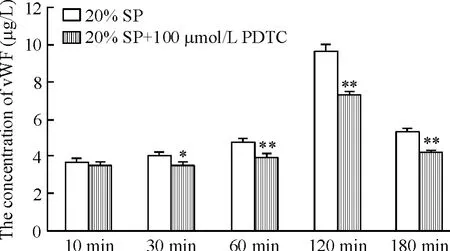
Figure 4.Effects of NF-κB inhibitor PDTCon of vWFproduction in HUVECs treated with septic plasma(SP).Mean±SEM.n=3.*P <0.05,**P <0.01 vs20%SP.图4 加入NF-κB拮抗剂后vWF的变化
5 NF-κB参与了脓毒症引起的内皮细胞凋亡
加入NF-κB拮抗剂PDTC 100μmol/L 1 h后再分别加入10%脓毒症患者血浆和10%正常人血浆作用HUVECs 18 h,对照组HUVECs凋亡率为(4.39±0.12)%;10%正常人血浆作用18 h HUVECs凋亡率为(4.85±0.13)%;10%脓毒症患者血浆作用18 h ,HUVECs凋亡率增加至(10.79 ±0.14)%;加入NF-κB 拮抗剂 PDTC18 h,HUVECs凋亡率增加至(16.03 ±0.12)%,见图5。
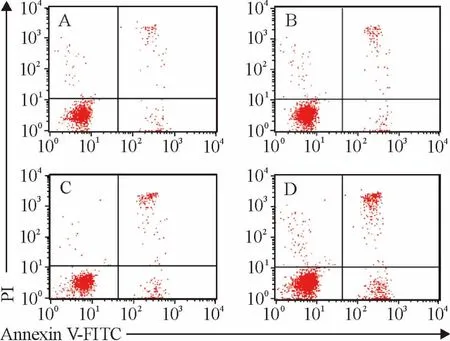
Figure 5.Effects of differents factors on apoptosis of HUVECs at 18 h.A:control;B:10%normal plasma for 18 h;C:10%septic plasma for 18 h;D:100μmol/L PDTC for 1 h and 10%septic plasma for 18 h.图5 不同因素作用18 h对HUVECs凋亡的影响
讨 论
脓毒症的早期即有内皮细胞的活化和损伤,在脓毒症病人引发多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的过程中,内皮细胞的活化-损伤起了重要的作用[3]。vWF存在于血管内皮细胞的 Weibel-Palade小体、血浆和血小板α颗粒中,当血管内皮细胞受损时,vWF等内容物释放入血增多,因此vWF是反映内皮细胞受损的重要标记物,其水平高低可反映血管内皮受损严重程度[4]。我们检测了脓毒症患者血浆以及用脓毒症患者血浆刺激HUVECs后vWF的浓度,发现vWF均明显升高,表明脓毒症时存在内皮细胞的损伤。
为了明确脓毒症时影响内皮损伤的炎症介质,我们检测了TNF-α。TNF-α处于众多炎症因子中的核心地位,能够刺激其它各种促炎症细胞因子的生成[5]。NF-κB、AP-1、ATF-2 等都是能与 TNF-α 基因启动子和增强子结合而促进转录的转录因子[6]。它们的活化都依赖于p38的活化。同时TNF-α的活化又进一步激活各种信号通路和转录因子,激活炎症细胞,两者互为因果,进而形成炎症级联反应,造成炎症介质泛滥。脓毒症血浆富含细胞因子,化学因子和其它炎症介质[7],TNF-α是其中主要物质之一。本实验中22名脓毒症病人的血浆中TNF-α明显高于健康对照者[(155.68 ±89.74)ng/L vs(5.00 ±0.47)ng/L,P <0.01],进一步验证了 TNF-α 是影响内皮细胞损伤的主要炎症介质。
为进一步明确脓毒症发生内皮细胞损伤和凋亡的分子机制,我们检测了NF-κB途径。NF-κB与细胞凋亡的关系密切,其参与多种凋亡相关基因的转录调控[8]。NF-κB 的活化核转录是通过 IKK/NF-κB途径进行的[9-10]。静息状态下,细胞质中的p50/p65与IKB结合成三聚体,使p50/p65不能核移位。当受到菌血症和内毒素等刺激后,IκB发生磷酸化和降解,使NF-κB成为具有活性的形式并迅速发生核移位,在细胞核中寻找特定靶基因启动子区的κB位点并与之结合,指导下游基因表达调控[9]。本实验中用脓毒症血浆刺激HUVECs,NF-κB活化,从胞浆移位入胞核,应用NF-κB拮抗剂PDTC阻断时,vWF降低,表明NF-κB参与了脓毒症的内皮细胞损伤。应用流式细胞仪检测细胞凋亡,加入NF-κB拮抗剂PDTC后,HUVECs凋亡增加,表明NF-κB在脓毒症血浆引起的内皮细胞凋亡中起抑制凋亡的作用。
在脓毒症中存在内皮细胞损伤,内皮细胞凋亡增加,NF-κB在脓毒症引起的内皮细胞损伤和凋亡中起重要作用。
