菩人丹调控IRS 2、BAD、FOXO 1蛋白表达和磷酸化抑制INS-1细胞凋亡的分子机制*
2013-12-01鲁碧楠杜子亮白永飞德力格玛庞宗然
陈 书,鲁碧楠,杜子亮,白永飞,德力格玛,庞宗然
(中国少数民族传统医学国家民委-教育部重点实验室,北京 100081)
胰岛β细胞功能受损和胰岛素抵抗是2型糖尿病(T2DM)的两大发病机制。糖尿病动物模型中发现,β细胞凋亡增加是造成T2DM胰岛β细胞数量显著下降的主要原因[1]。“脂毒性”是指血循环以及细胞内(主要是肌细胞、肝细胞、胰岛β细胞)游离脂肪酸(free fat acids,FFAs)浓度过高,引起β细胞凋亡、分泌胰岛素功能缺陷,导致糖尿病的发生[2]。中药菩人丹[3]由苦瓜、人参、丹参、半夏等组成,在调脂减肥、抑制“脂毒性”、增加胰岛素敏感性、减缓T2DM进程方面具有显著的优势与潜力。本研究旨在探讨菩人丹对软脂酸诱导INS-1细胞凋亡的抑制及可能的机制。
1 材料与方法
1.1 动物及细胞株
雄性Wistar大鼠,体质量300±10 g,购自北京维通利华实验动物技术有限公司。大鼠胰岛素瘤细胞系INS-1细胞由大连医科大学惠赠。
1.2 主要药品及试剂
苦瓜冻干粉(诺金科生物技术有限公司)、人参、制何首乌(亚威中药饮片公司)、丹参、葛根、制水蛭(金香中药饮片公司)、盐酸二甲双胍片(双鹤药业)、软脂酸(Sigma公司)、RPMI-1640培养基(Gibco公司)、胎牛血清(Hyclone公司)、牛血清白蛋白(Equitech bio公司)、Cell Counting Kit-8(CCK-8)(DOJINDO同仁化学研究所)、Annexin VFITC&PI Apoptosis Kit(优博奥生物科技有限公司)、细胞凋亡与坏死检测试剂盒、BCA蛋白浓度测定试剂盒、RIPA细胞裂解液(碧云天生物技术研究所)、p-IRS2(ser731)(亚诺法生技股份有限公司)、IRS2、p-BAD(ser136)、BAD、p-FOXO1(ser256)(Cell Signaling Technology公司)、FOXO1(Millipore公司),其他试剂均为分析纯。
1.3 主要仪器
超净工作台(苏洁净化设备有限公司)、二氧化碳培养箱(Thermo Scientific公司)、多功能酶标仪(美国分子仪器公司)、荧光倒置显微镜(OLYMPUS有限公司)、电泳仪(Bio-Rad公司)。
1.4 含药血清制备
取健康雄性Wistar大鼠90只,将大鼠按随机数字表法分组,30只为菩人丹组,30只为二甲双胍阳性对照组,30只为空白对照组,各组均饲以普通维持饲料。菩人丹组以煎制中药溶液灌胃,溶液浓度相当于生药量7.21 g·mL-1,二甲双胍阳性对照组以0.07 g·mL-1二甲双胍0.5%CMC-Na乳浊液灌胃,空白对照组以0.5%CMC-Na溶液灌胃。各组大鼠灌胃体质量给药量为10 mL·kg-1,每日给药2次(间隔12 h),连续给药5 d。第5天首次给药(即第9次给药)后1 h,10%水合氯醛(体质量剂量3 mL·kg-1)麻醉大鼠,腹主动脉取血致死。血样室温静置3 h,3500 rpm离心15 min,小心吸取上清,即获得大鼠血清。将各组大鼠血清混合,经56℃水浴灭活30 min,一次性无菌微孔滤膜(0.22 μm)过滤灭菌,分装后-20℃保存备用。
1.5 细胞培养
INS-1细胞用RPMI-1640完全培养液(含10%胎牛血清)在37℃、5%CO2恒温湿化培养箱中培养。待细胞长至70%~80%融合后予以传代。
1.6 分组及给药干预
INS-1细胞于含软脂酸0.5 mM的培养液中培养24 h后,将细胞分为软脂酸损伤组(PA)、低剂量菩人丹组(L-PRD)、高剂量菩人丹组(H-PRD)和二甲双胍阳性对照组(metformin,MF)。其中 L-PRD组、H-PRD组和MF组分别给予5%、10%菩人丹和10%二甲双胍含药血清干预24 h,PA组和正常对照(Control)组则给予RPMI-1640培养液培养24 h。
1.7 细胞活力(cell viability)检测
收集对数生长期的INS-1细胞,以1×105cell·mL-1密度接种于96孔板,根据实验设计对各组细胞进行干预。每孔加入10 μL CCK-8溶液,置于培养箱内孵育2 h,酶标仪测定450 nm处吸光度,以Control组OD值为对照,测定细胞活力,每组设6个复孔。
1.8 Hoechst荧光染色检测细胞凋亡
收集对数生长期的INS-1细胞,以每孔1×106个细胞浓度接种于6孔板,根据实验设计对各组细胞进行干预,而后吸去细胞上清液,每孔先加入1 mL细胞染色缓冲液,再加入5 μL Hoechst染色液,冰浴或4℃孵育20 min,PBS洗涤1次,置于荧光显微镜下(200×)观察细胞凋亡(n=5)。
1.9 流式Annexin V-FITC/PI双染法检测细胞凋亡
收集各组干预后的INS-1细胞,按照试剂盒说明书检测各组细胞凋亡率,同时以不加AnnexinVFITC和PI的细胞作为阴性对照。
1.10 Caspase-3和caspase-8活性检测
收集对数生长期的INS-1细胞,以每孔1×106个细胞的浓度接种于6孔板,根据实验设计对各组细胞进行干预。将各组INS-1细胞于600 g,4℃离心5 min收集,吸除上清,PBS洗涤1次,按每200万细胞加入100 μL裂解液比例加入裂解液,重悬沉淀,冰浴裂解15 min,4℃ 20000 g离心15 min,将上清转移至冰浴预冷的离心管中,按照试剂盒说明书检测caspase-3和caspase-8活性。
1.11 Western blot分析
利用 western blot方法检测IRS 2、BAD、FOXO 1蛋白质表达及磷酸化水平。给予PA损伤INS-1细胞10%菩人丹含药血清干预24 h后,收集各组细胞,RIPA蛋白裂解液提取各组细胞总蛋白,BCA法检测蛋白质浓度。制备蛋白样品转膜、封闭置于一抗(p-IRS2 1∶1000、IRS2 1∶1000、p-BAD 1∶5000、BAD 1∶2000、p-FOXO1 1∶1000、FOXO1 1∶2000)中 4℃孵育过夜。次日置于HRP标记的山羊抗兔二抗(1∶20000)中室温孵育40 min。TBST洗膜后,用化学发光对膜进行处理,在暗室中曝光、显影和定影。以Bio-Rad图像分析系统对Western印迹目的条带进行扫描,用Quantity One软件进行分析,确定目的条带和内参条带的光密度值,目的蛋白表达量的改变用相对光密度,即目的条带光密度值与内参条带光密度值的比值来评估。
1.12 统计学方法
应用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,2组间比较采用两样本均数t检验,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 菩人丹对PA损伤INS-1细胞活力的影响
CCK-8检测结果显示(图2-1),PA组INS-1细胞活力显著降低,以Control组INS-1细胞为对照,其细胞活力下降至67.9% ±4.06%(P<0.001)。低剂量菩人丹组(L-PRD)的细胞活力与PA组比较差异无统计学意义(66.4% ±2.11%,P=0.308),而高剂量菩人丹(H-PRD)使INS-1细胞活力明显升高(79.5% ±2.08%,P<0.001),与阳性对照药二甲双胍(MF)作用效果相当(79.5% ±2.26%,P=1.000)。
2.2 菩人丹对PA损伤INS-1细胞凋亡的影响
对各组细胞进行Hoechst 33342染色,荧光显微镜下观察到正常细胞的细胞核呈圆形,显弱蓝色荧光且细胞核染色均匀,细胞凋亡比例(图2-2)仅为7.00% ±3.29%,而PA组强蓝色荧光着色细胞明显增多,细胞核呈分叶状且出现浓染的致密颗粒,凋亡比例达到32.81% ±2.32%(P<0.001)。给药干预后细胞凋亡比例有所下降,其中L-PRD组细胞凋亡减少(30.99% ±1.62%,P=0.093),与PA组比较差异无统计学意义;而H-PRD组显著降低(20.49% ±1.04%,P<0.001),与MF阳性对照组作用效果相当(20.66% ±2.01%,P=0.866)。此结果与流式细胞仪对各组细胞凋亡率的分析结果相一致(图2-3),与Control组比较,PA组INS-1细胞凋亡率显著升高(30.68% ±1.54%vs.4.86% ±0.40%,P<0.001)。L-PRD组细胞凋亡率与PA组比较差异无统计学意义(30.00% ±1.20%,P=0.515),而HPRD组细胞凋亡率降至21.84% ±1.35%(P<0.001),且与 MF组比较差异无统计学意义(22.64% ±2.19%,P=0.445)。
Caspase-3、-8活性检测结果显示(图2-4),PA使INS-1细胞caspase-3和caspase-8活性显著升高,caspase-3活性增加为Control组细胞的398.21% ±14.11%(P <0.001),caspase-8活性为 Control组的195.93% ±7.73%(P<0.001)。给药干预24 h后,除L-PRD组 caspase-3活性无明显降低外(386.62% ±10.10%,P=0.068),H-PRD组和 MF阳性对照组的caspase-3活性均显著降低,即H-PRD组降为274.59% ±10.95%(P<0.001),MF组降为266.92% ±5.56%(P<0.001),二者的作用效果差异无统计学意义(P=0.217)。菩人丹也降低了PA损伤INS-1细胞的caspase-8的活性,但是L-PRD组caspase-8活性(196.47% ±10.66%)与PA组比较差异无统计学意义(P=0.917),而H-PRD则显著降低了 caspase-8活性(156.77% ±9.44%,P<0.001),但与 MF组比较差异有统计学意义(136.36% ±7.43%,P=0.001)。

图2-2 菩人丹抑制PA诱导INS-1细胞凋亡-Hoechst荧光染色法
2.3 菩人丹对PA损伤INS-1细胞IRS2、BAD、FOXO1蛋白质表达及磷酸化的影响
本实验考察了INS-1细胞IRS2蛋白质表达及其丝氨酸731位点(ser731)的磷酸化水平(图2-5)、BAD(ser136)的磷酸化水平(图2-6)、FOXO1蛋白质表达及其丝氨酸256位点(ser256)的磷酸化水平(图2-7)。
与Control组比较,PA使INS-1细胞的IRS2蛋白质表达水平下降37%(P=0.003),蛋白质磷酸化是一种重要的蛋白质翻译后修饰方式,它参与信号传导调控、基因表达、细胞周期等诸多细胞过程。IRS2丝氨酸位点磷酸化阻止IRS2与胰岛素受体结合,从而干扰胰岛素信号传导,PA使INS-1细胞的IRS2丝氨酸(ser731)位点磷酸化水平升高13.55倍(P<0.001),使 BAD(ser136)磷酸化水平下降至74%(P<0.001),FOXO1蛋白质表达水平升高1.43倍(P<0.001),FOXO1(ser256),磷酸化水平显著降低至86%(P<0.001)。与PA组比较,菩人丹作用24 h后,INS-1细胞的IRS2蛋白质表达水平升高 0.9倍(P<0.001),IRS2(ser731)磷酸化水平降低2.44倍(P<0.001),BAD(ser136),磷酸化水平升高 2.65倍(P<0.001),FOXO1蛋白质表达水平下降1.61倍(P<0.001),FOXO1(ser256)磷酸化水平升高3.83倍(P<0.001),且菩人丹的作用趋势与阳性对照药MF一致。

图2-3 流式Annexin V-FITC/PI双染法检测INS-1细胞凋亡
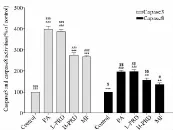
图2-4 菩人丹对PA损伤INS-1细胞caspase-3、-8活性的影响
3 讨论
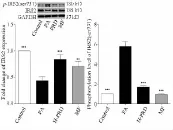
图2-5 菩人丹对PA损伤INS-1细胞IRS2蛋白质表达及ser731位点磷酸化的影响
IRS是胰岛素信号传导系统中极为重要的一类蛋白质分子,是胰岛素信号传递的中介;IRS 2是发挥主要作用的胰岛素受体底物家族之一,主要负责调控胰岛β细胞的量,即β细胞的增殖和凋亡等[2]。胰岛素与受体结合后,胰岛素受体激酶被激活,被激活的激酶使IRS2酪氨酸磷酸化,通过多种途径抑制细胞凋亡促进细胞存活。然而若IRS出现过高的丝氨酸位点磷酸化,将阻碍其正常的酪氨酸磷酸化,使其不能发挥抑制胰岛β细胞凋亡的作用。本实验中,软脂酸下调INS-1细胞的IRS2蛋白质表达水平,并使其丝氨酸(ser731)位点磷酸化水平升高,而中药菩人丹上调IRS2蛋白质表达水平,并抑制IRS2丝氨酸磷酸化,从而减少β细胞凋亡,发挥了其对脂毒性损伤胰岛β细胞的保护作用。
BAD是Bcl-2家族成员之一,受磷酸化/去磷酸化修饰的调控,可与Bcl-2或Bcl-xl形成复合体而表现促凋亡活性。生理状态下,BAD以磷酸化的形式存在于细胞之中,并与伴侣蛋白(Chaperone)14-3-3蛋白结合,阻断BAD与Bcl-2或Bcl-xl形成二聚体,不干扰 Bcl-2和 Bcl-xl的抑制细胞凋亡活性,即BAD不能发挥着促细胞凋亡作用[4]。而本试验中,软脂酸使BAD(ser136)磷酸化水平显著下降,菩人丹则上调其磷酸化水平,抑制BAD的促细胞凋亡作用,从而保护了胰岛β细胞。

图2-6 菩人丹对PA损伤INS-1细胞BAD(ser136)磷酸化的影响

图2-7 菩人丹对PA损伤INS-1细胞FOXO1蛋白质表达及ser256位点磷酸化的影响
FOXO家族的转录因子穿梭于细胞核内外,在机体细胞增殖、凋亡、分化和抵抗氧化应激方面发挥着重要作用[5]。FOXO1是胰岛素/胰岛素样生长因子信号通路中下游的关键分子,其上游主要受PI3K/Akt控制。有研究显示,FOXO1参与脂毒性诱β细胞凋亡,游离脂肪酸培养下的小鼠胰岛β细胞,FOXO1磷酸化水平降低,使FOXO1核内转位增加、活性明显增强,促进β细胞凋亡[6]。本实验中也发现,PA损伤INS-1细胞FOXO1的ser256位点磷酸化下降,而菩人丹干预后其磷酸化程度显著增强,说明菩人丹抑制FOXO1的核内转位,下调凋亡相关蛋白表达,以保护脂毒性下的胰岛β细胞。
菩人丹主要由苦瓜、人参、丹参、半夏等药物组成,其中苦瓜有清暑涤热、滋养肝肾之功效,研究证实其活性成分苦瓜皂苷、苦瓜素等降糖作用确切[7];人参味甘微苦、性温,大补元气,固脱生津,现代研究证实人参皂苷、人参多糖具有良好的降糖效果,且能调节脂代谢[8];丹参味苦微寒,归心、肝经,具有活血调经、祛瘀止痛之功效,并能有效降低血糖。现代药理学研究发现,丹参对细胞水平的胰岛素抵抗病理状态进展有一定的阻止作用[9];半夏辛、温,能燥湿化痰、降逆止呕、消痞散结,改善痰湿所致的胰岛素敏感性下降,诸药合用共奏养阴清热、活血化瘀、祛痰化湿之功[10]。前期研究结果表明,菩人丹可以显著改善T2DM大鼠的胰岛素抵抗、修复损伤的胰岛β细胞和大血管内皮细胞,具有降糖调脂减肥的功效[11,12]。本实验探究了菩人丹对PA诱导胰岛β细胞凋亡的影响,结果提示,菩人丹通过调控胰岛素信号传导系统中凋亡相关蛋白IRS2、BAD、FOXO1的表达和磷酸化,抑制PA诱导的胰岛β细胞凋亡,发挥保护胰岛β细胞的作用。
[1]Lupi R.,PS Del.Beta-cell apoptosis in type 2 diabetes:quantitative and functional consequences[J].Diabetes Metab,2008,34 Suppl 2:56-64.
[2]舒适,宋菊敏.胰岛素受体底物-1/-2与胰岛素信号转导[J].医学综述,2008(5):723-725.
[3]庞宗然,刘祖涵,苏晓慧,等.菩人丹超微粉对肥胖型T2DM大血管损伤大鼠ET-1、NO、FFAs含量的影响[J].中国老年学杂志,2011(10):1779-1780.
[4]何家璇,薛荣亮.Bad蛋白对细胞凋亡的调控作用[J].医学综述,2007(3):161-163.
[5]Greer EL,A.Brunet.FOXO transcription factors at the interface between longevity and tumor suppression[J].Oncogene,2005,24(50):7410-25.
[6]Martinez SC.Inhibition of Foxo1 protects pancreatic islet betacells against fatty acid and endoplasmic reticulum stress-induced apoptosis[J].Diabetes,2008,57(4):846-59.
[7]霍宇,谢金鲜.苦瓜在糖尿病治疗中的作用研究进展[J].广西中医学院学报,2010(2):80-82.
[8]唐姗,孙佳明,张辉.人参降糖活性的体外评价方法研究进展[J].吉林中医药,2011(12):1246-1248.
[9]蒋银香.丹参配合降糖治疗糖尿病患者血液流变性的改变[J].中国微循环,2004(3):183-184.
[10]庞宗然,赵玉堂,李静华,等.菩人丹超微粉对肥胖型2型糖尿病大鼠糖代谢相关指标的影响[J].中国实验方剂学杂志,2010(5):107-110.
[11]刘祖涵,庞宗然,王朝晖,等.菩人丹超微粉对2型糖尿病大鼠胰岛α、β细胞的影响[J].中国中医基础医学杂志,2011(3):326-328.
[12]庞宗然,苏晓慧,刘祖涵,等.菩人丹超微粉对T2DM大血管病变大鼠主动脉形态结构的影响[J].辽宁中医杂志,2011(10):1923-1925,2112.
