蛋白质α-N-末端乙酰化修饰研究进展
2013-11-30黄忱陈建华
黄忱,陈建华
α-N-末端乙酰化修饰(α-N-terminal acetylation)是一种蛋白质 N-末端的修饰形式,是真核生物中最为普遍的蛋白质修饰方式之一。虽然 α-N-末端乙酰化修饰早在 20 世纪70年代就被科学家所发现,但是到目前为止,其广泛存在的意义仍未有定论。近年来,研究人员发现了 α-N-末端乙酰化修饰发生的规律,总结出了(X)PX 法则,探明了 α-N-末端乙酰化修饰对多种蛋白质起着特异性的重要作用,使得人们更加清楚地了解细胞内一些生化反应发生的原理以及不同细胞通路的调节方式。此外,α-N-末端乙酰化蛋白质的序列检测方法也是近年来研究的热点之一。本文简要综述α-N-末端乙酰化修饰的研究进展。
1 α-N-末端乙酰化修饰
α-N-末端乙酰化修饰是一种十分普遍的蛋白质 N-末端修饰形式,由乙酰转移酶(N-terminal acetyltransferase,NAT)催化,将乙酰辅酶 A(acetyl-CoA,AcCoA)的乙酰基团转移到蛋白质 N-末端的 α-氨基上[1],其结果是蛋白质的总质量增加 42 D。
新生肽链的第一个氨基酸通常是甲硫氨酸,大多数的新生肽链都必须经过甲硫氨酸切除作用,即在甲硫氨酸胺肽酶的作用下,甲硫氨酸被切除,这一修饰发生在 α-N-末端乙酰化修饰之前。当新生肽链暴露出的第二位氨基酸符合一定条件时,即发生 α-N-末端乙酰化修饰反应。
α-N-末端乙酰化修饰是一种蛋白质的共翻译修饰,当新生肽链从核糖体中露出 25~50 个氨基酸残基序列,即肽链仍与核糖体结合的时候就发生修饰,而作为翻译后修饰的情况并不多见,这表明 N 末端修饰的方式从根本上取决于蛋白质 N 末端区域。
α-N末端乙酰化修饰是真核生物中最为普遍的蛋白质修饰方式之一,真核生物胞质蛋白进行 α-N-末端乙酰化修饰的比例为 80%~90%,但是原核生物和古细菌蛋白鲜少被乙酰化。植物中被乙酰化的蛋白质比例未知,但是SWISS-PROT 中已知 N 末端序列的成熟蛋白数量很少,仅包括细胞色素 C、组蛋白和一些代谢酶。无脊椎动物中N 末端乙酰化的蛋白质数量也很少。
2 α-N-末端乙酰转移酶及分类
α-N-末端乙酰化修饰由 α-N-末端乙酰转移酶(NAT)催化,目前已发现了 6 种真核 NAT,几乎全部或部分与核糖体相关,分别为 NatA~NatF。前 5 种(NatA~NatE)在人和酵母细胞中发现并且较为保守,NatF 仅在高等真核生物中发现。每一种 NAT 都由一个以上的亚基组成并有着不同的 N-末端底物序列。最早被发现的 NatA 由催化亚基Ard1(Naa10p)、辅助亚基 Nat1(Naa15p)和 Nat5 组成,在肽链完成甲硫氨酸的切除作用后催化由 Ser-、Ala-、Thr-、Val-、Gly-、Cys- 为 N-末端的乙酰化修饰。酸性氨基酸残基 Asp-、Glu- 为 N-末端的肽链可能进行由 NatA 或 Ard1单亚基催化的翻译后乙酰化修饰[2]。最近又有研究指出,NatA 中可能含有一种新的功能组分——分子伴侣样蛋白HYPK[3]。NatB 由催化亚基 Nat3(Naa20p)和辅助亚基Mdm20(Naa25p)组成,能够对以 Met-Asp-、Met-Glu-、Met-Asn- 为 N-末端的底物肽链进行乙酰化修饰[4]。NatC由催化亚基 Mak3(Naa30p)和辅助亚基 Mak10(Naa35p)、Mak31(Naa38p)组成,受其催化的底物肽链的 N-末端有着 Met-Leu-、Met-Ile-、Met-Tyr-、Met-Phe- 等序列[5]。NatD含有催化亚基 Nat4(Naa40p)能够催化 N-末端为 Ser- 的酵母组蛋白 H2A 和 H4 进行 N-末端乙酰化修饰[6]。NatE含有催化亚基 Nat5(Naa50p),与 NatA 的亚基 Ard1 及Nat1 相关[7]。Nat5 的体外实验指出其能够使 Met-Leu- 及相似序列乙酰化,然而其体内活性及是否依赖 Ard1 和Nat1 而起作用尚不明确。NatF 作为最新发现的一种 NAT,只存在于高等真核生物细胞中,含有催化亚基 Naa60p,底物 N-末端序列为 Met-Lys-,Met-Ala-,Met-Leu- 等[8]。
虽然在原核生物中,蛋白质的 α-N-末端乙酰化修饰并不普遍,但是在大肠杆菌中已发现 Rim I、Rim J[9]和 Rim L[10]三种 NAT,分别催化乙酰化核糖体蛋白 S18、S5 和L7/L12。
3 α-N-末端乙酰化修饰的(X)PX 法则与分子机制
对于 α-N-末端乙酰化修饰反应来说,新生肽链、乙酰转移酶、AcCoA 等都是必要条件。可是研究人员发现,并不是所有的新生肽链在乙酰转移酶和 AcCoA 的存在下就能够发生 α-N-末端乙酰化修饰。在对 α-N-末端乙酰化修饰了的蛋白质序列进行总结后,研究人员提出了(X)PX 法则[11]。该法则认为,当脯氨酸存在于肽链的第二位,第一位存在起始甲硫氨酸或者在第三位存在一个有着回转半径较小的氨基酸时,肽链的 α-N-末端乙酰化修饰作用就不能发生。这一法则为研究人员研究去除末端乙酰化基团后蛋白质的稳定性、功能、位置等问题提供了可能。但也有特例,SP-starting Ymr090w 蛋白的新生肽链虽然符合(X)PX 规则但仍被 NatA 进行了 α-N-末端乙酰化修饰,并且连接上了 NatA 依赖型AcN-降解决定子。这说明(X)PX 法则仍有待完善。
α-N-末端乙酰化修饰过程中 NAT 的多种亚基之间如何相互作用尚无定论。到目前为止,研究人员仅对酿酒酵母的 NatA 催化 α-N-末端乙酰化修饰时三种亚基与核糖体作用的分子机制提出了一种假设。
酿酒酵母的 NatA 是迄今研究最为透彻的 α-N-末端乙酰化酶。如前所述,NatA 主要由催化亚基 Ard1 和辅助亚基 Nat1 两个亚基组成。只有当 Ard1 和 Nat1 同时过表达时乙酰基转移酶活性才能提高。Nat1 或 Ard1 发生异常都会使 NatA 功能丧失,导致酵母表现出多重表型异常,包括慢生长、不能进入 G0期和形成孢子以及对沉默接合型位点失去抑制、导致染色体不稳定[12]等。
Gautschi 等[13]通过研究发现了 NatA 的第三种亚基Nat5。同时提出了 NatA 的三种亚基与核糖体相互作用的机制:Nat1 介导催化底物和核糖体大亚基之间稳定的相互作用,同时,Nat1 与刚从核糖体管状出口露出约 40 个氨基酸残基的新生肽链相结合。Nat1 将正在延伸的肽链引导到催化亚基 Ard1 和可能的催化亚基 Nat5,两个催化亚基将AcCoA 上的乙酰基团转移到肽链的 α-N-末端。当 Nat1 与核糖体亚基紧密结合时 Ard1 才能发挥催化作用,但是,Nat5 是否通过 Nat1 或(和)Ard1 与核糖体亚基相互作用尚不明确。如果没有 Nat1 的存在,催化亚基可能对新生肽链没有或者仅有很小的亲和力。因此,含有 Nat1 的稳定的反应复合物对于 N-α-乙酰化作用来说是十分重要的。Nat1和 Ard1 之间反应复合物的形成可能通过 C-末端的卷曲螺旋区域。
4 α-N-末端乙酰化修饰的作用
α-N-末端乙酰化修饰虽然普遍存在,但是对其作用人们还知之甚少,仅笼统地认为 α-N-末端乙酰化修饰在酶活性、稳定性、DNA 结合、蛋白质相互作用及受体识别中起作用。
早前有研究者认为由于蛋白质翻折需要泛素化依赖的降解系统,而这个系统又依赖 N 端游离的 α-NH2基团[14],所以有理由相信 α-N-末端乙酰化在防止蛋白质水解中起到重要作用。但是最近有研究指出,α-N-末端乙酰化能够产生特异性降解信号[15]。研究者发现在酿酒酵母中 N-末端乙酰化了的甲硫氨酸残基能够作为降解信号(AcN-降解决定子),被泛素连接酶 Doa10 识别,从而导致被标记蛋白质的降解。另外,N-末端为乙酰化了的 Ala-、Val-、Ser-、Thr-、Cys- 残基的蛋白质同样能被 Doa10 识别。
α-N-末端乙酰化修饰的生物学意义仅具体到数量有限的蛋白质上,如蛋白质位置的移动,蛋白质复合物的合成和酶动力学等。例如,Arl 蛋白[16]是一种 GTP 酶,在亚细胞细胞器的定位上起着决定性的作用。当处于 GTP 结合状态时,Arl 蛋白的 N 末端疏水螺旋暴露出来,使其能与磷脂双分子层相互作用。GTP 水解后,变为 GDP 结合状态的Arl 蛋白的 N 末端疏水螺旋埋入内部,因而蛋白从磷脂膜离开。α-N-末端乙酰化修饰是酵母两亲性螺旋 Arl3p 结合到高尔基体上以及 hArl8b 结合到溶酶体上的先决条件。在这些情况下,α-N-末端乙酰化修饰似乎能够取代如 N-豆蔻酰化、N-棕榈酰化等小 GTP 酶定位到膜上所需的脂肪酸修饰的替代反应。
Ashiuchi 等[17]研究指出,α-N-末端乙酰化修饰与血红蛋白亚基的质子化作用有关,能够影响血红蛋白的四聚体聚合强度和协调性。引起地中海贫血的原因是血红蛋白基因发生突变,第 2 位的缬氨酸突变为丙氨酸,使得蛋白质进行了 α-N-末端乙酰化,从而导致了血红蛋白氧亲和力的下降。
Murthi 和 Hopper[18]发现,当去除编码 N-末端乙酰转移酶 NatC 亚基的基因时,报告蛋白 Trm 1-II-GFP 不能够正确定位到内层核膜上,而是定位到了核浆中。MS 检测指出 Trm 1-II-GFP 蛋白是 N-末端乙酰化的,N-末端去乙酰化的 Trm 1-II-GFP 不能够进行正确的定位,说明了 N-末端乙酰化作用对于 Trm 1-II-GFP 内层核膜正确定位的重要性。但是 N-末端乙酰化并不是蛋白质定位到内层核膜的充分条件,可能 N-末端乙酰化在影响 Trm 1-II-GFP 结构及顺式-作用内层核膜定位模体暴露过程中起到作用。表 1 总结了部分已知的 α-N-末端乙酰化修饰对于特定蛋白质的作用。
由表 1 可见,α-N-末端乙酰化修饰对于特定蛋白质起着重要的作用,这使得人们能够更好地理解细胞内的生化反应以及细胞通路调节细胞生理的机制。
5 α-N-末端乙酰化蛋白质的序列测定方法
为了研究 α-N-末端乙酰化修饰普遍存在的意义,大规模测定蛋白质 N-末端序列并总结序列规律是十分必要的。然而,α-N-末端乙酰化的蛋白质 N 末端被乙酰基封闭,无法通过直接的 Edam 降解继而使用间接肽序列测定技术测定蛋白质序列,也无法结合化学修饰进行质谱鉴定。
近年来对角线色谱法(combined fractional diagonal chromatography,COFRADIC)与强阳离子交换色谱法(strong cation exchange chromatography,SCX)的结合使用已逐渐成为蛋白质 N 末端序列测定的普遍使用方法[19]。将α-N-末端乙酰化蛋白质用胰蛋白酶消化成多肽,经过谷氨酸循环转移酶和焦谷氨酸氨基肽酶的处理,在低 pH 条件下进行强阳离子交换色谱分析。首轮对角线色谱过后,用三硝基苯磺酸对多肽进行修饰,氧化甲硫氨酸,再进行第二轮对角线色谱,最后通过 LC-MS/MS 检测,就能对多肽进行识别与定量分析。再对多肽片段进行拼接,从而还原所测蛋白质的 N 末端序列。Aivaliotis 等[20]在对两种嗜盐古生菌Halobacterium salinarum 的 606 种蛋白质和 Natronomona pharaoniss 的 328 种蛋白质 N 末端序列进行测序的过程中就采用了对角线色谱法和强阳离子交换色谱。这两种蛋白质 N 末端序列鉴定方法的组合使用减少了原有蛋白质 N末端序列测定的步骤,更提高了序列测定的准确性。
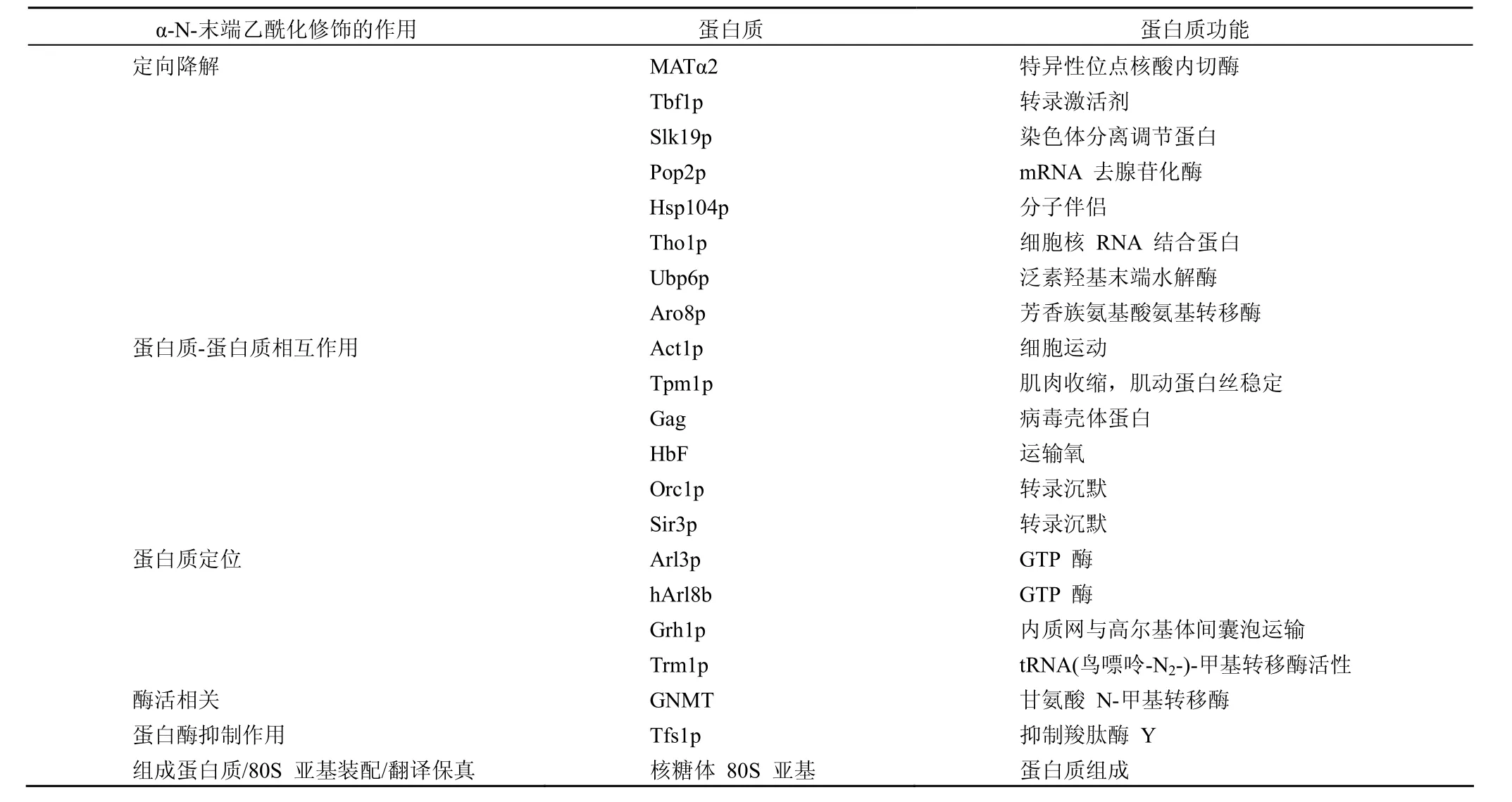
表1 α-N-末端乙酰化修饰对于特定蛋白质的作用
6 小结
α-N-末端乙酰化修饰是一种广泛存在的蛋白质共翻译修饰形式,但并未被完全认知。研究人员已发现 6 种真核NAT,NAT 家族是否还有其他成员尚未可知。不远的将来,NAT 可能在生物催化乙酰化蛋白质方面发挥重要作用。(X)PX 法虽然可以预测可能进行 α-N-末端乙酰化修饰的蛋白质,但仍有特例,这说明(X)PX 法则仍需完善;而将(X)PX 法则反其道而行之,若使蛋白质的 N-末端序列符合(X)PX 法则就能保证该蛋白质不会进行 α-N-末端乙酰化修饰。α-N-末端乙酰化修饰对于特定蛋白质具有防止降解或准确定位的作用,这可能有希望应用到药物蛋白质领域,在对药物蛋白质进行 α-N-末端乙酰化修饰后使之延长半衰期或增强药物靶向治疗效果。随着技术的不断发展,相信 α-N-末端乙酰化修饰能够更好地被人们所认识,并且应用到生产生活中来。
[1] Starheim KK, Gevaert K, Arnesen T.Protein N-terminal acetyltransferases: when the start matters.Trends in Biochemical Sciences, 2012, 37(4):152-161.
[2] Van Damme P, Evjenth R, Foyn H, et al.Proteome-derived peptide libraries allow detailed analysis of the substrate specificities of N(alpha)-acetyltransferases and point to hNaa10p as the post-translational actin N(alpha)-acetyltransferase.Molecular Cell Proteomics, 2011, 10(5):M110.004580.
[3] Arnensen T, Starheim KK, Van Damme P, et al.The chaperone-like protein HYPK acts together with NatA in cotranslational N-terminal acetylation and prevention of Huntingtin aggregation.Mol Cell Biol,2010, 30(8):1898-1909.
[4] Johnson M, Coulton AT, Geeves MA, et al.Targeted amino-terminal acetylation of recombinant proteins in E.coli.PLoS One, 2010, 5(12):e15801.
[5] Starheim KK, Gromyko D, Evjenth R, et al.Knockdown of human N alpha-terminal acetyltransferase complex C leads to p53-dependent apoptosis and aberrant human Arl8b localization.Mol Cell Biol, 2009,29(13):3569-3581.
[6] Song OK, Wang X, Waterborg JH, et al.An Nalpha-acetyltransferase responsible for acetylation of the N-terminal residues of histones H4 and H2A.J Biol Chem, 2003, 278(40):38109-38112.
[7] Evjenth R, Hole K, Karlsen OA, et al.Human Naa50p (Nat5/San)displays both protein N alpha- and N epsilon-acetyltransferase activity.J Biol Chem, 2009, 284(45):31122-31129.
[8] Van Damme P, Hole K, Pimenta-Marques A, et al.NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation.PLoS Genet, 2011,7(7):e1002169.
[9] Yoshikawa A, Isono S, Sheback A, et al.Cloning and nucleotide sequencing of the genes rimI and rimJ which encode enzymes acetylating ribosomal proteins S18 and S5 of Escherichia coli K12.Mol Gen Genet, 1987, 209(3):481-488.
[10] Tanaka S, Matsushita Y, Yoshikawa A, et al.Cloning and molecular characterization of the gene rimL which encodes an enzyme acetylating ribosomal protein L12 of Escherichia coli K12.Mol Gen Genet, 1989, 217(2-3):289-293.
[11] Geotze S, Qeli E, Mosimann C, et al.Identification and functional characterization of N-terminal acetylated proteins in Drosophila melanogaster.PLoS Biology, 2009, 7(11):e1000236.
[12] Ouspenski II, Elledge SJ, Brinkley BR.New yeast genes important for chromosome integrity and segregation identified by dosage effects on genome stability.Nucleic Acids Res, 1999, 27(15):3001-3008.
[13] Gautschi M, Just S, Mun A, et al.The yeast N(alpha)-acetyltransferase NatA is quantitatively anchored to the ribosome and interacts with nascent polypeptides.Mol Cell Biol, 2003, 23(20):7403-7414.
[14] Arnesen T.Towards a functional understanding of protein N-terminal acetylation.PLoS Biol, 2011, 9(5):e1001074.
[15] Hwang CS, Shemorry A, Varshavsky A.N-terminal acetylation of cellular proteins creates specific degradation signals.Science, 2010,327(5968):974-977.
[16] Hofman I, Munro S.An N-terminally acetylated Arf-like GTPses is localised to lysosomes and affects their motility.J Cell Sci, 2006,119(Pt 8):1494-1503.
[17] Ashiuchi M, Yagami T, Willey RJ, et al.N-terminal acetylation and protonation of individual hemoglobin subunits: position-dependent effects on tetramer strength and cooperativity.Protein Sci, 2005,14(6):1458-1471.
[18] Murthi A, Hopper AK.Genome-wide screen for inner nuclear membrane protein targeting in Saccharomyces cerevisiae: roles for N-acetylation and an integal membrane protein.Genetics, 2005,170(4):1553-1560.
[19] Van Damme P, Van Damme J, Demol H, et al.A review of COFRADIC techniques targeting protein N-terminal acetylation.BMC Proc, 2009, 3 Suppl 6:S6.
[20] Aivaliotis M, Gevaert K, Falb M, et al.Large-scale identification of N-terminal peptides in the halophilic archaea Halobacterium salinarum and Natronomas pharaonis.J Proteome Res, 2007, 6(6):2195-2204.
