谷氨酸棒杆菌和大肠杆菌生物合成L-甲硫氨酸的代谢工程改造研究进展
2023-08-12柳羽哲江泽沅王钰盛刘晓婷闵伟红
柳羽哲,江泽沅,高 欣,曾 琦,王钰盛,刘晓婷,闵伟红
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
L-甲硫氨酸又称L-蛋氨酸,于1923年被Mueller在分离酪蛋白过程中发现[1],与L-赖氨酸、L-苏氨酸及L-异亮氨酸同属天冬氨酸族氨基酸是生命体必需的唯一含硫氨基酸[2]。在生物体内L-甲硫氨酸具备重要生理生化功能,在DNA、蛋白质合成、催化功能调节和蛋白质翻译后修饰等过程中发挥着不可或缺的作用[3];作为合成前体和体内代谢中间体发挥重要作用,参与乙烯和多胺类物质合成,并参与细胞生长发育过程[4];还可以经过其代谢物S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)间接调节多种代谢过程,如作为甲基供体参与核酸、磷脂、蛋白质、肾上腺素、褪黑素、肌酸和其他化合物的代谢合成[5]。L-甲硫氨酸的生产方法主要包括化学合成法、生物酶拆分法、微生物发酵法[6-7]。目前,工业化生产L-甲硫氨酸的主要方式为化学合成法——丙烯醛法[8],但该方法产物为DL-混合型甲硫氨酸,存在分离困难、生产成本高、反应复杂、副产物多以及工业污染较严重的问题。酶拆分法生产L-甲硫氨酸所需底物较为昂贵,产生污染排放较大,不适合商业化生产。利用微生物发酵生产L-甲硫氨酸具有原料来源广、环境友好且生产成本低的优点[9],目前随着代谢工程策略及合成生物学工具的开发,微生物发酵法生产L-甲硫氨酸外的其他天冬氨酸族氨基酸已实现工业化[2,10]。由于L-甲硫氨酸合成途径存在复杂的反应及多级调控机制,L-甲硫氨酸尚未实现大规模的发酵生产。研究人员及生产商将研究目标投向探究微生物发酵法替代化学合成法工业生产L-甲硫氨酸的可能性。获得L-甲硫氨酸菌株的传统方式是利用诱变筛选或基于代谢控制发酵原理构建,但通过诱变获得的菌株在工业化发酵生产过程中容易出现发酵状态不稳定、菌体营养缺陷、生产水平低等问题[11]。近年来,随着代谢工程研究的深入,通过代谢工程优化通量并最终优化生物过程,在选育氨基酸生产菌株方面应用愈发丰富,代谢工程育种已成为诱变育种的有效替代策略。在氨基酸生产代谢工程改造过程中谷氨酸棒杆菌(Corynebacterium glutamicum)、大肠杆菌(Escherichia coli)等模式微生物已成为主要宿主[12-13]。本文对L-甲硫氨酸在C.glutamicum和E.coli中的生物代谢合成途径及调控网络机制、L-甲硫氨酸代谢工程改造策略的研究进展进行综述,旨在为L-甲硫氨酸代谢工程的进一步探究提供理论依据。
1 L-甲硫氨酸的生物合成途径及代谢网络调控机制
1.1 L-甲硫氨酸生物合成途径
L-甲硫氨酸的生物合成途径包括两个部分:中心代谢途径和天冬氨酸族氨基酸共同途径[14]。在中心代谢过程中,葡萄糖首先经糖酵解途径和戊糖磷酸途径生成磷酸烯醇式丙酮酸和丙酮酸,随后在磷酸烯醇式丙酮酸羧化酶(phosphopyruvate carboxylase,PEPC)和丙酮酸羧化酶作用下羧化生成草酰乙酸,在天冬氨酸氨基转移酶作用下生成L-天冬氨酸。随后L-天冬氨酸进入天冬氨酸族氨基酸共同途径,在天冬氨酸激酶(aspartokinase,AK)作用下L-天冬氨酸生成磷酸天冬酰胺,磷酸天冬酰胺在天冬氨酸半醛脱氢酶(aspartate semialdehyde dehydrogenase,ASD)催化下生成天冬氨酸半醛,天冬氨酸半醛随后进入两个途径——L-赖氨酸合成途径以及L-甲硫氨酸及L-苏氨酸合成途径。在高丝氨酸脱氢酶(homoserine dehydrogenase,HSD)催化下天冬氨酸半醛生成L-高丝氨酸,进入L-甲硫氨酸的分支代谢途径。在L-甲硫氨酸生物合成的第一个特异性反应中,首先L-高丝氨酸的γ-羟基被激活,在C.glutamicum和E.coli中分别以乙酰辅酶A和琥珀酰辅酶A作为酰基底物用于这一激活步骤。C.glutamicum中通过高丝氨酸乙酰转移酶(homoserine acetyltransferase,HAT)完成高丝氨酸的酰基化,生成的中间代谢产物为O-乙酰-L-高丝氨酸,对于硫的同化有两条途径可供选择,可以半胱氨酸作为硫的供体,或以硫化氢为硫的供体,前者在胱硫醚γ合成酶和胱硫醚β裂解酶催化下生成胱硫醚和高半胱氨酸,后者在O-乙酰-L-高丝氨酸硫化酶作用下直接合成高半胱氨酸[15]。E.coli中高丝氨酸琥珀酰转移酶(homoserine transsuccinylase,HTS)催化琥珀酰辅酶A和高丝氨酸缩合反应合成O-琥珀酰高丝氨酸。E.coli中只有一条硫化途径,是以半胱氨酸为硫源,琥珀酰高丝氨酸和半胱氨酸在琥珀酰高丝氨酸裂解酶(succinyl homoserine lyase,SHL)的作用下生成胱硫醚,胱硫醚在胱硫醚裂解酶作用下生成高半胱氨酸。L-甲硫氨酸生物合成的最后一步是分别由VB12依赖型甲硫氨酸合成酶(methionine synthase,MS)和VB12非依赖型MS催化完成,前者以叶酸循环途径产生的5-甲基-四氢叶酸为甲基供体,后者以丝氨酸分解代谢产生的5-甲基-四氢呋喃为甲基供体,为高半胱氨酸提供甲基从而合成L-甲硫氨酸,具体合成途径如图1所示。
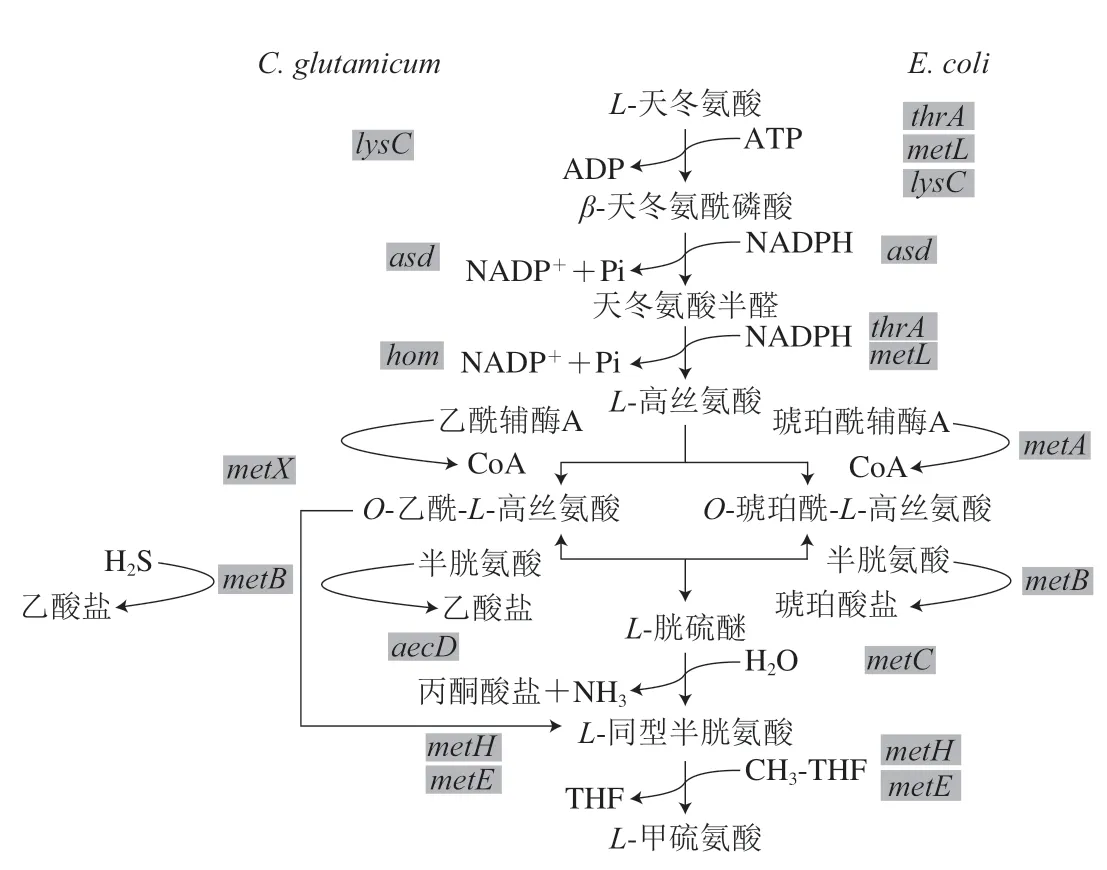
图1 L-甲硫氨酸生物合成途径Fig.1 L-Methionine biosynthesis pathway
1.2 L-甲硫氨酸代谢网络调控机制
L-甲硫氨酸生物合成途径在C.glutamicum和E.coli中生物合成中间体和调节机制存在异同。在E.coli中,PEPC受到更复杂的激活和抑制作用,包括苹果酸和天冬氨酸的反馈抑制作用。相比而言,C.glutamicum中PEPC在磷酸烯醇式丙酮酸到草酰乙酸的回补反应中发挥作用,但天冬氨酸对该酶并无调控作用[16]。
在天冬氨酸族氨基酸共同途径中,AK作为关键限速酶,在E.coli中包含同工酶AKI、AKII和AKIII 3 种,分别由lysC、thrA和metL基因编码,受L-赖氨酸、L-苏氨酸及产物L-甲硫氨酸的反馈调节[9],3 个基因均在转录水平上受到调控,但只有lysC和thrA相关酶受其代谢途径L-赖氨酸和L-苏氨酸的反馈控制。在C.glutamicum中,仅含有1 种AK,由lysC基因编码,受到分支途径L-赖氨酸和L-苏氨酸的协同反馈抑制[17]。ASD由asd基因编码,在E.coli中其受到L-赖氨酸、L-苏氨酸及L-甲硫氨酸的反馈阻遏,但在C.glutamicum中该酶不受终产物的抑制。HSD是天冬氨酸族氨基酸共同途径的第二个关键酶,在E.coli中含有两个同型双功能酶AKI-HSDI和AKII-HSDII,分别由thrA和metL基因编码,其活性受苏氨酸的抑制[18]。在C.glutamicum中HSD是一种单功能酶,由hom基因编码,其表达受到产物L-甲硫氨酸反馈阻遏,由于其结构C-末端ACT结构域的存在,对L-苏氨酸的反馈抑制较为敏感[19]。在E.coli中HTS由metA基因编码,在C.glutamicum中HAT由metX基因编码,表达及活性均受产物L-甲硫氨酸和代谢物SAM所抑制。VB12依赖型MS和VB12非依赖型MS分别由metH基因编码和metE基因编码[20]。SAM是在S-腺苷甲硫氨酸合成酶(S-adenosylmethioninesynthetase,SAMS)催化下由L-甲硫氨酸和ATP反应生成,在C.glutamicum和E.coli中SAMS由metK基因编码,其合成受L-甲硫氨酸反馈抑制[21]。C.glutamicum和E.coli中L-甲硫氨酸合成途径的具体反馈调节信息如图2、3所示。
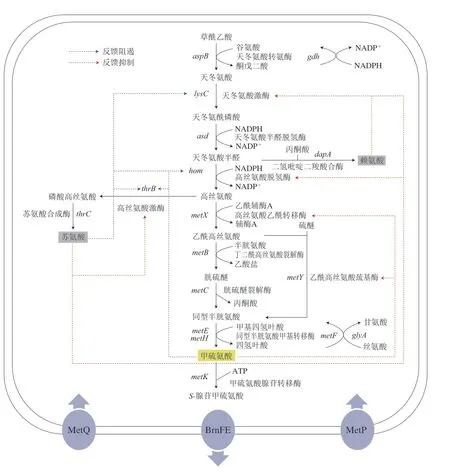
图2 C.glutamicum中L-甲硫氨酸反馈调节Fig.2 Feedback regulation of L-methionine in C.glutamicum
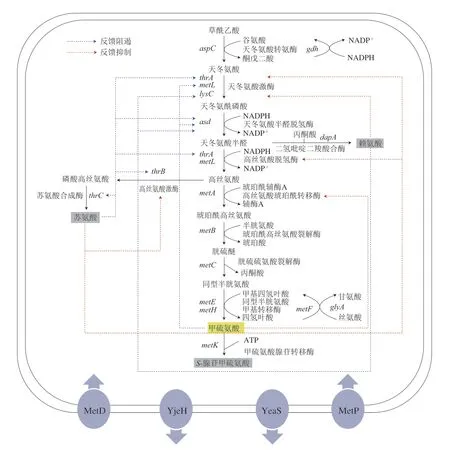
图3 E.coli中L-甲硫氨酸反馈调节Fig.3 Feedback regulation of L-methionine in E.coli
L-甲硫氨酸生产菌经代谢工程生物合成途径改造后,胞内氨基酸过量积累会使其代谢途径中一些关键酶的催化活性受到抑制,降解途径中的前体利用率增加,导致菌株生长受影响[22]。通过随机突变或基因组DNA文库的表型筛选、转录组学分析和序列相似性搜索技术可以确认L-甲硫氨酸的转运蛋白,对其合理利用可调节L-甲硫氨酸的摄入和输出[23]。在E.coli中,存在MetD和MetP两条专一性L-甲硫氨酸的胞内运输系统。MetD操纵子包含metN、metI、metQ,分别编码腺苷三磷酸结合盒转运蛋白(ABC转运蛋白元件)——ATP酶、L-甲硫氨酸渗透酶和L-甲硫氨酸结合蛋白,MetD能够运输甲硫氨酸及其结构类似物[24]。E.coli中向胞外运输甲硫氨酸存在YeaS和YjeH两个系统。YeaS属于RhtB运输蛋白家族,其表达受亮氨酸调控蛋白Lrps的调节。YjeH属氨基酸-多胺-胆碱运输蛋白家族,类似于YeaS转运系统的作用机制,通过增强E.coli对L-甲硫氨酸及其结构类似物的抵抗能力,促进菌体内多余L-甲硫氨酸的主动排出,从而降低胞内L-甲硫氨酸的浓度[25]。E.coli中MetJ是L-甲硫氨酸合成的重要阻遏蛋白,可抑制metL、metA、metB、metC和metE基因的表达。与MetJ不同,MetR是一类转录激活因子,过表达后可有效促进L-甲硫氨酸的合成。在C.glutamicum中BrnFE系统可催化L-甲硫氨酸的主动输出[26]。C.glutamicum对L-甲硫氨酸的吸收包括两个转运蛋白复合体MetD和MetP,调控L-甲硫氨酸由胞内向胞外的转运,其中MetD由metN、metI和metQ组成的基因簇编码,属于ABC转运蛋白超家族MUT亚家族,其表达受转录因子mcbR调控;MetP由metP和metS基因编码,属于钠离子能量偶联转运体家族,其表达形式为组成型表达[27]。
2 L-甲硫氨酸合成途径代谢工程改造
根据代谢工程改造菌株提高目标氨基酸产量的“进、通、截、堵、出”五字策略[10],依据目标氨基酸代谢合成途径及网络调控机制,代谢工程L-甲硫氨酸改造策略主要包括以下5 个方面:1)解除代谢途径对关键酶的反馈作用;2)阻断或削弱支路代谢途径;3)中心代谢调控网络的优化;4)增强辅助因子的供应;5)转运系统的优化。
2.1 解除代谢途径对关键酶的反馈作用
如前所述,C.glutamicum和E.coli中L-甲硫氨酸合成途径存在多分支、多水平的反馈调节,许多关键酶受相应代谢物的反馈抑制或(和)反馈阻遏。反馈抑制指在生物合成过程中代谢途径终产物对相关酶引起的活性抑制调节[28]。生物合成途径的终产物达到一定水平时对代谢途径关键酶表达量的调节会引起反馈阻遏[29]。在菌株发酵产氨基酸的正向代谢工程中,解除代谢途径关键酶受到的反馈调节可有效促进目标产物L-甲硫氨酸的合成,代谢流的疏通可作为一种策略提高L-甲硫氨酸产量[30]。
L-赖氨酸和L-苏氨酸合成途径作为L-甲硫氨酸合成的分支代谢途径,分别通过天冬氨酸-4-半醛和L-高丝氨酸实现代谢流的竞争[31]。除来自于末端代谢产物的反馈抑制,L-甲硫氨酸合成途径中还有一些关键酶受胞内中间代谢产物的抑制作用。在E.coli中AK的表达分别受L-苏氨酸、L-赖氨酸和L-甲硫氨酸的反馈调节[9],其中lysC和thrA及由其编码的AK分别受到L-赖氨酸和L-苏氨酸的反馈阻遏和反馈抑制,metL受到L-甲硫氨酸反馈阻遏。在C.glutamicum中由lysC编码的AK表达受L-苏氨酸和L-赖氨酸的协同反馈阻遏[32],在酶活力水平上受L-赖氨酸和L-苏氨酸的反馈抑制。C.glutamicum中构建AK定点突变体A279T和G359D,其中A279T突变体氨基酸由疏水性变为亲水性致使AK分子构象改变,与配体间的非共价键作用被打破,G359D的突变使Arg151与底物结合位点Glu74之间无法形成离子键,可在一定程度上解除L-苏氨酸和L-赖氨酸对AK的反馈阻遏[33-34]。在E.coli中HSD作为双功能酶由thrA和metL编码,其中基因thrA在转录水平上受L-苏氨酸抑制。在C .glutamicum中,HSD活性受L-苏氨酸的反馈抑制,其表达受到产物L-甲硫氨酸反馈阻遏,在构建C.glutamicum产L-甲硫氨酸菌株中,将HSD第377位的甘氨酸突变为谷氨酸,可消除L-苏氨酸对HSD的反馈抑制[35]。E.coli中HTS由metA基因编码,除受L-甲硫氨酸抑制外,其表达还受下游代谢产物SAM抑制,将HTS的第896位碱基由A突变为G或第71位碱基由C突变为A,能够解除末端产物L-甲硫氨酸和SAM的反馈抑制[36]。
2.2 阻断或削弱支路代谢途径
在天冬氨酸族氨基酸共同途径中,碳流通过天冬氨酸-β半醛和L-高丝氨酸后流向分支代谢途径,阻断或削弱分支代谢途径可有效调节碳源更多流向目标氨基酸L-甲硫氨酸代谢途径,实现L-甲硫氨酸产量的提升。主要方法包括:L-苏氨酸和L-赖氨酸营养缺陷型的筛选,弱化L-苏氨酸和L-赖氨酸的合成;敲除dapA和thrB基因阻断L-苏氨酸和L-赖氨酸的合成。C.glutamicum中,敲除基因thrB可以获得L-苏氨酸营养缺陷型菌株,在阻断碳流流向L-苏氨酸途径的同时解除L-苏氨酸对AK和HSD的协同反馈抑制作用[35,37-38]。在C.glutamicumATCC13032中通过对基因thrB敲除阻断L-苏氨酸合成途径,对dapA中起始密码子ATG用GTG代替,弱化L-赖氨酸合成途径,与野生型对比,C.glutamicum工程菌L-甲硫氨酸产量增加3 倍,最终达到2.99 g/L[38]。在E.coliW3110中,通过敲除thrBC基因构建L-苏氨酸营养缺陷型菌株,L-甲硫氨酸产量由不可检测提升至0.008 g/L[39]。E.coliK-12/pKD46菌株中,dapA基因缺失后代谢物L-甲硫氨酸产量提高2.61 倍[40]。
2.3 中心代谢调控网络的优化
一直以来,L-甲硫氨酸中心代谢途径碳分布不平衡是迫切需要解决的问题,其阻碍了代谢物生物合成产量和产率的进一步提高。中心代谢调控网络的优化主要包括碳源利用途径的优化、副产物合成途径的敲除、模块化代谢工程和全局转录机器工程等[41]。通过细菌的转录、代谢组学分析可以了解菌株代谢并为后期改造提供重要线索。通量平衡分析(flux balance analysis,FBA)的使用能够精确地计算和分析比对代谢网络内产物的理论得率和最佳代谢途径[42]。通过系统分析策略对中心代谢和选定的L-甲硫氨酸生物合成途径中的80 个基因表达进行抑制或上调,利用代谢组学数据进一步揭示了中心代谢通量分布更均匀的最优菌株L-甲硫氨酸生物合成途径,将L-甲硫氨酸生物合成途径模块化,同时进行迭代遗传修饰以揭示多层限制并逐步提高L-甲硫氨酸产量,最终达到16.86 g/L[43]。L-甲硫氨酸工程菌培养发酵过程中,在发酵培养基中添加Ca2+,FBA结果表明添加CaCO3加强了三羧酸循环,使细胞内ATP浓度增加了39.28%,柠檬酸合成酶和氧化磷酸化途径的调节是L-甲硫氨酸过量生产的重要原因,碳、ATP和辅因子通量的重新分布与E.coliW3110-BL协同改善L-甲硫氨酸生物合成效率,产量达到1.48 g/L,比未添加Ca2+的对照组高57.45%[44]。
2.4 增强辅助因子的供应
辅助因子的供给和平衡能够避免阻碍代谢途径,对目标氨基酸的合成效率也发挥重要作用,是氨基酸代谢工程的一个重要影响因素。相比于其他氨基酸,合成L-甲硫氨酸需要更多的辅助因子NADPH,是合成L-赖氨酸的2 倍,合成L-谷氨酸的8 倍[38]。NADPH在C.glutamicum和E.coli中以不同的方式提供。C.glutamicum中NADPH主要通过磷酸戊糖途径中由zwf编码的葡萄糖-6-磷酸脱氢酶以及由gnd编码的6-磷酸葡萄糖酸脱氢酶协同催化合成。在E.coli中主要通过利用膜结合的转氢酶完成从NADH到NADPH的转化。增强NADPH的供应最常用的策略是重新分配糖酵解和磷酸戊糖途径之间的代谢流量比。在C.glutamicum中将zwf基因727位点的G突变为A,gnd基因1 083位点的T突变为C,解除葡萄糖-6-磷酸脱氢酶和6-磷酸葡萄糖酸脱氢酶的反馈抑制,并异源过表达E.coli中基因gapC,细胞内NADPH水平增加448.2%,L-甲硫氨酸产量增加64.1%[45]。第二种策略是通过糖酵解产生NADPH,通过改变天然NAD依赖性甘油醛3-磷酸脱氢酶编码基因gapA对NADP的辅酶特异性[46]。第三种策略是过量表达来自E.coli的整合烟酰胺核苷酸转氢酶,膜结合转氢酶编码基因PntAB可促进NADP+向NADPH的转化[47]。过量的NADPH会被用于代谢途径中其他代谢物的合成,仅通过NADPH的供应促进L-甲硫氨酸的生产是有限的,利用系统代谢工程进一步提高L-甲硫氨酸产量非常必要[45]。
2.5 转运系统的优化
用于分子转运的载体蛋白在氨基酸代谢生物合成途径中发挥着重要作用。L-甲硫氨酸在胞内合成后,需要尽快将合成的多余甲硫氨酸运输到胞外,避免在胞内过量积累产生一定毒性使细胞死亡,防止L-甲硫氨酸过量引起的反馈抑制和反馈阻遏,同时有利于L-甲硫氨酸后续提取工艺的进行[48]。对L-甲硫氨酸分泌和吸收运输协同的改造可以促进L-甲硫氨酸的胞内合成,有利于胞外积累。研究发现可通过在E.coli中敲除metN、metI、metQ基因弱化L-甲硫氨酸胞内MetD运输系统的转运,过表达YjeH转运蛋白编码基因yjeH能够加强胞外转运能力,但会影响菌株生长[49]。在E.coli中YeaS运输系统的编码基因yeaS过表达,可提升L-甲硫氨酸胞外运输的能力[24]。对E.coli中异源引入基因cysBT149P替换E.coli内源cysB从而构建突变菌株能够有效地解除CysB激活蛋白调控cys操纵子的调控,促进L-甲硫氨酸生物合成途径中硫代谢相关基因的表达,提高代谢物的产量[25]。对C.glutamicum中硫代谢途径调控因子mcbR基因进行敲除或修饰,可解除其对菌株生产能力的阻遏,使L-甲硫氨酸产量提升[37]。MetD运输系统的表达也受转录因子mcbR的调控,敲除基因簇中任意基因均能够使MetD运输系统丧失活性[38]。C.glutamicum中过表达L-甲硫氨酸分泌系统BrnFE能使L-甲硫氨酸产量提高[37]。C.glutamicum中Lrp作为一种转录调控因子可影响L-甲硫氨酸的合成,通过对胞内L-甲硫氨酸浓度的响应,激活转运蛋白BrnFE表达从而稳定胞内L-甲硫氨酸浓度[50]。在未来,结合可见光荧光响应官能团与目的转运蛋白融合进一步改进生物传感器的方法,可更好地用于了解细胞内L-甲硫氨酸代谢通量[23,51]。
3 L-甲硫氨酸生物合成进展
在过去的20 年里,L-甲硫氨酸在C.glutamicum和E.coli中代谢途径和调控机制得到深入研究,人们在改进L-甲硫氨酸发酵方面不断做出努力和贡献。
随着L-甲硫氨酸代谢途径的确认,研究人员首先集中于利用基因表达调控及突变株的选育以提高L-甲硫氨酸产量。Moeckel等[52]对一株已改造的赖氨酸生产菌株中metX和metY基因过表达,弱化产物对HAT及乙酰高丝氨酸硫基酶的反馈抑制,强化L-甲硫氨酸合成途径,最终积累量达到16 g/L。Maier等[53]在一株抗反馈抑制E.coli中敲除编码阻遏蛋白基因metJ,并过量表达运输蛋白编码基因yjeH,强化合成途径及运输基因的表达,L-甲硫氨酸产量达到4.8 g/L。Krömer等[54]通过代谢途径分析预测C.glutamicum和E.coli在L-甲硫氨酸的生产上有巨大潜力。随后该团队对C.glutamicum代谢途径中调节L-甲硫氨酸生物合成和硫同化的重要基因mcbR进行敲除,使L-甲硫氨酸积累量达到3.4 g/L[55]。Park等[35]对一株已解除赖氨酸反馈抑制的C.glutamicum进行改造,通过敲除苏氨酸途径关键酶编码基因thrB以弱化支路途径,并提高HSD的表达量削弱反应中间代谢物带来的反馈抑制,在摇瓶发酵后测定胞外L-甲硫氨酸积累量为2.9 g/L。
酶的定向进化、基因敲除、基因过表达等方法在L-甲硫氨酸发酵生产过程中得到广泛应用后,研究人员渐渐投身于合成途径的完善与整合。Qin Tianyu等[37]敲除C.glutamicum中mcbR基因释放合成途径相关基因的转录抑制,上调metX转录水平,过表达homFbr、lysCFbr及运输蛋白编码基因brnFE,增加前体供应并增加L-甲硫氨酸胞外浓度,最终L-甲硫氨酸产量达到6.3 g/L。李莹[56]以C.glutamicumATCC13032为出发菌株,敲除编码产物主要吸收系统基因metD,通过诱变解除末端代谢产物对甲硫氨酸合成途径的反馈抑制作用,敲除thrB基因以阻断L-苏氨酸合成,对dapA、lysC、pyc基因进行定点突变以削弱分支代谢途径并解除相关酶的反馈抑制,过表达来自丙酮丁醇梭菌的外源基因gapC,从而增强胞内NADPH供应,最终L-甲硫氨酸产量达到9.88 g/L。Huang Jianfeng等[57]以E.coliW3110为出发菌株,敲除阻遏蛋白基因MetJ、向胞内运输L-甲硫氨酸的运输蛋白基因MetI、过量表达metAFbr和运输蛋白基因yjeH以提高碳流流向目标产物,加强胞外运输能力,并用Na2S2O3为硫源,5 L发酵罐补料发酵48 h,L-甲硫氨酸终产量达到9.75 g/L。
由于L-甲硫氨酸代谢途径存在复杂的基因表达与调控,通常只能进行局部代谢调控而较难实现对全局代谢的调控。近几年随着代谢工程策略与合成生物学工具的发展,以系统和全局的方式促进L-甲硫氨酸生产的相关研究逐渐显现。Huang Jianfeng等[43]以E.coliW3110 IJ/pA*H为研究对象,基于CRISPR-Cas9技术对中心代谢途径和氨基酸生物合成途径进行系统分析,进一步揭示包括转录调节、变构调节、同型半胱氨酸甲基化、甲基四氢叶酸(tetrahydrogen folic acid,CH3-THF)供应、o-琥珀酰-L-高丝氨酸供应和L-丝氨酸在内的限制L-甲硫氨酸生物合成的6 层瓶颈,代谢组学分析结果表明,多个基因修饰能有效地重新分配代谢通量,促进L-甲硫氨酸的生物合成。魏磊[58]利用CRISPR-Cas9技术对L-甲硫氨酸合成过程的阻遏因子metJ及其竞争途径——赖氨酸和苏氨酸合成途径的lysA和thrC以及sucCD进行敲除,同时定点改造AK编码基因为产物反馈抑制不敏感型的lysCmut和thrAmut,将植物中的胱硫醚-γ-合成酶基因cgs和高半胱氨酸甲基转移酶基因hmt和甲硫氨酸甲基转移酶基因mmt组合在已改造后的菌株中进行过表达,L-甲硫氨酸产量最终达804 mg/L,是野生型的12 倍。Niu等[59]用FBA对重组E.coliW3110分批发酵L-甲硫氨酸的代谢通量进行分析,估算不同溶氧条件下细胞内的通量分布,发现在30%溶解氧水平下获得的L-甲硫氨酸生产通量高于其他溶解氧水平。Zhu Wenyuan等[60]利用发酵与生物催化相结合的方法生产L-甲硫氨酸,将经系统分析优化构建的o-琥珀酰基-L-高丝氨酸生产菌E.coliW3110(DE3)ΔIJB*TrcmetL/pTrc-metAfbr-Trc-thrAfbr-yjeH经发酵提取上清液,在o-琥珀酰基-L-高丝氨酸巯基酶和甲硫醇钠存在的情况下转化为L-甲硫氨酸,降低菌株修饰难度,使L-甲硫氨酸产量达21.1 g/L。研究人员不断利用C.glutamicum和E.coli进行L-甲硫氨酸代谢途径的改造,然而合成L-甲硫氨酸的多层次调控和复杂性尚未得到解决,对L-甲硫氨酸的大规模生产之间仍然存在一些差距。随着科学技术的不断发展,现有研究很大程度扩展了对L-甲硫氨酸生物合成多层次多级调控的认识,并为工业化生产L-甲硫氨酸奠定基础。表1汇总了部分L-甲硫氨酸代谢途径改造策略。

表1 L-甲硫氨酸代谢途径改造策略部分汇总Table 1 Summary of L-isoleucine metabolic pathway modification strategies
吉林农业大学食品科学与工程学院酶分子改造及食品营养分子调控团队通过定向进化酶分子改造强化关键酶的表达,解除或削弱代谢途径相关酶反馈抑制,并通过代谢工程构建高产L-甲硫氨酸工程菌,致力于利用微生物发酵法提高L-甲硫氨酸产量的研究[65-69]。团队首次发现与C.glutamicum同源相似性达99%的北京棒杆菌(C.pekinense)AK单体别构酶,揭示了单体AK别构调控机制,至今已构建了140余株突变菌株,其中酶活力最大提高99.43 倍,异源表达AK优化后构建C.glutamicum工程菌PEC-lysCm-homm-metX的L-甲硫氨酸最高产量达6.85 g/L,较原菌提高274.32%,具体AK改造后酶活力提升情况如表2所示,为系统阐明关键酶与蛋氨酸生物合成代谢网络相互作用关系,为棒杆菌L-甲硫氨酸合成代谢的调节和氨基酸菌种选育提供了良好借鉴。未来,团队将集中在现有研究成果基础上结合CRISPR技术,深入研究多分支、多水平调控氨基酸合成途径方法,微生物发酵方法的研究以及溶氧、pH值等发酵参数的优化,以求高效改造L-甲硫氨酸生物合成途径,推进玉米淀粉高效生物转化L-甲硫氨酸工业化进程。
4 结语
L-甲硫氨酸作为生命体不能自主合成的必需独特含硫氨基酸,在食品、医药、动物饲料、化妆品等方面应用广泛[75-76],具有重要的工业经济价值。近几年,随着代谢工程技术与合成生物学的迅速发展,适应性进化、基因组编辑、基因表达调控等广泛开发,研究人员已将这些方法应用于L-甲硫氨酸的生产研究中。虽然已经阐明了L-甲硫氨酸合成途径中的代谢调控机制,但通过微生物发酵生产L-甲硫氨酸尚未实现工业化。
在目前的研究报道中,提高L-甲硫氨酸产量具体策略主要包括:优良出发菌种的选择、高产菌株的高通量筛选、合成途径的合理选择以及发酵条件的优化。过表达、弱化表达、定向进化和目标基因的缺失与替换等方法已被广泛应用于优化L-甲硫氨酸生物合成途径。以往对于生物合成L-甲硫氨酸相关的改造研究普遍集中于对天冬氨酸族氨基酸共同途径的代谢调控,但中心代谢途径中碳流量和辅助因子通量变化也会直接影响L-甲硫氨酸的合成能力,后续的研究可主要着重于:1)对中心代谢调控展开更细化的讨论,并在产量最大化的基础上尽量精简调控路线,节约实验成本;2)目前动态调控、精确调控已成为代谢工程研究的主要策略,合理利用动态调控、精细调控代谢过程以平衡菌株生长发育过程与L-甲硫氨酸合成的关系,能够有效调节菌株生产效率并提高L-甲硫氨酸的转化率;3)以合理设计为前提、正向代谢工程为基础的系统代谢工程进行综合应用,深入应用组学数据分析方法,建立计算机高级代谢网络模型,并加强进化、反向代谢工程在高产L-甲硫氨酸代谢工程中的研究利用以提高氨基酸菌株育种效率;4)利用多学科领域交叉联合手段综合运用L-甲硫氨酸代谢设计,利用计算机分析建立基因组精细代谢表达调控模型指导L-甲硫氨酸生产,结合生物传感器、新型功能元件挖掘、CRISPR基因编辑和全基因组池CRISPR干扰等技术进行L-甲硫氨酸代谢途径改造。随着生物信息学与合成生物学的发展与应用,未来利用代谢工程技术生产L-甲硫氨酸将有望实现工业化,L-甲硫氨酸产业将会为人们带来更高的经济效益。
