超高压辅助离子液体提取/HPLC分析牛蒡子中牛蒡苷与牛蒡苷元
2013-11-28耿岩玲刘建华刘代成
王 迪,耿岩玲,王 晓,刘建华,刘代成,刘 峰*
(1.山东师范大学 生命科学学院,山东 济南 250014;2.山东省科学院山东省分析测试中心,山东 济南 250014)
牛蒡子为菊科植物牛蒡Arctium lappa L.的干燥成熟果实,具有疏散风热、宣肺透疹,解毒利咽的功效,用于治疗风热感冒、咳嗽痰多、麻疹、风疹、咽喉肿痛等症[1]。现代医学证明,牛蒡子具有抗肿瘤、抗菌、降血糖等功能[2-4]。牛蒡子含有丰富的木脂素类化合物、亚油酸、亚麻酸、挥发油等成分。其中,以牛蒡苷的含量最高,牛蒡苷经水解生成牛蒡苷元[5]。牛蒡苷和牛蒡苷元具有抗炎和免疫调节[6]、抗病毒[7]、抗肿瘤[8]、治疗肾病[9]等多种药理作用。
目前,从牛蒡子中提取牛蒡苷和牛蒡苷元主要采用加热回流法[10]、超临界萃取法[11]和超声波辅助提取法[12]。超高压提取技术应用于中药有效成分提取时,是利用100 MPa以上的流体静压力作用于溶剂和中药的混合液,保压数分钟后泄压,然后进行分离纯化,从而达到提取的目的[13]。与传统技术相比,超高压提取可以大大缩短提取时间、降低能耗、减少杂质成分的溶出,提高有效成分的收率,避免了因热效应引起的有效成分结构变化、损失以及生理活性的降低[14]。同时超高压提取在密闭的环境中进行,没有溶剂的挥发,因此该技术更加符合绿色环保的要求[15]。目前超高压提取技术已在茶叶中提取茶多酚[16]、甜叶菊中提取甜菊糖甙[17]、金银花中提取总黄酮[18]、大豆中提取大豆卵磷脂[19]等多种植物有效成分的提取中获得应用。离子液体是指全部由离子组成的液体,与传统有机溶剂相比,离子液体是一种环境友好溶剂,具有温度区间大、溶解范围广、化学和热稳定性好,且几乎没有蒸汽压,同时具有不挥发、不易燃烧和爆炸等优点。
本文以离子液体为溶剂,采用超高压提取技术从牛蒡子中提取牛蒡苷和牛蒡苷元,通过对离子液体类型、浓度、提取压力、时间、料液比等单因进行素实验确定了提取工艺条件,以期为综合利用牛蒡子资源,开发牛蒡苷和牛蒡苷元活性成分提供参考。
1 实验部分
1.1 材料与试剂
牛蒡子购于山东中医药大学中鲁医院,经山东省分析测试中心王晓研究员鉴定为牛蒡Arctium lappa L.的干燥成熟果实。牛蒡苷、牛蒡苷元对照品(纯度≥98%,成都曼思特生物科技有限公司);乙醇、甲醇为分析纯(济南巨业化学试剂有限公司);1-丁基-3-甲基咪唑六氟磷酸盐、1-己基-3-甲基咪唑四氟磷酸盐、氯化1-己基-3-甲基咪唑、溴化1-己基-3-甲基咪唑、溴化1-辛基-3-甲基咪唑、溴化1-癸基-3-甲基咪唑、溴化1-十二烷基-3-甲基咪唑(CnmimX,纯度为99%,上海成捷化学有限公司);HPLC分析用乙腈为色谱纯(山东禹王实业有限公司);实验用水为二次蒸馏水。
1.2 仪器与设备
HPP·L3-600型超高压生物提取设备(天津市华泰森淼生物工程技术有限公司);Agilent 1120型高效液相色谱仪(美国Agilent公司);SB-5200D型超声波提取仪(宁波新芝生物科技股份有限公司)。
1.3 实验方法
1.3.1 样品制备 将干燥后的牛蒡子用中药粉碎机粉碎,过40目筛。得到粉末状样品,放置于干燥处备用。
1.3.2 色谱条件 Hypersil ODS C18色谱柱(4.0 mm×150 mm,5 μm);流动相A为乙腈,B为0.10%磷酸溶液;梯度洗脱程序:0~20 min,25%~55%A;20~21 min,55%~100%A;21~30 min,100%A;流速1 mL·min-1;检测波长280 nm。
1.3.3 超高压提取(UPE) 称取样品0.50 g,转入聚乙烯塑料袋中,按照一定的料液比加入不同溶剂,密封。在室温(25℃)下浸泡4 h后,在一定压力下,提取一定时间,泄压。提取液用0.45 μm微滤膜过滤,乙醇定容至50 mL后HPLC测定含量。所有实验均重复3次,取平均值。
1.3.4 超声提取(UAE) 称取样品1.0 g,分别加入甲醇、乙醇、0.8 mol/L的C12mimBr溶液各20 mL,在室温下浸泡4 h后,于超声频率30 kHz下,提取30 min。提取液用0.45 μm微滤膜过滤,乙醇定容至50 mL后HPLC测定含量。所有实验均重复3次,取平均值。
1.3.5 加热回流提取(HRE) 称取样品1.0 g,加入甲醇、乙醇、0.8 mol/L的C12mimBr溶液各20 mL,在室温下浸泡4 h后,分别于60、80、100℃下提取2 h。提取液用0.45 μm微滤膜过滤,乙醇定容至50 mL后HPLC测定含量。所有实验均重复3次,取平均值。
2 结果与讨论
2.1 离子液体条件的优化
2.1.1 离子液体类型对提取率的影响 分别采用1.0 mol/L的C4mimPF6、C4mimBF4、C4mimCl、C4mimBr溶液为提取溶剂,固定料液比1∶20(g/mL),在压力200 MPa下浸提2 min,不同离子液体类型对提取率的影响如图1所示。由图1可知,C4mimBr溶液更显优势,其对牛蒡苷和牛蒡苷元的提取率分别为13.11、3.84 mg/g。由此可以看出,目标化合物的提取率与离子液体的类型有关,阴离子影响的大小关系为Br->
2.1.2 离子液体碳链长度对提取率的影响 分别采用 1.0 mol/L 的 C4mimBr、C6mimBr、C8mimBr、C10mimBr、C12mimBr溶液为提取溶剂,固定料液比1∶20(g/mL),在压力200 MPa下浸提2 min,不同碳链长度对提取率的影响如图2所示。由图2可知,离子液体的碳链长度对提取率有很大影响,随着碳链长度的增加,提取率随之升高。这是因为随着碳链长度的增加,离子液体的疏水性增强,同时,咪唑基阳离子与牛蒡苷、牛蒡苷元之间存在的π-π跃迁、氢键、离子化等作用可有助于目标化合物在离子液体溶液中溶解,从而提高提取率。考虑到离子液体阴、阳离子对提取率的影响,选取C12mimBr溶液作为目标化合物的提取溶剂。
2.1.3 离子液体浓度对提取率的影响 分别配制0.5、0.8、1.0、1.2、1.4 mol/L的C12mimBr溶液,固定料液比1∶20(g/mL),加入上述不同浓度的离子液体,在200 MPa下浸提2 min,离子液体浓度对提取率的影响如图3所示。由图可知,当离子液体浓度由0.5 mol/L增至0.8 mol/L时,溶剂对目标化合物的溶解能力和萃取能力增强。原因是离子液体与牛蒡子基体和木质素化合物的相互作用增强,从而加速了牛蒡子中木质素类化合物的萃取和水解,提高了牛蒡苷和牛蒡苷元的提取率。而当离子液体浓度继续增大时,提取率明显降低,这是因为随着离子液体浓度的增大,溶液黏度增大,扩散能力减弱,离子液体难渗入到牛蒡子样品基质内部,导致提取率降低。因此,选择0.8 mol/L的C12mimBr溶液为最佳提取溶剂。
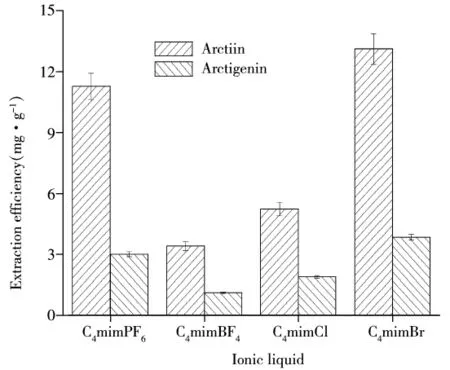
图1 离子液体类型对提取率的影响Fig.1 Effect of ionic liquid type on the extraction yield
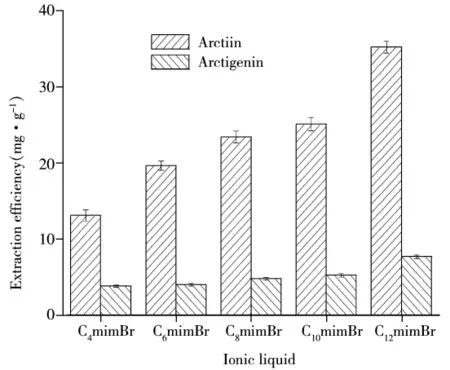
图2 不同碳链长度离子液体对提取率的影响Fig.2 Effect of carbon chain length on the extraction yield
2.2 提取工艺的优化
2.2.1 提取压力对提取率的影响 以0.8 mol/L的C12mimBr溶液为溶剂,选择料液比1∶20(g/mL),分别在100、200、300、400、500 MPa高压下浸提2 min,提取结果见图4。结果表明,随着超高压压力的升高,提取率随之提高,达到200 MPa后,再增加压力,提取率基本不变。在200 MPa以下,随着压力的升高,有效成分的传质速率加快,细胞壁和细胞膜被破坏的数量增加,因此提取率随压力的增加而提高,压力大于200 MPa时,细胞的细胞壁和细胞膜被充分破坏,目标化合物已充分溶出,此时再提高压力,对提取率影响不大。
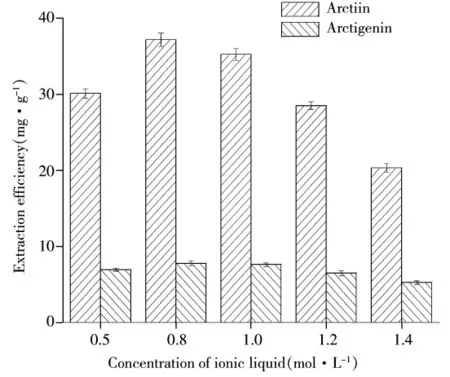
图3 不同浓度C12mimBr对提取率的影响Fig.3 Effect of C12mimBr concentration on the extraction yield
2.2.2 提取时间对提取率的影响 以0.8 mol/L的C12mimBr溶液为溶剂,料液比1∶20(g/mL),200 MPa高压下分别浸提1、2、3、4、5 min,提取结果显示,在前2 min,牛蒡苷和牛蒡苷元的提取率随提取时间的增加而增加,超过2 min后,提取率基本不随提取时间而变化。由于超高压提取的过程是先对物料加压,保持一定时间后突然泄压,在增压过程中,细胞内外出现超高压差,溶剂在压力作用下迅速渗透到细胞内;卸压过程中压力由几百兆帕迅速降为常压,同样,在内外压差作用下,有效成分从细胞内向周围溶剂内扩散,从而大大加快了有效成分向外扩散的速率。200 MPa高压下牛蒡子的细胞破裂很快,2 min内已充分破裂,此时,继续延长提取时间对提取率影响不大。
2.2.3 料液比对提取率的影响 以0.8 mol/L的C12mimBr溶液为溶剂,在200 MPa高压下浸提2 min,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶30(g/mL)时的提取结果见图5。由图5看出,当料液比在1∶5~1∶30范围内时,随着加入的溶剂量增加,提取率增加,当料液比超过1∶20时,提取率增加缓慢,趋于稳定。考虑到成本费用等因素,选取最佳料液比为1∶20。
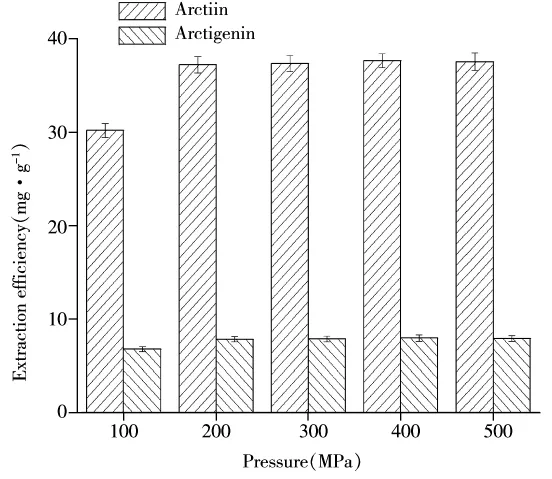
图4 提取压力对提取率的影响Fig.4 Effect of extraction pressure on the yield of arctiin and arctigenin
2.3 最佳提取条件
综上所述,超高压辅助离子液体提取牛蒡子中牛蒡苷和牛蒡苷元的最佳工艺条件为:0.8 mol/L的C12mim Br为溶剂,提取压力200 MPa,料液比1∶20(g/mL),提取时间2 min,此时得到牛蒡苷和牛蒡苷元的提取率分别为37.15 mg/g和8.04 mg/g,图6为对照品和牛蒡子样品的色谱图。将提取样品量增至20 g,按照上述条件进行提取实验,重复3次,牛蒡苷和牛蒡苷元的平均提取率分别为36.99 mg/g和7.86 mg/g,比样品量小时的提取效率略低。
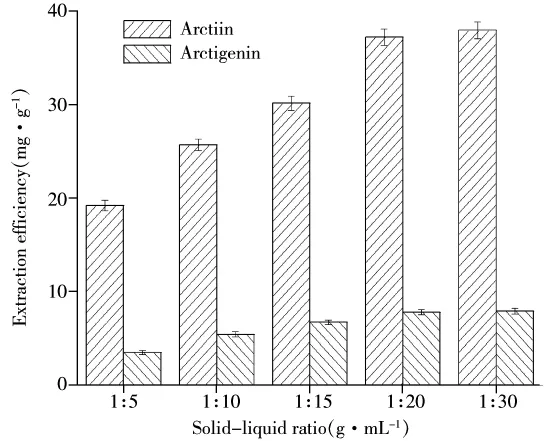
图5 料液比对提取率的影响Fig.5 Effect of solid solvent ratio on the extraction yield
2.4 超高压提取与其他提取方法的比较
分别采用超高压、超声和加热回流方法进行提取,并采用不同的溶剂,比较提取率和提取时间,结果如表1所示。在相同提取方法下,0.8 mol/L C12mimBr的提取效果明显高于乙醇,而略低于甲醇,但离子液体环境友好、无污染,作为提取溶剂有明显的优越性。
在相同溶剂条件下,超高压的提取率均明显高于超声10 min以及加热回流30 min条件下的提取率;而当超声时间为30 min或加热回流120 min时,超高压的提取率略低于超声和加热回流方法。但超高压提取时间只有2 min,是超声方法的1/15,加热回流方法的1/60,极大地节省了提取时间,提高了工作效率。因此,超高压辅助离子液体提取牛蒡子中的牛蒡苷和牛蒡苷元能在极短的时间内达到较高的提取率,是一种高效、环保的提取方法。
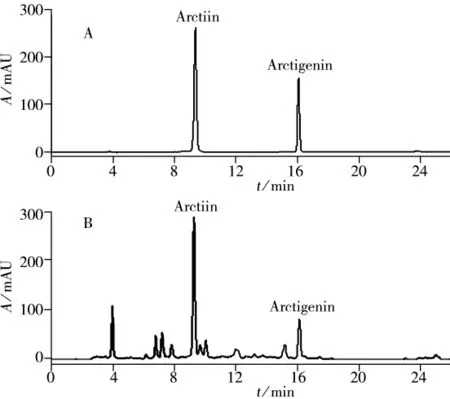
图6 对照品(A)及牛蒡子样品(B)的HPLC图谱Fig.6 HPLC chromatograms of arctiin and arctigenin standards(A)and Fructus Arctii sample(B)
2.5 精密度与回收率
在优化条件下测得牛蒡苷的线性范围为0.010 68~0.534 μg,其回归方程为:Y=507 699+9.118 32×109X,r2=0.999 9;牛蒡苷元的线性范围为0.007 44~0.372 μg,其回归方程为:Y=881 389+1.510 31 ×1010X,r2=0.999 9。
将牛蒡苷、牛蒡苷元浓度为10 mg/L的混合标准样品按照优化的色谱条件连续进样3次,其峰面积的相对标准偏差(RSD)分别为1.8%和2.0%,表明方法的精密度良好。
同一份牛蒡子粉碎样品,取等量3份,分别加入10 mg/L的牛蒡苷、牛蒡苷元混合标准样品1 mL,按照本方法测定含量,计算回收率(n=3)。结果表明,牛蒡苷、牛蒡苷元的平均回收率分别为93%和90%,RSD分别为2.2%和3.9%。
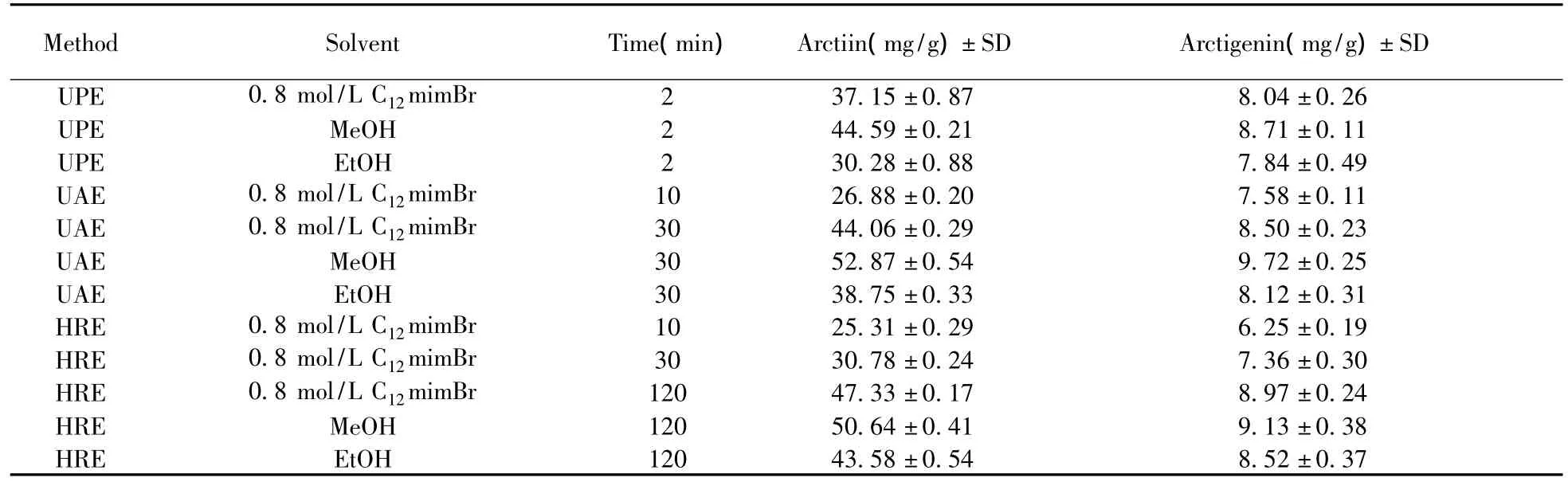
表1 不同提取方法对牛蒡苷和牛蒡苷元提取率的比较Table 1 Comparison of ILUPE with other extraction methods
3 结论
本文利用超高压辅助离子液体从牛蒡子中有效提取了牛蒡苷和牛蒡苷元。与传统方法相比,超高压方法的提取时间短,操作简单,能耗低。同时,超高压处理后的提取液成分较简单,不浑浊,粘度低,易过滤,有利于后续操作。此外,超高压方法所采用的常温提取能使牛蒡苷和牛蒡苷元避免因热效应而造成的损失和药理活性降低,且该技术在密闭的常温环境下进行,无溶剂挥发,绿色环保。因此,超高压辅助离子液体提取技术是一种提取牛蒡子中牛蒡苷和牛蒡苷元的较好方法。
[1]Xu L,Dou D Q,Kang T G.Res.Pract.Chin.Med.(许亮,窦德强,康廷国.现代中药研究与实践),2010,24(1):24-26.
[2]Cho M K,Jang Y P,Kim Y C,Kim S G.Int.Immunopharmacol.,2004,4(10/11):1419 -1429.
[3]Kim S H,Jang Y P,Sung S H,Kim C J,Kim J W,Kim Y C.Biol.Pharm.Bull.,2003,26(8):1202-1205.
[4]Wang L,Zhao F,Liu K.Chin.Tradit.Herbal Drugs(王潞,赵烽,刘珂.中草药),2008,39(3):467-470.
[5]Mu H O,Jin Y Q,Wang Y J.Zhejiang J.Integrated Tradit.Chin.Western Med.(木海鸥,金玉琴,王怡娟.浙江中西医结合杂志),2010,20(11):710-712.
[6]Zhao F,Wang L,Liu K.J.Ethnopharmacol.,2009,122:457 -462.
[7]Fu L C,Xu P P,Liu N,Yang Z F,Zhang F X,Hu Y J.Tradit.Chin.Drug Res.Clin.Pharmacol.(符林春,徐培平,刘妮,杨子峰,张奉学,胡英杰.中药新药与临床药理),2008,19(4):266-269.
[8]Zheng G C.Lishizhen Med.Materia Med.Res.(郑国灿.时珍国医国药),2008,9(10):2384-2385.
[9]Wu J G,Wu J Z,Sun L N.Phytomedicine,2009,(16):1033 -1041.
[10]Wang J,Shi J,Kang T G,Yang S S.J.Chin.Med.Mater.(王劲,史辑,康廷国,杨松松.中药材),2004,27(2):127-129.
[11]Jiang H,Li H N,Wang X,Chen R.Lishizhen Med.Materia Med.Res.(江海,李会宁,王晓,陈锐.时珍国医国药),2007,18(11):2701-2702.
[12]Cui Z W.Packaging and Food Machinery(崔政伟.包装与食品机械),2003,21(4):1-4,27.
[13]Zhang G,Zhang L L,Wu H,Zhang S Q.J.Tea Sci.(张格,张玲玲,吴华,张守勤.茶叶科学),2006,26(4):291-294.
[14]Zeng L,Luo L Y,Guan X L.Food Sci.(曾亮,罗理勇,官兴丽.食品科学),2011,32(6):85-88.
[15]Qin X,Jin X Y,Liu H J.Hubei Agric.Sci.(秦霞,靳学远,刘红菊.湖北农业科学),2010,49(9):2215-2217.
[16]Xi J,Zhao S,Lu B B,Zhang R,Li Y,Shen D J,Zhou G F.Int.J.Pharm.,2010,386(1):229 -231.
[17]Li B,Jia S R,Zhong C,Liu J.Mod.Food Sci.Technol.(李宾,贾士儒,钟成,刘杰.现代食品科技),2010,26(10):1117-1120.
[18]Zong W,Li X.Food Res.Dev.(纵伟,李晓.食品研究与开发),2009,30(2):65-68.
[19]Ma T J,Qin X J,Jia C X.Chin.Agric.Sci.Bull.(马挺军,秦晓健,贾昌喜.中国农学通报),2010,26(19):46-51.
