光谱法研究根皮苷与人血清白蛋白相互作用
2013-11-28王迎进张艳青李亚雄李艳芳张海容
王迎进,张艳青,李亚雄,李艳芳,张海容
(生化分析技术研究所 忻州师范学院,山西 忻州 034000)
根皮苷(Phlorizin)是一种具有明显生物活性的天然化合物,其化学成分是1-(2-(β-D-吡喃葡萄糖氧基)-4,6-二羟基苯基)-3-(4-羟基苯基)-丙酮,主要从苹果、苹果树皮及叶中提取而得。现代药理学研究表明根皮苷具有抗氧化、抗肿瘤及防治糖尿病、美白等生理功效[1-3]。人血清白蛋白(HSA)是人血浆中最丰富的功能蛋白,也是人体内重要的小分子药物结合蛋白,具有运输转运脂肪酸、氨基酸以及多种药物功能[4]。深入研究HSA与药物小分子的结合作用,不仅可以从分子水平上阐述药物小分子的药效作用机理,而且对药物的体外筛选、合理开发利用以及设计更加有效的药物分子具有重要的理论指导意义。因此,HSA与药物小分子的相互作用研究已成为生命科学、医学和环境科学等领域的重要研究课题。目前有关根皮苷与HSA的相互作用研究尚未见文献报道。本实验采用荧光光谱和紫外光谱法研究了根皮苷与HSA的相互作用机理,得到了根皮苷与HSA相互作用的猝灭常数、结合常数、结合位点数及结合距离,根据热力学参数确定了其相互作用力类型,采用同步荧光光谱法研究了根皮苷对HSA构象的影响,并考察了5种金属离子对根皮苷与HSA结合作用的影响,为阐明根皮苷在体内的输送和代谢过程、了解其生物学作用机理提供了实验依据。
1 实验部分
1.1 仪器与试剂
RF-5301型荧光分光光度计、UV-2550紫外可见分光光度计(日本岛津公司);501A型超级数显恒温水浴(上海浦东荣丰科学仪器有限公司)。
人血清白蛋白(99%,Sigma公司):称取HSA配制成1.5×10-5mol·L-1标准液,置于冰箱中4℃保存。根皮苷(95%,北京索莱宝科技有限公司):准确称取根皮苷配制成5.0×10-5mol·L-1标准溶液;Tris-HCl缓冲溶液(pH 7.4);实验用水为二次蒸馏水,其它试剂均为分析纯。
1.2 实验方法
准确移取一定体积的根皮苷标准溶液于10 mL比色管中,加入3.5 mL HSA标准溶液,以Tris-HCl缓冲溶液定容至5 mL,恒温水浴30 min。以285 nm为激发波长,激发和发射狭缝均为5 nm,恒温扫描一定波长范围内HSA的荧光光谱、HSA在根皮苷作用下的荧光猝灭光谱、同步荧光光谱(Δλ=15、60 nm)及紫外吸收光谱。

图1 根皮苷对HSA的荧光猝灭光谱Fig.1 Fluorescence quenching spectra of phlorizin-HSA system 303 K;cHSA=1.05×10-6mol·L-1;cphlorizin(1-10):0.0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0(×10-6mol·L-1)
2 结果与讨论
2.1 根皮苷对HSA的荧光猝灭光谱
蛋白质因含有色氨酸、酪氨酸及苯丙氨酸残基而能发射较强的内源荧光。在选定条件下,考察了不同浓度根皮苷溶液对BSA荧光强度的影响,结果如图1所示。HSA在330 nm处有较强的荧光,随着根皮苷浓度的增加,HSA在330 nm附近的荧光强度被有规律地猝灭,说明根皮苷与HSA发生了相互作用,导致HSA发生荧光猝灭。
2.2 荧光猝灭机理及猝灭常数的测定
引起HSA荧光猝灭的原因可能有动态猝灭和静态猝灭两种。动态猝灭是猝灭剂和荧光分子之间因彼此扩散和碰撞导致荧光物质荧光减弱的现象,其猝灭过程遵循Stern-Volmer方程[5]。
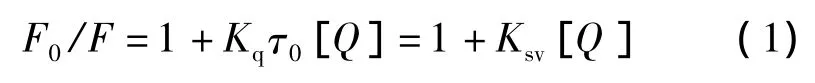
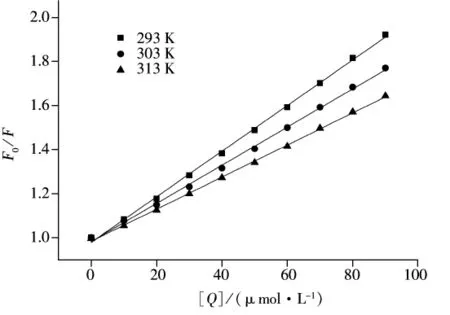
图2 不同温度下根皮苷-HSA体系的Stern-Volmer曲线Fig.2 Stern-Volmer curves of phlorizin-HSA system at temperatures of 293,303,313 K
式中:F0和F分别为未加入和加入根皮苷时HSA的荧光强度;Kq为双分子猝灭过程的猝灭速率常数(L·mol-1·s-1);τ0为无猝灭剂时荧光分子的平均寿命;Ksv为Stern-Volmer猝灭常数(L·mol-1)。生物大分子的荧光寿命约为 10-8s[6],故可根据猝灭常数Ksv求得猝灭速率常数Kq。
静态猝灭是由于猝灭剂与荧光物质相互作用而生成了一定构型化合物,导致荧光物质荧光强度减弱的现象。静态猝灭过程符合Lineweaver-Bruk双倒数方程[7]:
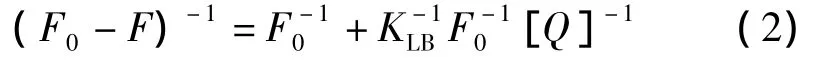
式中:KLB为猝灭剂与荧光物质的结合常数,也称作Lineweaver-Bruk猝灭常数。随温度的升高动态猝灭常数增大,而静态猝灭常数随之减小,由此可判断荧光猝灭类型。
按实验方法分别测定293、303、313 K时体系的荧光猝灭光谱,据式(1)作HSA荧光猝灭的Stern-Volmer曲线(图2),据式(2)作双倒数曲线,得到线性回归方程及相关系数r,可计算得到猝灭常数Ksv及结合常数KLB(表1)。

表1 根皮苷-HSA体系的猝灭反应常数Table 1 Quenching constants of phlorizin-HSA system
由图2和表1可知,随着温度升高,根皮苷与HSA作用的猝灭曲线斜率降低;根皮苷对HSA荧光猝灭过程的Kq值远大于各类猝灭剂对生物大分子的最大 Kq值(2 ×1010L·mol-1·s-1);结合常数 KLB随温度的升高而减小;均证明根皮苷对HSA的荧光猝灭不是动态猝灭,而是因根皮苷与HSA之间形成了配合物而引起的静态猝灭[8]。
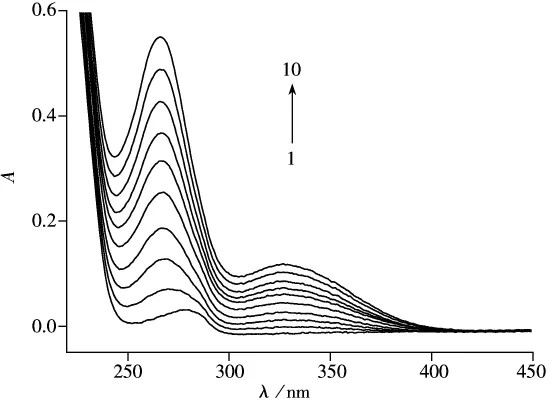
图3 根皮苷对HSA的紫外吸收光谱Fig.3 Absorption spectra of phlorizin-HSA system cHSA=1.05×10-6mol·L-1;cphlorizin(1-10)=0.0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0(×10-6 mol·L-1),293 K
2.3 根皮苷与HSA的紫外吸收光谱
紫外吸收光谱是检测是否生成复合物的一种简单有效方法,根皮苷与HSA相互作用的紫外吸收光谱如图3所示,由图3可知,HSA在278 nm处有一强吸收峰,当加入根皮苷后,吸收强度随根皮苷浓度的增加逐渐增强,且HSA的最大吸收峰发生明显紫移(从278 nm减小到266 nm)。进一步证明了根皮苷与HSA形成了基态复合物[9]。
2.4 根皮苷与HSA的结合常数与结合位点数
对于静态猝灭,荧光强度与猝灭剂的关系可由结合常数表达式[10]推导求出。
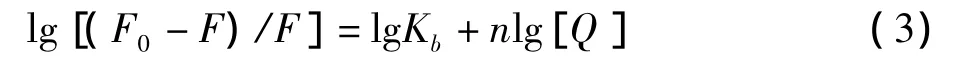
将lg[(F0-F)/F]对 lg[Q]作图,根据截距和斜率可求得相应Kb和n。结果如图4及表2所示。由表2可知,根皮苷与HSA的结合位点数n接近1,说明根皮苷与HSA可形成1个结合位点。结合常数Kb值较大(在105数量级),且随着温度的升高而降低,表明根皮苷与HSA之间有较强的结合作用,可以被蛋白质运输和储存。
2.5 根皮苷与HSA结合反应的热力学性质及作用力
分子间的作用力包括氢键、范德华力、静电引力和疏水作用。当温度变化不大时,反应的焓变ΔH、熵变ΔS可认为是常数,由热力学公式可计算根皮苷与HSA相互作用的热力学函数值。由表3可知,根皮苷与HSA的相互作用过程是一个放热熵减少过程。根据Ross等[11]总结的生物大分子与小分子作用力类型的热力学规律,结合过程ΔrHm<0,ΔrSm<0,可以推测根皮苷与HSA形成复合物归因于氢键和范德华的形成。这与根皮苷结构中存在多个羟基,易形成氢键的事实相符。而ΔrGm<0,表明根皮苷与HSA的相互作用是自发过程。
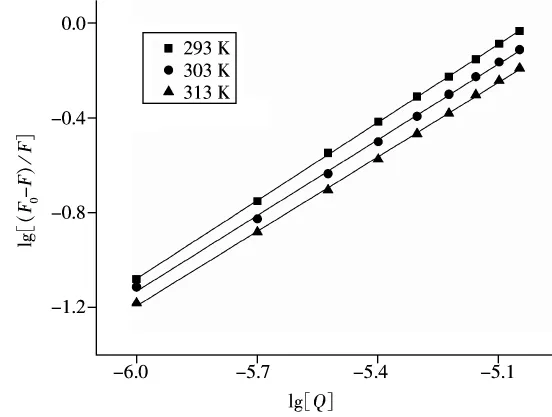
图4 根皮苷对HSA荧光猝灭的Lineweaver-Bruk图Fig.4 Lineweaver-Bruk curves of HSA quenched by phlorizin

表2 根皮苷-HSA体系的结合常数及结合位点数Table 2 The binding constants and binding sites of phlorizin-HSA system
2.6 根皮苷-HSA体系的同步荧光光谱
Δλ为15、60 nm的同步荧光光谱分别显示酪氨酸残基和色氨酸残基的光谱特征[12]。固定HSA浓度逐渐增加根皮苷浓度时,记录Δλ=15 nm和Δλ=60 nm的同步荧光光谱(图5)。由图可知,酪氨酸残基的最大发射波长基本不变,而色氨酸残基的最大发射波长发生明显红移,发射波长由339 nm红移至343 nm。表明根皮苷的介入引起HSA构象的变化,使色氨酸周围微环境的亲水性增强,HSA结构变得舒展,更易被水分子接近[13]。另外,色氨酸残基的荧光强度降低比酪氨酸残基显著,说明根皮苷与HSA的结合位点更接近于色氨酸残基。

表3 根皮苷与HSA结合过程的热力学参数Table 3 Thermodynamic parameters of phlorizin-HSA binding procedure
2.7 根皮苷与HSA作用距离计算
根据F rster偶极-偶极非辐射能量转移理论[14],可以求出小分子与蛋白质分子中发射荧光基团之间的距离,距离越小,药物分子越易于被蛋白质储存与运输,越能发挥其药理作用,能量转移效率E与给体-受体间距离r的关系为:

能量转移效率(E)为50%时,临界距离R0(福斯特距离)为:
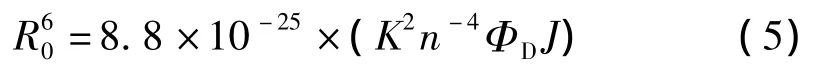
式中,K为供体和受体各项随机分布的取向因子,n为介质的折射指数,ΦD为给体的荧光量子产率,J为供体的发射光谱与受体吸收光谱的重叠积分。


只要得到E、K2和n并通过测定光谱求出积分J,就可计算出R0和r。
HSA的荧光光谱和根皮苷的吸收光谱如图6所示,将光谱重叠部分分割成极小的矩形,通过式(6)求得重叠积分 J(v)=7.54 ×10-15。
上述实验条件下,取向因子供体受体各项随机分布的平均值K2=2/3,n折射指数取水和有机物平均值n=1.336,ΦD=0.118,将上述数值代入式(5)求得R0=2.34 nm。再用根皮苷与HSA等摩尔混合后的荧光强度,通过式(6)计算得到能量转移效率E=0.04。经式(4)求得根皮苷与色氨酸残基的最短距离r=3.97 nm,说明根皮苷与HSA足够靠近(r<7 nm),其结合是通过非辐射能量转移促使蛋白质的荧光猝灭。

图5 根皮苷-HSA体系的同步荧光光谱Fig.5 Synchronous fluorescence spectra of phlorizin-HSA system

图6 HSA的荧光光谱与根皮苷的吸收光谱Fig.6 Fluorescence spectra of HSA and the absorption spectra of phlorizin
2.8 金属离子干扰
生物体内含有多种微量金属元素,这些元素共同参与各种生命活动。研究微量元素与生物体的作用机理,可以深入了解微量元素在生物体内的生理功能。因此,研究了 Mg2+、Zn2+、Ca2+、Fe3+、Al3+5种金属离子对根皮苷-HSA结合体系的影响,结果见表 4。由表 4可知,Zn2+、Ca2+、Fe3+、Al3+的介入对根皮苷与 HSA的结合常数影响较小。而Mg2+的介入使根皮苷与HSA的结合常数增加了1个数量级,原因可能是Mg2+在根皮苷与HSA分子之间起到“离子架桥作用”,形成了根皮苷-Mg2+-HSA 复合物[15]。
3 结论
根皮苷对HSA的荧光存在猝灭作用,其荧光猝灭过程是由于形成复合物而引起的静态猝灭,且发生了分子内的非辐射能量转移。根据热力学参数与作用力关系确定二者之间主要以氢键及范德华力相互作用;同步荧光光谱表明根皮苷主要与HSA的色氨酸残基相互作用,并能改变其局部构象;而金属离子的存在会影响根皮苷与HSA间的结合能力。

表4 金属离子对根皮苷-HSA体系结合常数的影响(293 K)Table 4 Effects of metal ions on binding constant of phlorizin-HSA system(293 K)
[1]Lotito S B,Frei B.Free Radical Biol.Med.,2004,36(2):201 -211.
[2]Dong H Q,Ning Z X.Food Sci.Technol.(董华强,宁正祥.食品科技),2006,31(12):192-195.
[3]Xie Y,Lai W,Wan M J,Xie X Y,Chen L.Chin.J.Aesthetic Med.(谢阳,赖维,万苗坚,谢小元,陈力.中国美容医学),2008,17(7):1032-1034.
[4]Liu J Q,Tian N,Tian X,Hu Z D,Chen X G.Bioorg.Med.Chem.,2004,12:469-474.
[5]Yang P,Gao F.Principles of Bioinorgainic Chemisty.Beijing:Science Press(杨频,高飞.生物无机化学原理.北京:科学出版社),2002.
[6]Lakowica J R,Weber G.Biochemistry,1973,12(21):4161 -4170.
[7]Jiang A G.Phys.Test.Chem.Anal.:Chem.Anal.(姜吉刚.理化检验-化学分册),2010,46(11):1286-1288.
[8]Li Y Q,Jia B X,Yao X Q,Ji H W,Guo F G,Qi Y X.J.Instrum.Anal.(李玉琴,贾宝秀,姚晓军,冀海伟,郭丰广,齐永秀.分析测试学报),2009,28(12):1396-1400.
[9]Ge F,Chen C Y,Liu D Q,Han B Y,Xiong X F,Zhao S L.J.Lumin.,2010,130(1):168 -173.
[10]Wang S,Wang H,Wang R W.J.Anal.Sci.(王帅,王海,王日为.分析科学学报),2011,27(5):627-630.
[11]Ross P D,Subramanian S.Biochemistry,1981,20(11):3096-3102.
[12]Liu C H,Li Y Q,Jia B X,Qi Y X,Li K.J.Instrum.Anal.(刘彩红,李玉琴,贾宝秀,齐永秀,李珂.分析测试学报),2011,30(5):532-536.
[13]Abert W C,Gregory W M,Allan G S.Anal.Biochem.,1993,213:407.
[14]F rster T,Sinanoglu O.Modern Quantum Chemistry.NewYork:Acacemic Press,1966.
[15]Wang N,Liu Z Y,Hu X L,Bo F Q,Zhao X Z.Chem.J.Chin.Univ.(王宁,刘忠英,胡秀丽,卜凤泉,赵学忠.高等学校化学学报),2011,32(2):241.
