激光打孔技术在小鼠卵子冷冻保存上的运用
2013-11-27刘丽均郁丽丽王俊凤张艺宝施美莲
刘丽均,郁丽丽,王俊凤,张艺宝,李 淼,施美莲,廖 侃,徐 平
(1.上海斯莱克实验动物有限责任公司,上海 201615;2.南京农业大学动物医学院,南京 210006;3.中科院上海实验动物中心,上海 201615)
配子和胚胎的冷冻保存技术可以使胚胎生物技术的运用不受时间和空间的限制,对基础研究、商业运用以及建立大型的胚胎库有着重要的意义。在各种冷冻保存技术中,卵子的冷冻保存有着自己的特色和难点,虽然卵子冷冻保存可以充分利用卵巢中的卵子,为各项生物技术的开展随时提供材料;为高龄、卵巢早衰或有恶性肿瘤的患者提供生育机会;保存优良品种和濒危动物资源,但是卵细胞体积巨大,细胞质丰富,细胞器多而复杂,对于温度、渗透压和离子浓度非常敏感[1],虽然前人做了一些冷冻保存的研究,但是复苏后有细胞存活率、受精率均较低,发育效果不佳[2]等问题。有研究表明卵细胞冷冻复苏后透明带变硬[3]、质膜变脆[4],导致了受精率的低下。本研究从透明带糖蛋白的角度,来研究冷冻对透明带糖蛋白的影响,并运用激光打孔技术来解决因为冷冻而照成的受精率下降的问题,为胚胎生物技术和辅助生殖技术提供解决的新方法。
1 材料和方法
1.1 实验动物
C57BL/6J,雌鼠,4周,SPF级,来源于上海斯莱克实验动物有限责任公司(生产许可证:SCXK(沪)2007-0005;使用许可证:SYXK(沪)2007-0005);
C57BL/6J,BKS.Cg - Leprdb/+Leprdb/Jc(以下简 称 Db+/- ),C57BL/6 BKS,MXβ-Catenin,MKP-5,Sir-168,C57BL/6-Tg(hislit2)(以下简称Hislit-2),B6.129S7-Ifngtm1TS(以 下 简 称 Ifng),C57BL/6 TRL 4KO(以下简称4KO)雄鼠,10周,均来源于上海斯莱克实验动物有限责任公司(生产许可证:SCXK(沪)2007-0005;使用许可证:SYXK(沪)2007-0005)。
所有动物都在SPF的环境中,自由采食,自由饮水,光照控制为 10 h∶14 h(AM.8:00-PM.6:00光周期)。
1.2 实验方法
1.2.1 试剂:HTF(human tube fluid),精子获能液及受精液,自己配置,配置方法参考 Quinn.P(1985)[5];所用试剂均为 SIGMA 公司;
R18S3,精子冷冻保护剂,配置方法参考Nakagata(1992)[6],所用试剂均为 SIGMA 公司;
EFS20,卵子冷冻保护剂,含20%乙二醇的 FS(Ficoll PM-Sucrose,简称 FS液)液;EFS40:含 40%乙二醇的 FS液;FS:含30%Ficoll PM 70的 PB1溶液。
兔抗人透明带糖蛋白-2抗体(一抗):SIGMA,货号HPA01126;
羊抗鼠抗体(二抗):Alexa FluarR488 Donkey Anti-Mouse TgG,molecular probes A21202;
鬼笔环肽phalloidin:SIGMA,货号P1951;Hoechst:SIGMA,货号 B1155。
激光打孔仪器由美国HAMILTON THORNE公司出品,型号为 XYClone Class I Laser Product,参数为 pulse=260,power=100%;
1.2.2 方法:
1.2.2.1 精子处理过程:①精子获能:各个品系的成年雄鼠,颈椎脱臼处死,剥离附睾尾部,擦拭血液和组织液,在尾部剪口,挑出精子团,放入预先平衡的HTF溶液中,37℃获能1.5 h;
②精子冷冻:成年雄鼠,颈椎脱臼处死,剥离附睾尾部,擦拭血液和组织液,在尾部剪口,挑出精子团,放在R18S3中,待精子散开后,10 μL每管转入麦管中,液氮上面预冷10 min后,投入液氮;
③精子复苏:麦管从液氮中取出,37℃水浴锅中10 min后,将精子悬浮液转入 HTF溶液中,37℃获能1.5 h;
1.2.2.2 卵子处理过程 ①卵子获得:C57BL/6J,雌鼠,腹腔注射孕马血清(pregnant mare serum gonadotropin,PMSG)48 h后,腹腔注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG),在hCG处理14~16 h后,颈椎脱臼处死雌鼠,分离膨大部,挑出卵子-卵丘细胞复合物(cumulus-oocyte complex,COC),用透明质酸酶消化成裸卵,反复清洗,去除透明质酸酶的影响,放入预先平衡的 HTF溶液中;
②卵子冷冻及复苏:(1)冷冻:上述裸卵,EFS20 0℃预冷2 min后,放入0℃的EFS40中,1 min后,立即投入液氮。(2)复苏:卵子冷冻一周后,从液氮中取出,加入0.75 mol/L的蔗糖溶液,静止片刻转入0.25 mol/L的蔗糖溶液中,清洗3次后,HTF培养待用;
③卵子打孔:选择形态正常的新鲜裸卵,或者复苏后形态正常的裸卵,在 power=260,power=100%条件下打孔,打孔后的卵子于HTF溶液中培养待用。
1.2.2.3 体外受精 上述复苏裸卵,以及复苏后打孔的卵子,加入新鲜获能精子或复苏后获能精子悬浮液,培养箱培养过夜。第2天计数二细胞胚胎的数量。
1.2.2.4 免疫荧光染色:①卵子分组:a)新鲜卵子,透明质酸酶消化后,HTF培养待用;2)经过酶消化的卵子,冷冻30 min后复苏,HTF培养待用;3)经过酶消化的卵子,冷冻1周后复苏,HTF培养待用;4)经过酶消化的卵子,进行正常的冷冻,但是不投入液氮,然后正常复苏,HTF培养待用;
②上述各组裸卵,PBS清洗3次;4%PFA-PBS常温固定;
③TTBS-1%BSA封闭过夜;
④加入兔抗人透明带糖蛋白一抗(HPA01126,SIGMA),常温 1 h;
⑤TTBS清洗数次后,加入羊抗鼠的二抗、phalloidin、Hoechst,避光染色 1 h;
⑥封片过夜后,激光共聚焦显微镜观察。
1.3 结果统计
1.3.1 受精率的计算:受精率=二细胞的数量/液滴中总的细胞数量(二细胞+未受精的单细胞+异常的细胞);
1.3.2 将受精率采用arc-sin对数转换后,做统计分析,采用 SPSS分析软件,单因素方差分析,P<0.05为差异显著。
2 结果
2.1 C57BL/6J小鼠卵子冷冻前后细胞核、微丝及透明带糖蛋白-2的变化研究
C57BL/6J小鼠卵子,用兔抗人透明带糖蛋白2抗体标记透明带糖蛋白,然后用羊抗兔的二抗显示,结果如彩插4图1图所示;所有卵子的微丝,用鬼笔环肽标记,结果如彩插4图2所示;细胞核用Hochest标记,结果如彩插4图3所示。从4组图中可以看出,新鲜卵子的透明带糖蛋白-2完好无损,微丝结构完整,细胞核明亮。冷冻一周后复苏的卵子,以及冷冻30 min后复苏的卵子,透明带荧光变暗淡,外围出现断裂不完整处,微丝颜色略变暗,边缘有不完整,细胞核一切正常,没有明显变化。经过冷冻保护剂处理而没有冷冻的卵子,除了细胞核正常外,透明带荧光变得暗淡,结构明显不完整,多处出现断裂,微丝结构断裂,不完整,呈现出细胞皱缩状态。
2.2 C57BL/6J小鼠复苏卵子和复苏后打孔卵子体外受精的研究
C57BL/6J小鼠雌鼠,4周,超排后取卵,如上述处理后与9个品系的雄鼠进行了体外受精实验,从下表中可以看出,C57BL/6J小鼠的卵子,冷冻后,受精能力下降,与新鲜精子受精,受精率平均在15~30%之间,经过打孔后,平均受精率在40% ~70%之间。复苏后的卵子与复苏后的精子受精,受精率变化较大,从5~25%都有,与不同的雄鼠品系有关,复苏卵子打孔后,与复苏精子受精,可以使受精率提高至20% ~40%,同品系不同组之间比较,差异显著(P<0.05)。
3 讨论
Hochest是一种小分子荧光染料,可以特异性的和DNA结合,四种分组中,均可以看出细胞核的明显的位置,荧光强弱无明显差异,说明冷冻与否并不会损伤卵子的DNA,这也是为什么可以通过冷冻保存配子、胚胎来保存动物资源的理论依据。细胞骨架是指真核细胞中的蛋白纤维网络结构,由微丝、微管和中间纤维构成。其中微丝确定细胞表面特征,使细胞能够运动和收缩。鬼笔环肽(phalloidin)与微丝能够特异性的结合,荧光标记的鬼笔环肽可特异性的显示微丝结构在细胞中的分布[7]。4种分组的图片显示,被鬼笔环肽标记的微丝结构,无论在新鲜卵子,还是冷冻复苏的卵子,抑或EFS处理的卵子,微丝有变化但是差异不大,在卵子细胞膜下表现出完整的结构,这说明冷冻复苏过程并没有严重损伤微丝的结构。也可能是因为微丝虽然在低温下易解聚,但是复苏的卵子经过一段时间的培养,解聚的微丝可以重新组装起来,维持卵子正常的形态[8]。经过 EFS处理组的微丝,可以看出细胞明显皱缩,可能是高浓度的冷冻保护剂照成细胞内外渗透压的改变,使得微丝也发生结构变化,卵子呈现皱缩。
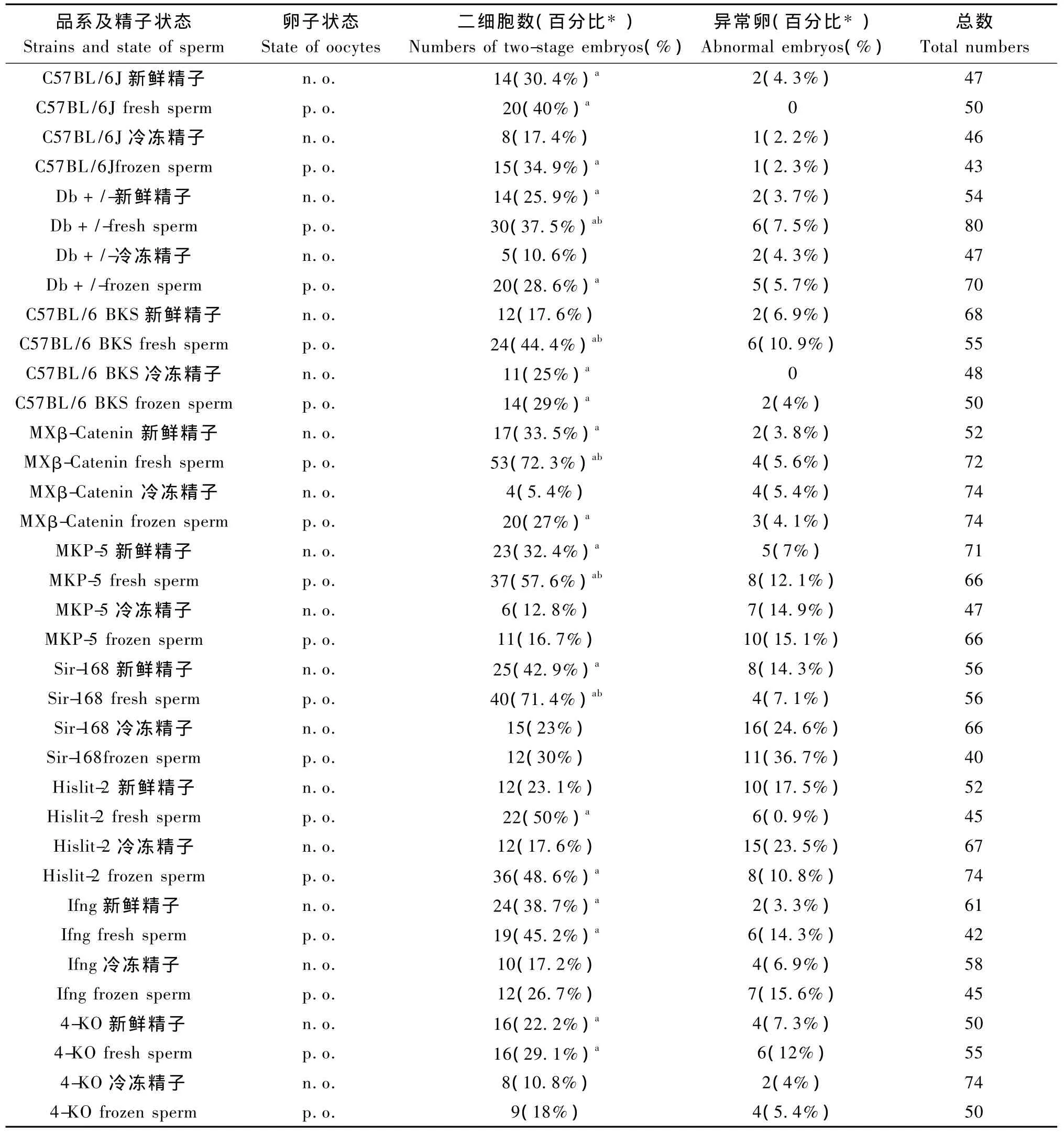
表1 C57BL/6J小鼠复苏卵子和打孔卵子体外受精率的比较Tab.1 Comparing the IVF rate of C57BL/6J post-thawed oocytes and laser-punched oocytes
冷冻对细胞照成的伤害,主要在于以下几个方面,一是高浓度的冷冻保护剂对细胞的毒害;二是冷冻过程对细胞的过度刺激,三是在冷冻过程中可能形成的细胞内致死性冰晶,四是复苏时由于细胞膜内外渗透压的改变可能照成的细胞膜破裂[9,10]。本实验表明,对于卵子来说,冷冻造成的受精率的低下还有一个重要的原因是卵子透明带变化。小鼠的透明带主要有3个糖蛋白构成,ZP1、ZP2、ZP3,其中ZP3是精子结合透明带的第一个结合部位,精子结合ZP3后,发生顶体反应,暴露顶体内膜,然后与ZP2继续结合,发生一系列复杂反应后,穿过透明带,与细胞膜结合,再穿过细胞膜发生受精。有前人报导经过冷冻的卵子,细胞内皮质颗粒的提前释放,照成透明带的硬化,影响了透明带与精子的结合,照成受精率下降[11-13]。我们运用兔抗人 ZP2抗体,来标记小鼠ZP2,研究是否冷冻会对透明带造成了一定的破损[14-16]。从结果可以看出,新鲜卵子组绿色荧光亮而且完整,显示透明带结构完整,而冷冻一周或冷冻30 min组的卵子,透明带荧光变弱,边缘有断续,说明冷冻后透明带受到一定程度的破坏,可能是透明带糖蛋白分子严重变形,扭曲,或者发生了糖键的断裂,从而使得糖蛋白上与精子结合的位点被破坏,影响了精子与卵子的结合,卵子冷冻后受精率低下,甚至有些几乎不能受精。
2004年,HAMILTON公司设计开发了激光打孔系统,这套系统应用简单的激光发生设备,对哺乳动物的卵子的透明带进行简单的打孔,在人类体细胞的核移植研究[17],疾病模型小鼠的制备[18,19],以及小鼠ES细胞注射以进行小鼠的遗传学研究[20]中得到了充分的运用。本实验室借鉴这些文章,对于冷冻后因透明带糖蛋白受损而不能受精的卵子,运用激光打孔技术,在透明带上打孔后,使得精子可以直接通过微孔与卵子结合,受精,从而提高冷冻复苏卵子的受精率。从文章的结果可以看出,9个品系的新鲜精子与C57BL/6J复苏卵子受精率为17.6%~42.9%;新鲜精子与复苏打孔卵子受精率为29.1% ~72.3%,差异显著(P<0.05);9个品系复苏精子与复苏卵子体外受精率为5.4%~23%;复苏精子与复苏打孔卵子受精率为16.7% ~48.6%,差异显著(P <0.05),与Anzai M的结果类似[21]。说明利用激光打孔技术可以较好的提高冷冻复苏卵子的受精率,提高了卵子的利用效率,也提高了冷冻技术在生殖工程中的运用。
[1] Tharasanit T,Colleoni S,Lazzari G,et al.Effect of cumulus morphology and marutation stage on the cryopreservability of equine oocytes[J].Reprod,2006,132:759 - 769.
[2] 孙青原,秦鹏春,徐立滨.哺乳动物卵母细胞的冷冻保存方法[J].生物技术,1993,3(1):5-9.
[3] Wininger J D,Kort H I.Cryopreservation of immature and mature human oocytes[J].Seminars Reprod Medi,2002,20:45-49.
[4] Didion B A,Pomp D,Martin M J,et al.Observations on the cooling and cryopreservation of pig oocytes at the germinal vesicle stage[J].J Anim Sci,1990,68:2803 - 2810.
[5] Quinn P,Kerin J.F.,Warners G.M.Improved pregnancy rate in human in vitro fertilization with the use of medium based on the composition of human tubal fluid[J].Fertil.Steril.,1985,44:493-498.
[6] Nakagata N,Taneshima T.High fertilizing ability of mouse spermatozoa diluted slowly after cryopreservation [J].Theriogenology,1992,37:1283-1291.
[7] Velilla E,Rodríguez-Gonzalez E,Vidal F,et al.Microtubule and microfilament organization in immature,in vitro matured and in vitro fertilized prepubertal goat oocytes[J].Zygote.2005,May,13(2):155-65.
[8] Hosu BG,Mullen SF,Critser JK,et al.Reversible disassembly ofthe actin cytoskeleton improves the survival rate and developmental competence of cryopreserved mouse oocytes[J].PLoS One.2008,30(7):2787-92.
[9] M.Kasai,K.Ito,K.Edashige.Morphological appearance of the cryopreserved mouse blastocyst as a tool to identify the type of cryoinjury[J].Hum.Reprod.2002,17:1863 -1874.
[10] Yang l,Fang Y.N.Wen J.D.et al.The type and extent of injuries in vitrified mouse oocytes[J].Cryobiology,2012,64:97-102.
[11] Ko CS,Ding DC,Chu TW,et al.Changes to the meiotic spindle and zona pellucida of mature mouse oocytes following different cryopreservation methods[J].Anim Reprod Sci.2008 May;105(3-4):272-282.
[12] Moreira daSilvaF, MeteloR. Relation between physical properties of the zona pellucida and viability of bovine embryos after slow-freezing and vitrification[J].Reprod Domest Anim.2005 Jun;40(3):205-209.
[13] Burkart AD,Xiong B,Baibakov B,et al.Ovastacin,a cortical granule protease,cleaves ZP2 in the zona pellucida to prevent polyspermy[J].J Cell Biol.2012,197(1):37 - 44.
[14] Zhao M,Gold L,Dorward H,et al.Mutation of a conserved hydrophobic patch prevents incorporation of ZP3 into the zona pellucida surrounding mouse eggs[J].Mol Cell Biol.2003 Dec;23(24):8982-8991.
[15] Hoodbhoy T,Avilés M,Baibakov B,et al.ZP2 and ZP3 traffic independently within oocytes prior to assembly into the extracellular zona pellucid[J].Mol Cell Biol.2006 Nov;26(21):7991-7998.
[16] Wassarman P.M.Egg zona pullucida glycoproteins adhesion proteins. T. Kieis and R Vale Eds. Oxford university press.1999.
[17] Hall V J, Compton D, Stojkovie P etal. Developmental competence of human in vitro aged oocytes as host cells for nuclear transfer[J].Human Reproduction,2007,22:52 - 62.
[18] Willian T Poueymirou,Wojtek Auerbach,David Frendewey et al.F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses[J].Nature Biotechnoligy,2006,24:1 -9.
[19] Noriko Tanaka,Takumi Takeuchi,Queenie V Neri,et al.Laserassisted blastocystdissection and subsequentcultivation of embryonic stem cells in aserum/cellfreeculturesystem:applications and preliminary results in a murine model[J].Journal of Translational Medicine,2006,4:20-33.
[20] Thomas G,Rick W.Laser surgery for mouse geneticists[J].Nature Biotechnology,2007,25:59 -60.
[21] Anzai M,Nishiwaki M,Yanagi M et al.Application of laserassisted zona drilling to in vitro fertilization of cryopreserved mouse oocytes with spermatozoa from a subfertile transgenic mouse[J].J Reprod Dev.2006 Oct;52(5):601 - 606.
