绿色荧光转基因大鼠模型的建立
2013-11-27王贵利关霏霏马元武张连峰
王贵利,白 琳,陈 炜,关霏霏,高 珊,马元武,张连峰
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
由于大鼠在生理、行为、代谢等方面具有比小鼠更优良的特点和最近基因工程大鼠研制技术的兴起,大鼠已成为生命科学和医药研究期待的动物模型。大鼠活体影像分析、组织细胞示踪、干细胞示踪等,都需要一个标记蛋白高表达和各种细胞标记率高的大鼠模型。常用的干细胞标记方法有LacZ基因、荧光染料 Hochest和5-溴-2脱氧尿嘧啶核苷(BrdU)等,这些免疫组化染色的缺陷是只能在组织切片上观察干细胞的存活、迁移和分化情况,需要牺牲大量的实验动物来观察不同时间点干细胞在体内的转归,无法实时、纵向监测干细胞在体内的动态迁移过程[1]。荧光发光是通过激发光激发荧光基团达到高能量状态,而后产生发射光。常用的有红色荧光蛋白(RFP)和绿色荧光蛋白(GFP)[2]。荧光成像被广泛用于细胞凋亡、蛋白质相互作用、免疫细胞迁移、癌症及药物研究等多个领域[3-6]。最近几年,这项技术开始被用于干细胞研究,可在活体内观察干细胞的行为和生物学特性及其转归,准确获得活体动物体内靶位置的干细胞,在各时间点的生长和分化情况,加速了干细胞在肿瘤、组织工程等领域的研究进展[7]。
为满足科学研究的需要,国内外研究者建立了多种荧光转基因大鼠[8]。但由于转基因载体构建所采用的启动子不同、靶基因染色体插入的位置效应以及转基因拷贝数的差异,不同荧光转基因大鼠的细胞标记率和标记细胞亚群不同,尤其是骨髓干细胞标记率低,从而影响了大鼠荧光标记干细胞在干细胞研究中的进一步应用。本文从建立的16个EGFP转基因大鼠品系中,筛选出一个血液细胞和骨髓干细胞高效标记绿色荧光的转基因大鼠。
1 材料和方法
1.1 EGFP表达载体的构建及转基因
用PCR法从 pEGFP-N1质粒中扩增 EGFP基因,DNA序列分析证实没有突变(北京三博远志生物技术有限公司,中国)。把EGFP基因克隆入系统性表 达 的 chicken β-actin 强 启 动 子 (Dr.Jun-ichi Miyazaki惠 赠,Institute for Medical Genetics,Kumamoto University Medical Schoo1)下游构建EGFP转基因载体[9]。转基因载体用 Sal I线性化(宝生物工程有限公司,中国),调整浓度至5 ng/μL,用显微注射法将线性化的转基因载体注射到SD大鼠的受精卵中(大鼠购自军事医学科学院实验动物中心,SCXK(军)2007-004;SYXK(军)2009-0003),用Wistar大鼠作假孕受体(大鼠购自军事医学科学院实验动物中心,SCXK(军)2007-004;SYXK(军)2009-0003),制备转基因大鼠(TE2000.U 显微注射仪)[10]。本实验方案已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为 ILAS-GC-2012-001。
1.2 PCR鉴定EGFP转基因大鼠
转基因大鼠在出生7~9 d用剪趾法标记,收集剪下的组织,用碱裂解法提取基因组 DNA[11],用PCR对转基因大鼠进行基因表型检测。EGFP转基因大鼠 PCR引物为 5'-CGCCACCATGGTGAGCAAG-3',5'-ATGCCGTTCTTCTGCTIC-3'(Invitrogen 公司,中国)。PCR试剂购自宝生物工程有限公司。
1.3 活体荧光影像系统分析EGFP转基因大鼠
10日龄 F1代 EGFP转基因大鼠,0.1 mL戊巴比妥钠(2%)麻醉后,放入活体荧光影像系统的暗箱中拍照,SlideBook 4.0软件进行分析(日本 Roger公司)。
1.4 EGFP转基因大鼠组织表达分析
按正常病理程序牺牲1月龄F1代EGFP转基因大鼠,将全身重要组织器官进行冰冻切片(kica冰冻切片机)。立即在激光共聚焦显微镜下观察和分析。
1.5 大鼠血液细胞和骨髓细胞的荧光分析
1.5.1 大鼠血液和骨髓细胞的获取
麻醉F1代大鼠后剪尾1 cm,取血液100 μL;用剪刀环形剪开大鼠踝关节处的皮肤,然后沿大鼠小腿的纵轴内侧和外侧的中线分别剪开皮肤。分离胫骨的肌肉组织,尽量取净。在胫骨的两端骨骺处切开,使用5 mL注射器以PBS缓冲液反复冲洗骨髓腔,收集细胞。吹打细胞成单细胞悬液,50 μm的尼龙滤膜过滤细胞悬液至15 mL离心管中,400 g离心5 min,去上清。
1.5.2 血液和骨髓中红细胞的去除及荧光分析
用无菌水将红细胞裂解液(BD Pharm LyseTM Lysing buffer)稀释10倍,向上述血液和骨髓细胞中加1 mL稀释后的红细胞裂解液,静置5 min后2400 r/min离心5 min。PBS洗一次。吹散过滤,用流式细胞仪(美国BD公司FACSAria)检测。
1.6 骨髓干细胞的荧光分析
取1×106个大鼠骨髓细胞,分别加入 0.5 μL APC标记的 CD45RA抗体,1 μL PE标记的 CD3抗体,0.3 μL PerCP-Cy5.5 标记的 Thy-1.1 抗体作为单阳管对照,3种抗体同时加入作为实验管。抗体4℃孵育1 h后,用 PBS清洗,过滤后用流式细胞仪检测。
2 结果
2.1 EGFP表达载体的构建和基因表型的鉴定
用PCR克隆EGFP基因,测序结果表明克隆的cDNA同已报道的序列完全一致。将EGFP基因插入系统性表达的chicken β-actin强启动子下游构建EGFP转基因载体(图1A)。
用显微注射法将线性化的转基因载体注射到SD大鼠的受精卵中,转入到假孕受体 Wistar大鼠中,大鼠出生后7~9 d提取基因组DNA,用PCR检测EGFP转基因首建鼠(图1B),得到16只首建鼠。
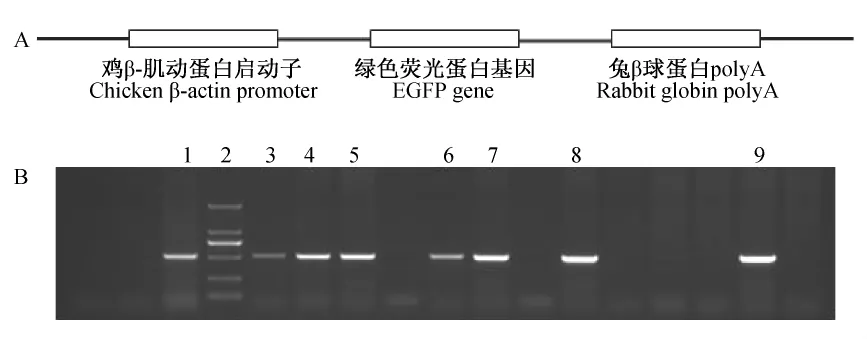
图1 EGFP转基因载体的构建和基因表型的鉴定。Fig.1 Construction of EGFP transgenic vector and genotyping of EGFP transgenic rats with PCR.
2.2 活体荧光影像系统分析绿色荧光蛋白转基因大鼠
用戊巴比妥钠麻醉10日龄F1代EGFP转基因大鼠后,放入活体荧光影像系统的暗箱中拍照,SlideBook 4.0软件进行分析。由封2图2可知,SDTgN(ACT-EGFP-1)ZLFILAS 转基因大鼠(Ⅱ)相对于野生型大鼠(Ⅰ),呈现较强绿色荧光,荧光蛋白在全身多个组织器官中表达,且强于其他转基因大鼠首建鼠(图略)。
2.3 EGFP转基因大鼠组织表达分析
将1月龄F1代EGFP转基因大鼠全身重要组织器官进行冰冻切片,立即在激光共聚焦显微镜下观察和分析。结果显示,对照野生型大鼠各组织器官均无荧光标记,EGFP绿色荧光蛋白在 SD-TgN(ACT-EGFP-1)ZLFILAS 转基因大鼠的心脏、肝脏、肌肉、肺、胰腺、脑、膀胱、胃、肾脏、肠和脾脏中表达,尤其在心脏、肝脏、肌肉、肺、胰腺中表达量较高,在脾脏中表达量较低(彩插1图3)。
2.4 血液细胞和骨髓细胞中的荧光标记细胞分析
从大鼠胫骨中分离骨髓细胞,从血液中获得血液细胞,除去红细胞后,以流式细胞仪分析血液细胞和骨髓细胞中荧光标记细胞的比率,从而筛选获得高效荧光标记的转基因大鼠。SD-TgN(ACTEGFP-1)ZLFILAS转基因品系的荧光标记细胞比率最高。如图4所示,血液细胞中荧光标记德细胞占94.4%,骨髓细胞中有90.7%的细胞为荧光标记。
2.5 骨髓干细胞的荧光分析
骨髓细胞通过 CD45RA、CD3、Thy-1.1 抗体染色后,根据其阳性和阴性可以初步分析出干细胞。单阳的对照管确定了不同抗体染色后的合适电压,实验管用 Thy-1.1+CD3-CD45RA-除去红细胞、淋巴细胞、骨髓中成熟的细胞,检测大鼠的骨髓干细胞,发现其中 GFP阳性细胞占了 97.8%(封 2图5)。
3 讨论

图4 SD-TgN(ACT-EGFP-1)ZLFILAS转基因大鼠血液和骨髓细胞中的荧光标记细胞分析。Fig.4 The ratios of fluorescent labeling cells in blood cells and bone marrow cells in SD-TgN(ACT-EGFP-1).ZLFILAS
传统的动物实验方法需要在不同的时间点牺牲实验动物以获得数据,得到多个时间点的实验结果。利用光学标记的转基因动物模型进行活体荧光成像,直接、实时追踪并检测标记细胞在体内的活动,标记基因在体内的表达;对同一组实验对象在不同时间点进行记录,跟踪同一观察目标的迁移及变化,可以研究疾病的发生发展过程,进行药物研究及筛选;操作简便、结果直观、测量快速、灵敏度高、费用低廉、所得的数据更加真实可信,已广泛应用于生命科学、医学研究及药物开发等方面[12]。此外,现行的骨髓移植技术通常检测供体造血干细胞在受体骨髓中的数目,是一种终点检测方法。应用转基因大鼠,将荧光标记的造血干细胞移植入脾及骨髓,可以通过荧光发光实时检测这些干细胞的后代在动物体内的生长和活动。
荧光蛋白在体内,尤其是干细胞中的表达必须在强启动子,如鸡 β肌动蛋白 chicken β-actin启动子或CAG启动子的驱动下才能高效进行,在某些启动子驱动下表达效果较差,且转基因载体插入位点和拷贝数对基因表达效率也具有显著影响[2]。大鼠的骨髓干细胞标记研究较少,我们利用红细胞裂解液除去红细胞、利用B淋巴细胞的标记CD45RA,T淋巴细胞的标记CD3除去淋巴细胞,初步去除了骨髓中成熟的细胞[13]。Goldschneider利用体内脾克隆形成的方法,发现 Thy-1.1阳性细胞能形成克隆,而阴性细胞不能形成克隆,可以利用 Thy-1.1阳性细胞标记大鼠的骨髓干细胞[14]。因此,我们利用流式分析骨髓中 Thy-1.1+CD3-CD45RA-细胞作为大鼠的骨髓干细胞。
本研究将 EGFP插入 chicken β-actin强启动子下游,构建了系统性表达绿色荧光的转基因大鼠,绿色荧光蛋白在全身多个组织器官和骨髓细胞中表达。其中,SD-TgN(ACT-EGFP-1)ZLFILAS 转基因大鼠94.4%的血液细胞为荧光标记,97.8%的骨髓干细胞标记绿色荧光。该品系绿色荧光转基因大鼠模型将为示踪基因表达、标记转基因动物、干细胞的分化与定位、研究肿瘤的生物学行为研究,提供有力的工具动物和分子影像学技术手段。
[1] Cao YA, WagersAJ. Beilhack A etal. Shiftingfociof hematopoiesis during reconstitution from single stem cells.Proc Natl Acad Sci U S A.2004;101(1):221-226.
[2] 冯娟,高苒,全雄志等.红色荧光和绿色荧光转基因大鼠模型的建立[J].中国实验动物学报,2007,15(4):267-270.
[3] Yang M,Baranov E,Moossa AR,et al.Visualizing gene expression by whole—body fluorescence imaging[J].Proc Natl Acad Sci USA,2000,97:12278-12282.
[4] Takada T,Iida K,Awaji T,et al.Selective production of transgenic mice using green fluorescent protein as a marker[J].Nat Biotechnol,1997,15:458 -461.
[5] Yang M,Reynoso J,Jiang P,et al.Transgenie nude mouse with ubiquitous green fluorescent protein expresion as a host for human tumors[J].Cancer Res,2004,64:8651 -8656.
[6] Sangmi C,Therese A,Kai—C S,et al.Analysis of different promoter systems for efficient transgene expression in mouse embryonic stem cell lines[J].Stem Cell,2002,20:139 - 145.
[7] 张晓娟,李小颖,施海霞等.造血干细胞全标记红色和绿色荧光转基因小鼠的筛选.中国比较医学杂志,2011,Vol.21,No.5,14 -17
[8] Moore AM,Borschel GH,Santosa KA,et al.A transgenic rat expressing green fluorescent protein(GFP)in peripheral nerves provides a new hindlimb model for the study of nerve injury and regeneration.J Neurosci Methods.2012 Feb 15;204(1):19-27.
[9] Niwa H.Yamamura K,Miyazaki J.Efficient selection for high—expression transfectants with a novel eukaryotie vector[J].Crene,1991.108:193-200.
[10] Gordan JW, RuddleFH. Integration and stablegerm line transmission of genes injected into mouse pronuelei[J].Science,1981.214(4526):1244-1246.
[11] Truett GE,Heeger P,Mynatt RL,et al.Preparation of PCR-quality mouse genomie DNA with hot sodium hydroxide and tris(Hot SHOT)[J].Biotechniques,2000,29(1):52 -54.
[12] Robert M.Advantages of multi-color fluorescent proteins for whole-body and in vivo cellular imaging[J]. J Biomedical Optics,2005,10:041021-0410210
[13] Marc H.Dahlke,Oliver S.Lauth,Mark D.Jäger,et al.In vivo depletion of hematopoietic stem cells in the rat by an anti-CD45(RT7)antibody.Blood,2002,99:3566-3572
[14] Golschneider I,Gordon LK,Morris RJ.Demonstration of Thy-1 antigen on pluripotent hematopoietic stem cells in rats.J Exp Med 1978;148:1351-1366.
