袖状胃切除术Wistar大鼠模型建立及初步观察
2013-11-27张建军汪文娟吴毅平
张建军,汪文娟,吴毅平
(1.华中科技大学同济医学院附属同济医院整形美容外科,武汉 430030;2.石河子大学医学院第一附属医院烧伤整形科,石河子 832008)
袖状胃切除术是近些年来较为推崇和行之有效的治疗病态性肥胖症的流行术式之一,其短期和中期的减重疗效获得了肯定[1],袖状胃切除术被认为是一种限制性手术,胃容量的减少会限制食物的摄入进而降低体质量,但其减重的机制仍未完全阐明[2],目前的研究多集中在胃肠激素的调节作用方面,对组织形态的研究关注不多[3]。根据大鼠的胃组织学结构的差异可分为皮胃和腺胃两部分,皮胃即前胃,为非腺体区,胃壁较薄,与腺胃之间有较明显的界限嵴分隔[4],它主要起暂时贮存食物的作用,我们建立了袖状胃切除术正常 Wistar大鼠模型,对其减重的效果及术后前胃的组织形态进行了初步观察。
1 材料和方法
1.1 动物及分组
SPF级雄性 Wistar大鼠20只,周龄6~8周,体重250~300 g,湖北省实验动物研究中心提供[SCXK(鄂)2008 -0005],所有大鼠均饲养在华中科技大学同济医学附属同济医院动物实验中心内(SYXK(鄂)2009-0049),室内相对温度(22 ±2)℃,相对湿度(60±10)%,保持12 h光照/12 h黑暗交替。适应性喂养一周后随机分为手术组12只和假手术组8只。手术组进行袖状胃切除术,切除约70%~80%的胃组织。假手术组在胃大弯前胃腺胃交界处作一个1 cm切口,然后缝合,其余步骤与手术组相同,麻醉手术时间尽量与手术组接近。
1.2 实验用品
电子天平(TSA-5000A武汉自动化仪器厂)、OLYMPUS IX71显微镜及显微图像软件 Image-Pro Plus6.0、持针器、眼科剪、眼科镊、线剪、无损伤血管钳,蚊式钳、5-0丝线、3-0丝线、消毒敷料及5 mL注射器若干、2%戊巴比妥钠(上海科瑞生物有限公司)、3%活力碘、庆大霉素注射液、0.9%氯化钠注射液。
1.3 手术及实验方法
2%戊巴比妥钠(40 mg/kg)腹腔麻醉后,大鼠仰卧四足及门齿固定,腹部消毒铺巾,取剑突下上腹部正中切口,长3 cm,幽门上0.5 cm用2把无损伤血管钳沿胃大弯侧相向钳夹,沿无损伤钳切除胃大弯侧胃壁,切除约70% ~80%胃组织(包括前胃和腺胃)。残端消毒后切口采用5-0丝线连续的内翻褥式缝合,然后间断缝合加强,避免出血和渗漏,观察无明显渗血后,还纳胃于左上部腹腔内,腹腔常规给予庆大霉素盐水2 mL,3-0丝线间断全层缝合腹膜、肌层和皮肤。假手术组切口相同,游离胃周围组织血管过程相同,游离提出胃组织后,在胃大弯侧,前胃和腺胃交界处纵行切开一长约1 cm切口,消毒后不切除胃组织原位缝合,其他操作过程同实验组,术前Wistar大鼠禁食(自由饮水)16~18 h,术后禁食1 d即可正常进食固体食物。
1.4 观测指标
观察假手术组、手术组的Wistar大鼠手术相关并发症和成活率,在术前、术后第1天、术后前4周每周和而后的8周内每两周的体质量变化;大鼠12周麻醉处死,取前胃组织4%多聚甲醛固定,石蜡包埋,切片(4 μm)进行常规 HE染色,光镜下观察术后大鼠前胃的形态变化,并利用 OLYMPUS IX71显微镜及显微图像软件Image-Pro Plus6.0采集处理图片,两组中各随机选取6只大鼠,每只大鼠选取2张前胃切片,选择测量部位要求前胃黏膜和黏膜肌层形态完整,界限清晰,无明显扭曲变形,每张切片随机选3个前胃黏膜上皮及黏膜肌层用微分尺进行测量。
1.5 统计学处理
2 结果
2.1 手术成活率及并发症
手术组死亡2只,1只考虑胃瘘致感染败血症死亡,1只考虑胃切口出血导致死亡,其余大鼠均成活,手术组大鼠成活率83%。饲养中大鼠呼吸道感染1例,手术组观察到术后腹泻2例,隔离饲养后自行恢复。
2.2 体重变化
12只手术组大鼠与8只假手术组大鼠术前体重无统计学差异(P>0.05);两组大鼠术后第一周体重均有减轻,假手术组大鼠在术后第2周体重增长明显(P<0.05),手术组大鼠体重在术后2周恢复到术前水平,此后,手术组体重增长在各个时间点上均明显较对照组慢(P <0.05)(图1)。
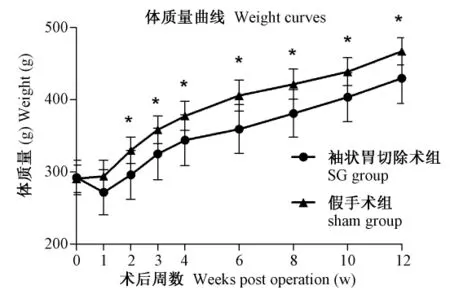
图1 两组大鼠术后体质量曲线的变化。Fig.1 Varies of weight curves in SG and sham group.
2.3 前胃组织形态学变化
Wistar大鼠袖状胃切除术后12周,与假手术组相比,大体观察可见胃组织大弯侧明显瘢痕粘连形成,胃前壁皱缩的沟回样外观消失,表面光整,手术组胃的长径较假手术组变化不大,但横径有明显缩窄,胃组织膨大主要表现在前胃的残留部分;光镜下观察可见前胃粘膜皱襞较浅平,镜下黏膜及黏膜肌层明显变薄,上皮角缩短,基底较为平整(彩插2图2)。经显微测量后结果提示:袖状胃切除术组术后12周大鼠前胃黏膜及黏膜肌层较假手术组薄(P< 0.01)(表 1)。
表1Wistar大鼠前胃结构变化(,n=36)Tab.1 Structure changes of forestomach in Wistar rats(,n=36)
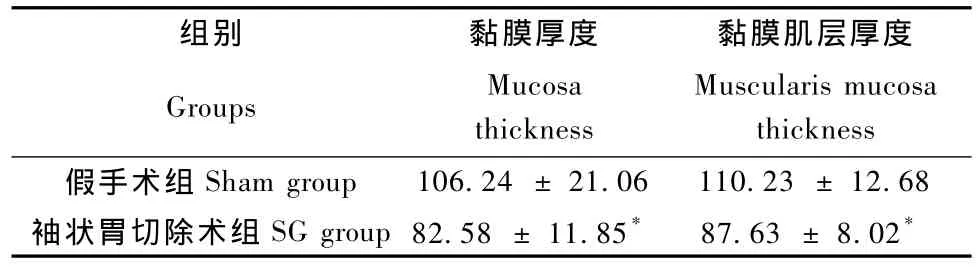
表1Wistar大鼠前胃结构变化(,n=36)Tab.1 Structure changes of forestomach in Wistar rats(,n=36)
注:* P <0.01,与假手术组比较。Note:* P < 0.01,vs.sham group.
Sham group 106.24 ± 21.06 110.23 ± 12.68袖状胃切除术组 SG group 82.58 ± 11.85* 87.63 ± 8.02 Muscularis mucosa thickness假手术组组别 黏膜厚度 黏膜肌层厚度Groups Mucosa thickness*
3 讨论
正常Wistar大鼠袖状胃切除术模型的建立主要为在肥胖大鼠或糖尿病大鼠减重机制中的动物模型建立摸索条件,为进行手术机制的研究提供前期基础。袖状胃切除术虽然较胃旁路术等术式相对简单,但手术的创伤也会引起大鼠死亡及相关并发症,我们在大鼠实验中因出血、吻合口漏造成2只手术组大鼠死亡,Wistar大鼠手术组成活率是83%,基本顺利的建立了袖状胃切除术大鼠实验模型。我们的体会是术中高质量的缝合、止血、麻醉管理等是保证手术成功的关键,随着手术熟练程度的提高,手术时间的缩短,手术创伤也会明显减少,造模的大鼠的成活率会提高。
袖状胃切除术模型要求在安全的基础上寻求持久的减重效果,我们的大鼠手术组术后2周逐渐恢复术前体重,而后的术后12周内保持低体重,与假手术组比较差异有统计学意义(P<0.05)。Wistar大鼠术后2周体重就恢复到术前水平,这一现象与国内报道相符[5],而不同于国外4周体重恢复的报道[6],这种研究结果的差异一方面可能与饲养环境等条件有关,另一方面手术对大鼠体重的影响也是一个主要因素,该术式目前胃组织切除的操作过程还不能做得完全的标准化,会导致术后残胃大小不一致,也可能造成这种结果的差异[7],实验中我们也发现禁食后大鼠胃瘪陷,前胃皱缩,较为规范和精确的切除胃组织存在一定的困难,而大鼠胃底部位是胃饥饿素Ghrelin分泌的主要部位,胃底的有效切除可以减少食物的摄入,降低体内Ghrelin的分泌水平,这可能与大鼠术后12周内保持低体重有关。除了这种胃肠激素的内分泌机制外,袖状胃切除术不应该仅仅被看做是一种单一的限制性手术,术后残胃组织的慢性代偿性扩张的适应性改变也有待深入研究[2]。
大鼠的胃壁由黏膜层、黏膜下层、肌层及浆膜层组成。黏膜为复层鳞状上皮,表面有角化,固有膜薄,黏膜肌层发达,黏膜下层为疏松结缔组织,富含血管[4]。国内报道已经提到了大鼠袖状胃切除术术后前胃代偿性膨大的现象[5],我们在实验中观察到大鼠袖状胃切除术术后腺胃较术前变化不明显,部分有缩窄,而残存的前胃多有膨大和扩张表现,在镜下可见前胃的黏膜上皮及黏膜肌层厚度变薄,这与国外学者的报道一致[3]。前胃的代偿性膨大可能是大鼠体重反弹的组织形态学基础,前胃形态学的深入探讨有助于袖状胃切除术大鼠模型减重机制的阐明,由于大鼠胃组织解剖结构与人体既存在差异又有很多相似性[8],而前胃是人体与大鼠具有差异性的结构,实验中这种前胃形态学的改变还不能用于解释部分临床患者袖状胃切除术术后体重反弹的原因,但也由于大鼠与人体胃组织所存在的相似性,大鼠前胃结构的组织学改变可能对临床袖状胃切除术后残胃扩张有一定的借鉴意义。限于目前本实验仅初步比较了低倍镜下前胃的部分形态学改变,对胃体、胃窦部腺体的形态还有待进一步研究。
总之,我们认为对袖状胃切除术术后 Wistar大鼠前胃的形态学的研究可能有利于进一步阐明该术式大鼠模型的减重和体重反弹机制,也可以给临床研究提供一些有益的思考。
[1] Fezzi M,Kolotkin R L,Nedelcu M,et al.Improvement in quality of life after laparoscopic sleeve gastrectomy[J].Obes Surg,2011,21(8):1161 - 1167.
[2] Santoro S.Is sleeve gastrectomy a restrictive or an adaptive procedure?Reflections on the concepts ofrestriction and adaptation[J].Ann Surg,2010,252(5):892 - 893.
[3 ] Marina Martín M A B,Javier Gómez-Ambrosi V V,Becerril Á B B R.Short- and long-term changes in gastric morphology and histopathology following sleeve gastrectomy in diet-induced obese rats[J].Obes Surg,2012:22,634 - 640.
[4] 苏宁,姚全胜.新药毒理实验动物组织病理学图谱[M].东南大学出版社,2005,9.
[5] 王一龙,蔡景理,徐鲁白,等.袖带胃减容术大鼠模型的建立[J].实验动物与比较医学,2009,29(4):233 -236.
[6] de Bona C J,Bettiol J,D 'Acampora A J,et al.Sleeve gastrectomy model in Wistar rats[J].Obes Surg,2007,17(7):957-961.
[7] Dhahri A,Verhaeghe P,Hajji H,et al.Sleeve gastrectomy:technique and results.[J].Journal of visceral surgery,2010,147(5 Suppl):e39.
[8] Patrikakos P,Toutouzas K G,Perrea D,et al.A surgical rat model of sleeve gastrectomy with staple technique:long-term weight loss results[J].Obes Surg,2009,19(11):1586 - 1590.
