加减射麻止喘汤对哮喘大鼠支气管平滑肌细胞生长周期的干预作用
2013-11-26王维益刘建博蔡俊翔
王维益,刘建博,郭 敏,蔡俊翔,雷 源
(1.广州中医药大学,广东 广州501405;2.广州中医药大学第一附属医院,广东 广州501405)
现代医学认为,哮喘是由多种细胞包括气道的炎性细胞和结构细胞(如嗜酸粒细胞、肥大细胞、T淋巴细胞、平滑肌细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾病[1],其原因是气道发生了重构[2],其中支气管平滑肌细胞(ASMC)增殖在气道重构中占有十分重要的地位。本实验拟通过MTT法及流式细胞术检测分析加减射麻止喘汤对哮喘大鼠ASMC 增殖的干预作用,为支气管哮喘的进一步防治提供一定的实验依据。
1 材料和方法
1.1 材料
1.1.1 动物 SPF 级SD 雄性大鼠,体质量250~300 g,35 只,合格证号:0080764 0077574,许可证号:scxk(粤)2008-0020,广州中医药大学动物实验中心提供。
1.1.2 加减射麻止喘液汤方药 射干,地龙,椒目,北杏仁,法半夏,桔梗,细辛,甘草,质量比为1∶1.2∶1∶0.6∶1.2∶1.2∶0.6∶0.6,按传统煎药法制成含生药为1.48 g/mL 的水剂。
1.1.3 试剂 注射用青霉素钠(批号:Y1203411)、注射用硫酸链霉素(批号:1009104)购于广州中医药大学第一附属医院;鸡卵清蛋白(批号:9006-59-1)、氢氧化铝(批号:21645-51-2)购于广州齐云生物技术有限公司;PMA(批号:1626450)购于LClabs 公司;Ro-31-8220(批号:sc-200619)购于Santa Cruz 公司;核糖核酸酶(RNA 酶)(批号:182651301)、四甲基偶氮唑盐(MTT)(批号:132613903)购于Sigma 公司;木瓜蛋白酶(批号:1626405)购于Merck 公司;胶原酶I型(批号:17100-017)购于Gibco 公司;DMEM 高糖培 养 液 (批号:GNM12800)、胰蛋白酶 (批号:SH30042.01)、PBS 缓冲液(批号:GNM200120)、胎牛血清(FBS)(批号:SV30087.01)购于Hyclone 公司;碘化丙啶(PI)(批号:95458)、二甲基亚砜(DMSO)(批号:196055)、牛血清白蛋白(BSA)(批号:021624104)购于广州威佳科技有限公司。
1.1.4 主要仪器 402AI 超声雾化器由江苏鱼跃医疗设备股份有限公司生产;Epics Altra 流式细胞仪由美国贝克曼库尔特公司生产;TDL-5 离心机由上海天本公司生产;LX70 倒置显微镜由日本Olympus公司生产;550 酶标仪由美国BIO-RAD 公司生产;SL 型CO2培养箱由美国Sheldon 公司生产;自制雾化箱 (35 cm×23 cm×21 cm,箱壁上有一大小约12 cm2可放入雾化管的孔)。
1.2 方法
1.2.1 动物分组 将35 只大鼠分为空白组4 只,正常组5 只,模型组5 只,加减射麻止喘汤高、中、低剂量组各7 只。
1.2.2 哮喘大鼠模型建立[3]哮喘模型组大鼠5只,第1 天每只大鼠腹腔注射含10 mg 卵清蛋白和200 mg 氢氧化铝的生理盐水1.5 mL,第8 天重复致敏1 次,第15 天开始激发,将大鼠置于自制雾化箱内,用超声雾化器喷入含20 mg/mL 卵清蛋白的生理盐水,激发30 min,1 次/d,激发后大鼠出现烦躁、呛咳、呼吸加快等哮喘发作症状,共激发15 d。正常组大鼠5 只,不予药物致敏及雾化。
1.2.3 含药血清制备 将21 只大鼠随机分为高、中、低加减射麻止喘汤给药剂量组(分别予含生药14.8 g/kg、7.4 g/kg、1.48 g/kg 的加减射麻止喘汤),每天灌胃1 次,连续7 d。空白组大鼠4 只,不予药物灌胃。7 d 后各组大鼠分别眼眶静脉采血,离心血清 (3 000 r/min,37 ℃,20 min),56 ℃、30 min 灭活,-20 ℃冷藏备用。
1.2.4 哮喘模型组大鼠支气管平滑肌的病理镜检及ASMC 的提取与传代培养 哮喘模型组大鼠造模成功后最后一次激发后24 h 内,脱颈处死大鼠并浸泡酒精后取出,分离出支气管,提取少量支气管同正常对照组大鼠支气管行镜检(HE 染色),观察病理特点提示哮喘大鼠造模成功(见图1~2)。哮喘模型组大鼠其余支气管置入PBS 液中,用眼科剪剔除肺组织、内外膜及结缔组织等,直至支气管接近透明。将获得的支气管平滑肌组织尽量剪碎,置于含1 mg/mL 胶原酶I 型、1 mg/mL 木瓜蛋白酶、10 mg/mL BSA 的PBS液中,37 ℃消化约20 min 后,室温800 r/min 离心5 min,弃上清液后高糖培养液(DMEM)洗涤2 次,细胞筛筛去组织,用含20% FBS、100 U/mL 青霉素钠、100 U/mL 硫酸链霉素的DMEM 悬浮所分离的细胞,种植于25 cm2培养瓶,置于37 ℃、含体积分数5%CO2培养箱中培养,每2~3 d 换液1 次,约14 d 细胞贴壁生长90%融合后传代培养,实验用3~5 代细胞。

图1 哮喘模型组大支气管平滑肌病理形态光镜图(HE ×200)
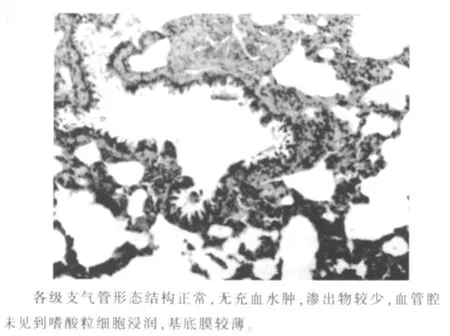
图2 正常组大鼠支气管平滑肌病理形态光镜图(HE ×100)
1.2.5 MTT 法检测ASMC增殖培养的ASMC 按1×105个/孔接种于96 孔板,用高糖DMEM 液培养24 h,使细胞同步于G0期后,分别予加减射麻止喘汤高、中、低剂量含药血清、空白组大鼠血清、蛋白激酶C 激活剂佛波醇-12-肉豆蔻酰-13-乙酸佛波酯PMA (10 nmol/L) 及蛋白激酶C 抑制剂马来酰亚胺甲磺酸盐Ro-31-8220(5 μmol/L)干预,各组设6 个复孔,同时换用含体积分数10% FBS 的DMEM 继续培养24 h 后,每孔加5 mg/mL MTT 20 μL,4 h后去培养液,加DMSO 150 μL 摇匀,约10 min 后用酶标仪于450 nm 处测定各孔吸光度D 值。
1.2.6 流式细胞仪检测ASMC 周期 传代后的ASMC 按1×105个/mL 接种于6 孔板,细胞同步于G0期后分组,均予含10% FBS 的DMEM 液继续培养,同时每 1 mL 细胞培养液中分别予 PMA(10 nmol/L)、Ro-31-8220(5 μmol/L)、含药血清(加减射麻止喘汤高剂量组)及空白组大鼠血清干预,24 h后0.25%胰蛋白酶消化收集细胞,PBS 配制浓度为1×105个/mL 细胞悬液,用预冷的75%乙醇固定,-4 ℃冰箱内放置24 h,800 r/min 离心5 min 沉淀细胞,弃上清液,PBS 洗涤1 次,先后加入50 μg/mL RNA 酶和10 μg/mL PI 各0.5 mL,室温避光放置30 min,流式细胞仪检测细胞周期分布。
1.3 统计学分析
采用SPSS 13.0 统计软件包进行统计分析,实验数据以±s 表示,多组间比较采用F 检验,两两之间比较采用q 检验。
2 结果
2.1 加减射麻止喘汤各组大鼠ASMC D 值
哮喘模型组大鼠ASMC 中,PMA 组D 值较正常组显著增加(P<0.05),Ro-31-8220 组的D 值较正常组显著降低(P<0.05),加减射麻止喘汤高、中、低剂量组的D 值较正常组、PMA 组显著降低(P<0.05);中剂量组的D 值和Ro-31-8220 组无显著差异(P>0.05),高低剂量组的D 值较Ro-31-8220 组显著增加 (P<0.05)。见表1。
2.2 加减射麻止喘汤各组大鼠ASMC 各周期分布百分比
表1 加减射麻止喘汤对各组哮喘大鼠ASMC 的D 值的影响 (n=6,±s)

表1 加减射麻止喘汤对各组哮喘大鼠ASMC 的D 值的影响 (n=6,±s)
注:与正常组比较*P<0.05;与PMA 组比较#P<0.05;与Ro-31-8220 组比较△P>0.05,▲P<0.05。
组 别 D 值PMA 组 0.952 2±0.045 8*▲Ro-31-8220 组 0.501 7±0.077 5*加减射麻止喘汤高剂量组 0.662 2±0.119 2*▲#加减射麻止喘汤中剂量组 0.561 8±0.067 8*△#加减射麻止喘汤低剂量组 0.686 8±0.201 0*▲#正常组 0.810 5±0.054 8
哮喘模型组大鼠ASMC 中,PMA 组G1细胞百分比较正常组显著降低,G2/M 期显著增高(P<0.05),S 期无显著差异(P>0.05);Ro-31-8220 组的G1期细胞百分比较正常组显著升高,G2/M、S 期显著降低(P<0.05);加减射麻止喘汤高剂量组的G1细胞百分比较空白组、PMA 组显著升高,G2/M 期、S 期显著降低(P<0.05);加减射麻止喘汤高剂量组的S 期与Ro-31-8220 组比较显著升高(P<0.05),G2/M 期无显著差异(P>0.05)。见表2。
表2 流式细胞法检测各药物干预组哮喘大鼠ASMC 各周期分布百分比 (±s,n=6,%)

表2 流式细胞法检测各药物干预组哮喘大鼠ASMC 各周期分布百分比 (±s,n=6,%)
注:与正常组比较*P<0.05,▲P>0.05;与PMA 组比较#P<0.05;与Ro-31-8220 组比较△P<0.05,□P>0.05。
组 别 G1 S G2/M PMA 组 55.183 3±3.757 3* 11.366 7±3.338 7▲ 33.483 3±2.658 1*Ro-31-8220 组 94.700 0±0.613 7* 2.500 0±0.687 1* 2.783 3±0.402 1*加减射麻止喘汤高剂量组91.950 0±1.091 3*# 5.800 0±2.101 4*△# 2.250 0±1.350 2*□#正常组 62.950 0±1.348 7 12.483 3±3.754 2 26.433 3±6.077 1
3 讨论
支气管哮喘属中医学“哮病”、“喘证”范畴,其发病与肺、脾、肾三脏有关,多因痰饮内伏、风寒袭肺、痰湿壅阻、肺失宣降所致,故治疗上多以化痰、平喘、宣肺、健脾、补肾等为主。《金匮要略》记载“咳而上气,喉中水鸡声,射干麻黄汤主之”,本研究中加减射麻止喘汤由射干麻黄汤加减化裁而成,具有宣肺平喘、祛痰止咳的功效。既往临床与实验室研究提示射麻止喘液能明显改善哮喘患者肺功能,其机制可能与拮抗炎性介质、降低气道高反应性、降低血黏度[4],降低血浆及肺组织ET 水平,抑制嗜酸性粒细胞的浸润[5],减少血浆cAMP 含量、增加cGMP 含量,松弛支气管平滑肌[6]等作用有关。
蛋白激酶C(PKC)是一类Ca2+、磷脂依赖性的蛋白激酶,在跨膜信号传递过程中起着重要作用,PKC 信号途径是与细胞增殖有关的一种信号转导通路[7-8]。已有研究表明[8]在PKC 激动剂PMA 的刺激下,哮喘大鼠ASMC 细胞增殖水平明显增高,而PKC 抑制剂Ro-31-8220 则能抑制细胞增殖。本实验通过与PMA 组、Ro-31-8220 组、正常组哮喘大鼠ASMC 增殖情况比较,提示加减射麻止喘汤可影响哮喘大鼠平滑肌细胞的生长周期,抑制细胞增殖,从而影响气道重构,而加减射麻止喘汤抑制哮喘大鼠支气管平滑肌细胞增殖的作用与药物浓度的关系有待进一步研究与探讨。
[1]邵晨东.涤痰祛风定喘汤治疗轻中支气管哮喘60 例[J].湖南中医药大学学报,2012,32(2):29-30.
[2]张 梅,林 勇,黄 静,等.雌激素对大鼠急性哮喘模型呼吸力学影响的实验研究[J].现代医学,2006,34(4):245-247.
[2]Kumar RK.Understanding air way wall remodeling in asthma: a basis for improvements in therapy[J].Pharmacol Ther,2001(91):932-1 041.
[3]刘小虹,刘 琼,梁直英,等.射麻止喘液治疗哮喘的近期疗效及其机理[J].广州中医药大学学报,2000,17(1):20-23.
[4]周名璐,陈芝喜,梁直英,等.加味射麻液对哮喘豚鼠GM-CSF 和ET 水平的影响[J].标记免疫分析与临床,2000,7(4): 203.
[6]陈芝喜,粱直英,周名璐,等.射麻止喘液对哮喘豚鼠血浆环核苷酸和TxB2、6-K-PGF1a 水平的影响[J].放射免疫学杂志,2000,13(2):77-78.
[7]Itoh H,Yamamura S,Ware J A,et a.l.Differential effects of protein kinase C on human vascular smooth mucle cell proliferati on and migration [J].Am J Physil Heart Circ Physiol,2001,281(1): 359-370.
[8]Eude I,Da llot E,Ferre F,et al.Protein kinase Calpha is required for endothelin-1-induced proliferation of human myometrial cells[J].B iol Reprod,2002,66(1):44-49.
[9]许淑云,徐永健,张珍祥,等.蛋白激酶C 在支气管哮喘模型大鼠气道平滑肌细胞增殖中信号转导机制研究[J].中华结核和呼吸杂志,2003,26(12):756-760.
