黄芪甲苷对阿霉素心肌损伤的保护作用及Daxx表达的影响
2013-11-26周卫华杨梅松竹石慧娟彭英福李双杰
钟 飞,周卫华,张 洁,杨梅松竹,石慧娟,彭英福,李双杰
(1.吉首大学医学院,湖南 吉首416000;2.湖南省儿童医院肝病中心,湖南 长沙410007)
心肌细胞凋亡是在一定生理和病理条件下,通过特殊信号转导途径,激活细胞“自杀”程序,在基因调控下进行的程序化死亡。目前认为心肌细胞凋亡是心血管疾病发生发展的细胞学基础,在心肌病的发生发展过程中起重要作用[1]。心肌组织死亡结构域相关蛋白(Daxx)是(death domain-associated protein,Daxx)是Yang[2]等在1997年发现的一种Fas 死亡结构域结合蛋白,可激活c-Jun 氨基末端激酶 (c-Jun Nterminal kinase,JNK) 通路诱导细胞凋亡;研究显示,干预Daxx 在心肌中的表达,可减少大鼠心肌梗死的面积与心肌细胞的凋亡[3],我们推测Daxx 可能成为调节细胞凋亡新的重要药理作用靶点,我们以前的研究表明黄芪甲苷具有减少阿霉素性致心肌细胞凋亡作用,本研究在前期工作的基础上,进一步探讨黄芪甲苷调控心肌细胞凋亡的作用机制,为开发研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD 大鼠30 只,SPF 级,体质量200~250 g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2009-0012。
1.1.2 药物 黄芪甲苷(成都锦泰和医药化学技术有限公司),保存于4 ℃冰箱,用甲基纤维素钠配成5 mg/mL;阿霉素(购自湘西自治州肿瘤医院)。
1.1.3 试剂 山羊抗Daxx 抗体、辣根过氧化物酶标记驴抗山羊IG、β-actin 小鼠多克隆抗体、辣根过氧化物酶标记兔抗小鼠IG、complete TM pretease inhibitor cocktail tablet,均由Santa 公司公司提供。PageRulerTM Puls pertained protein ladder(fermentas 公司);硝酸纤维膜、BCA 蛋白浓度测定试剂盒,ECL 超敏化学发光试剂,均由江苏南通碧云天生物技术研究所提供;RIPA Lysis buffer(Millipore 公司);PE 导管(内径0.58 mm,外径0.99 mm,美国健康医疗仪器国际公司)。
1.1.4 仪器 TGL-16G 冷冻离心机(上海安亭科学仪器厂生产);723 可见分光光度计(上海光谱仪器有限公司);莱卡切片机(RM2126 上海);全自动生物组织脱水机(YD-12G 金华益迪医疗设备有限公司);生物组织包埋机(YD-6L 产地金华益迪医疗设备有限公司);紫外分光光度计(UV-3100 产地上海美普达仪器有限公司),DYCZ 双板夹芯式垂直槽 (北京六一厂);半干式碳板转移电泳槽 (北京六一厂);BL-420E 生物机能实验系统(成都泰盟软件有限公司)。
1.2 方法
1.2.1 动物分组 大鼠随机分为3 组,即空白组、模型组、黄芪甲苷组,每组10 只。
1.2.2 造模方法 参照文献用阿霉素造模[4]2.5 mg/kg,隔日1 次腹腔注射,每周3 次,共2 周,总剂量为15 mg/kg。
1.2.3 给药方法 空白组采用生理盐水0.6 mL 腹腔注射,隔日1 次,共6 次,同时用1%羧甲基纤维素钠1 mL,灌胃1 次/d。模型组采用阿霉素造模(2.5 mg/kg,隔日1 次腹腔注射,共6 次,总剂量为15 mg/kg);同时灌胃给予1%羧甲基纤维素钠1 mL,1 次/d。黄芪甲苷组造模方法同模型组,同时灌胃给予黄芪甲苷[5]30 mg/kg(用1 mL 1%甲基纤维素钠溶解),1 次/d 灌胃,连续2 周。
1.2.4 心功能检测 最后1 次阿霉素处理24 h 后,用20%乌拉坦4 mL/kg 腹腔注射麻醉大鼠,取仰卧位固定,颈部正中切口,游离右颈总动脉,经右颈总动脉向左心室插入自制的心室插管(内径0.58 mm,外径0.99 mm)导管内充满1%的肝素,稳定20 min后,用数据采集和分析系统测量左室收缩压(LVSP)、左室内压最大上升/下降速率(±dp/dtmax)等心功能指标。
1.2.5 心肌损伤理学检测 心功能测定后,断头处死,用预冷的生理盐水洗净残血,取部分心肌10%的甲醛固定24 h,常规脱水透明,石蜡包埋,切片,片厚5 μm,HE 染色,光学显微镜观察结果并照相。
1.2.6 心肌生化指标的检测 心功能测定后,断头处死,用预冷的生理盐水洗净残血,取中下部分心肌,-80 ℃保存备用,取部分心肌匀浆测定丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性,TBA法测定MDA 含量,羟胺法测定SOD 活性,蛋白质定量用BCA 法,严格按照试剂盒说明书操作。
1.2.7 蛋白电泳和蛋白免疫印迹 (western-blot)检测死亡结构域相关蛋白(Daxx)表达 取心肌组织约50 mg,用用预冷的RIPA Lysis buffer 加omplete TM pretease inhibitor 500 μL,用匀浆器破碎细胞,4 ℃,12 000 g,离心10 min,取上清液,用BCA 法蛋白定量,取100 μg 蛋白,10%分离胶和4%浓缩胶SDS-PAGE 胶电泳3 h,蛋白经半干电转膜系统转至硝酸纤维膜,10%脱脂奶粉封闭1 h,加山羊抗大鼠Daxx 抗体(1∶500),4 ℃过夜,TTBS 洗3 次,10 min/次,驴抗山羊IG(1∶1 000),37 ℃振荡孵育2 h,TTBS 洗3 次,10 min/次,加ECL 反 应 液5 min,暗室暴光,压片,用凝胶成像分析系统摄像分析。
1.3 统计学分析
所有数据采用SPSS 16.0 统计软件进行分析,采用“±s”表示,组间比较用方差分析和两两比较S-N-K 法,P<0.05 示差异有统计学意义。
2 结果
2.1 黄芪甲苷对大鼠心脏LVSP、±dp/dtmax 等心功能的影响
与空白组相比,模型组大鼠心肌LVSP,±dp/dtmax 等指标显著降低,提示其心功能显著下降。灌胃给予黄芪甲苷后,大鼠心肌LVSP,±dp/dtmax 等指标与模型组相比明显改善。结果见表1。
表1 黄芪甲苷对大鼠心脏LVSP,±dp/dtmax等心功能的影响 (±s,n=10,mmHg/s)

表1 黄芪甲苷对大鼠心脏LVSP,±dp/dtmax等心功能的影响 (±s,n=10,mmHg/s)
注:与空白组相比**P<0.01,与模型组相比#P<0.05。
组 别空白组模型组黄芪甲苷组LVSP 135.64±11.2 96.82±7.46**119.17±10.23#+dp/dtmax 5 769±1 104 2 876±976**4 376±1 146#-dp/dtmax 5 216±1 214 2 347±942**3 615±1 087#
2.2 黄芪甲苷对阿霉素大鼠心肌组织病理的影响
空白组心肌细胞排列整齐,胞核清晰,无心肌纤维的破坏,细胞间隙正常,未见水肿,组织间隙无炎性渗出。模型组心肌细胞肿胀,排列紊乱,心肌纤维减少,肌原纤维断裂,多灶性坏死,心肌坏死灶内可见单核、淋巴细胞浸润。黄芪甲苷组病变明显减轻,心肌细胞水肿减轻,炎症细胞浸润明显减少,肌原纤维排列较整齐,心肌细胞胞间隙增宽,心肌间可见部分红细胞浸润。见图1。

图1 黄芪甲苷对阿霉素大鼠心肌组织病理影响的光镜图(HE 染色,×400)
2.3 黄芪甲苷对心肌生化指标的影响
模型组大鼠心肌组织MDA 含量升高,与空白相比差异有统计学意义(P<0.01);模型组大鼠心肌组织SOD 和GPX 活性下降,与空白相比差异有统计学意义(P<0.01);灌胃给予黄芪甲苷后,大鼠心肌组织MDA 含量下降,大鼠心肌组织SOD 和GPX 活性升高,与模型组相比差异有统计学意义(P<0.05),结果见表2。
表2 黄芪甲苷对大鼠心肌组织SOD、GPX 活性和MDA 含量的影响 (±s,n=10)
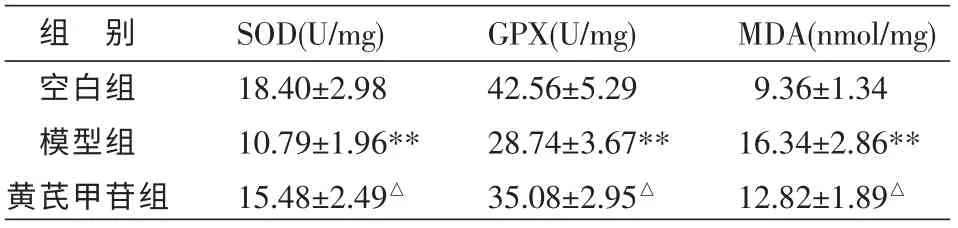
表2 黄芪甲苷对大鼠心肌组织SOD、GPX 活性和MDA 含量的影响 (±s,n=10)
注:与空白组相比**P<0.01,与模型组相比△P<0.05。
组 别空白组模型组黄芪甲苷组SOD(U/mg)18.40±2.98 10.79±1.96**15.48±2.49△GPX(U/mg)42.56±5.29 28.74±3.67**35.08±2.95△MDA(nmol/mg)9.36±1.34 16.34±2.86**12.82±1.89△
2.4 western-blot 结果
与空白组相比,模型组大鼠心肌组织Daxx 增加至正常水平的(2.95±0.38)倍(P<0.01),黄芪甲苷灌胃给药后大鼠心肌组织中daxx 的表达增加至正常水平的(1.93±0.46)倍,与模型组相比差异有统计学意义(P<0.01)。见图2。
3 讨论

图2 大鼠心肌组织中Daxx 蛋白免疫印迹检测图
普遍认为阿霉素诱导的心肌损伤与过量氧自由基的产生有关[1,6],它导致细胞膜脂质过氧化,引起细胞膜的直接损害。本实验中模型组大鼠心肌组织中得MDA 含量显著升高,SOD 和GSH-PX 活性显著降低(P<0.05),表明ADR 引起明显心肌细胞脂质过氧化反应,导致心肌细胞损伤,这与文献报道一致[7]。模型组病理结果可见心肌细胞肿胀,排列紊乱,心肌纤维减少,肌原纤维断裂,多灶性变性和坏死;测定LVSP、±dp/dtmax 等心功能指标,模型组LVSP,±dp/dtmax 等指标显著恶化,阿霉素组大鼠出现了左室收缩功能障碍,证实阿霉素心肌损伤模型是成功的。
近年来的研究证实阿霉素导致心肌细胞凋亡在其对心肌的毒性损伤机制中起重要的作用[8]。Fas(CD95)为死亡受体,属于肿瘤坏死因子受体(TNFR)家族成员。FasL(又名CD178)为肿瘤坏死因子相关的凋亡诱导配体。当表达Fas 的靶细胞和活性细胞的FasL 交联后,启动凋亡信号传导途径,从而激活Fas/FasL 途径下游的白细胞介素-1β 转化酶的相关蛋白酶系列,引起核酸内切酶活化,降解DNA 修复酶及细胞骨架调节蛋白,最终导致Fas 表达阳性的靶细胞凋亡[9]。Fas/FasL 系统介导的凋亡信号传导途径是许多心血管疾病发生发展的重要机制。Kim 研究首先证实daxx 在氧化应激诱导的细胞凋亡中发挥重要作用[10],H2O2处理细胞能诱导Daxx 表达上调,而用反义寡核苷酸抑制daxx 的表达能抑制H2O2诱导的细胞凋亡。Yaniv 研究[11]进一步探明了daxx诱导细胞凋亡的作用机制,首先H2O2激活Fas,Fas的死亡结构域可与Daxx 的C 末端一个功能区结合,通过激活C-Jun 氨基末端激酶(JNK)途径而启动凋亡的发生。我们的实验结果表明,daxx 在阿霉素心肌损伤大鼠心肌中表达升高,表明daxx 可能通过Fas-daxx-JNK 介导了阿霉素诱导的细胞凋亡。
黄芪甲苷为中药黄芪的重要的活性成分,研究表明其对病毒性心肌炎具有良好的治疗效果,能改善病毒性心肌损伤大鼠心功能、减轻心肌损伤病理改变[12]。我们以前的研究证实黄芪甲苷可以显著减少阿霉素所诱导的心肌细胞凋亡[13];本研究表明黄芪甲苷能降低阿霉素大鼠心肌组织MDA 含量,升高SOD 和GSH-PX 活性;明显减轻其病理改变程度,黄芪甲苷能下调阿霉素心肌损伤大鼠心肌组织daxx 的表达从而起到抑制心肌细胞凋亡的作用,明显改善其心功能。综上所述daxx 在阿霉素心肌损伤大鼠心肌中表达上调,并在阿霉素心肌损伤的发生发展中起一定的作用,黄芪甲苷能下调daxx 的表达,改善阿霉素心肌损伤大鼠的心功能,减轻病理损害,其机制可能与其清除氧自由基、抑制细胞凋亡等作用有关。
[1]Guzman Mentesana G,Baez A,Cordoba R,et al.Role of mitochondria and reactive oxygen species in the progression of heart failure [J].Rev Fac Cien Med Univ Nac Cordoba,2010,67(4):150-158.
[2]Yang X,Khosravi-Far R,Chang HY,et al.Daxx,a novel Fas-binding protein that activates JNK and apoptosis [J].Cell,1997,89(7):1 067-1 076.
[3]Roubille F,Combes S,Leal-Sanchez J,et al.Myocardial expression of a dominant-negative form of Daxx decreases infarct size and attenuates apoptosis in an in vivo mouse model of ischemia/reperfusion injury [J].Circulation,2007,116 (23):2 709-2 717.
[4]王 华,卢 青,刘越美,等.超微通阳调心方对扩张型心肌病大鼠心肌细胞凋亡及BNP 的影响 [J].湖南中医药大学学报,2010,30(9):64-66,77.
[5]李 丽,陶辉宇,陈杰斌,等.黄芪甲苷保护阿霉素心肌损伤的抗氧化机制研究[J].临床儿科杂志,2007(1):58-61.
[6]Lu L,Wu W,Yan J,et al.Adriamycin-induced autophagic cardiomyocyte death plays a pathogenic role in a rat model of heart failure [J].International Journal of cardiology,2009,134(1):82-90.
[7]Arunachalam S,Kim SY,Lee SH,et al.Davallialactone protects against adriamycin-induced cardiotoxicity in vitro and in vivo[J].Journal of Natural Medicines,2012,66(1):149-157.
[8]Kumar D,Jugdutt BI.Apoptosis and oxidants in the heart[J].The Journal of laboratory and clinical medicine,2003,142(5):288-297.
[9]Lien YC,Lin SM,Nithipongvanitch R,et al.Tumor necrosis factor receptor deficiency exacerbated Adriamycin -induced cardiomyocytes apoptosis: an insight into the Fas connection[J].Mol Cancer Ther,2006,5(2):261-269.
[10]Kim KS, Hwang HA, Chae SK, et al.Upreguiation of daxx mediates apoptosis in response to oxidative stress [J].J Cell Biochem, 2005,96(2):330-338.
[11]Yaniv G,Shilkrut M,Larisch S,et al.Hydrogen peroxide predisposes neonatal rat ventricular myocytes to Fas-mediated apoptosis[J].Biochem Biophys Res Commun,2005,336(3):740-746.
[12]罗永姣,刘红英,李双杰.小鼠柯萨奇B3 病毒性心肌炎心脏炎症细胞因子基因和蛋白表达及黄芪甲苷干预研究[J].中国动脉硬化杂志,2009,17(2):122-124.
[13]钟 飞,李 辉,周卫华.黄芪甲苷对大鼠阿霉素心肌细胞凋亡的影响[J].吉首大学学报(自然科学版),2008,12(6):104-106.
