球孢白僵菌工程菌株构建及其环境安全性分析
2013-11-26吕丁丁李增智
吕丁丁,李增智
(1.镇江高等专科学校电子与信息工程系,江苏镇江 212003;2.安徽农业大学安徽省微生物防治重点实验室,安徽合肥 230036)
随着社会经济的发展和人们环保意识的提高,环境友好型生物源杀虫剂的应用越来越受重视。利用昆虫病原真菌加工而成的真菌杀虫剂的应用及基础研究得到了长足的发展,但由于存在击倒昆虫所需时间较长,对环境条件要求高等缺点,真菌杀虫剂的应用受到一定程度的限制。有目的地对生产菌株进行遗传改良,获得高效工程菌并研制高活性新剂型是克服这些弱点的关键,将大大加速真菌杀虫剂的产业化步伐[1]。
球孢白僵菌(Beauveria bassiana)作为重要的昆虫病原真菌在害虫的生物防治中发挥着重要作用。
通过基因工程技术提高昆虫病原真菌的毒力是进一步扩大真菌杀虫剂应用范围的有效手段,已经报道的毒力基因高表达是一种行之有效的方法。将带有苯菌灵抗性基因质粒pBENA3与带有体壁降解酶Prl基因的质粒pMAPR-1置于金龟子绿僵菌1080菌株进行原生质体共转化试验,得到的过量表达Prl工程菌株获得了显著提高的杀虫活性[2]。也可以将外源毒素基因(如北非蝎Androctonus australis昆虫特异性神经毒素多肽基因)导入昆虫病原真菌以提高真菌的杀虫毒力。引入蝎毒基因AaⅠT而构建的绿僵菌工程菌株对烟草天蛾和埃及伊蚊子(Aedes aegypti)的致死剂量减少至原来的1/20[3]。可见,采用毒力基因或外源毒素基因超量表达等基因工程技术可以极大地提高虫生真菌的杀虫效率[4]。
本研究主要是构建一个含有外源毒素基因AaⅠT的虫生真菌的工程菌株,获得高毒力的工程菌株,为生物防治提供性能良好的出发菌株,并为高效杀虫剂的研制提供基础资源,克服真菌杀虫剂击倒昆虫所需要的时间长,对环境条件要求高等缺点,这将大大加速真菌杀虫剂的产业化步伐。同时,本文针对基因工程重组菌株的安全性问题进行深入探讨和分析,并提出一些解决方案以供参考。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒
1)菌株。球孢白僵菌(Beauveria bassiana)Bb202,保藏于安徽农业大学安徽省微生物防治重点实验室,作为转基因的出发菌株。其寄主是松墨天牛(Monochamus alternatus Hope),来源于日本。
2)载体。pGPET1由中国科学院上海生命科学研究院植物生理生态研究所王成树课题研究组保存并提供。
1.1.2 主要试剂和工具酶
PCR纯化试剂盒(QIAquick PCR Purification Kit)、RNA提取试剂盒(RNeasy Plant Mini Kit)和胶回收试剂盒(QIAquick Gel Extraction Kit)为QINGEN产品。
质粒抽提试剂盒购自上海生工生物工程技术服务有限公司。
第一链cDNA合成试剂盒(revertra ace-α-)为TOYOBO产品。
DNA marker为上海鼎国生物工程有限公司出品。
Taq酶、dNTP,限制性内切酶类、T4连接酶和去磷酸化酶均为TAKARA产品。
1.1.3 主要培养基
1)SDB培养基:DifcoTMSabouraud Dextrose Broth(Becton Dickinson)30 g/L。
2)PDA培养基:Potato Dextrose Agar(青岛高科园海博生物技术有限公司)46 g/L。
3)L-borth培养基:葡萄糖10 g,蛋白胨5 g,酵母浸出粉 2 g,KH2PO41.52 g,NaCl 5 g,MgSO4·7H2O 0.52 g,pH6.8 ~7.0,加蒸馏水至 1000 mL。
4)基础培养基:葡萄糖1%(w/v),NaNO30.6%(w/v),KCl 0.052%(ω/v),MgSO4.7H2O 0.052%(w/v),KH2PO40.025%(w/v),琼脂 1.5%(w/v)。
1.2 方法
1.2.1 球孢白僵菌对草胺磷的敏感性测定
分别取草胺磷含量为 0 μg/mL,50 μg/mL,100 μg/mL,150 μg/mL,200 μg/mL,250 μg/mL,300 μg/mL的基础培养基2.5 mL倒入6 cm培养皿。每个梯度倒2皿。
同时,制备孢悬液:在Bb202的平板上刮取少量孢子到4 mL 0.05%的Tween20中,vortex振荡混匀,再用玻璃丝棉过滤,除去菌丝,把滤液的孢子浓度稀释到1×106个/mL。
在抗性平板上涂孢悬液20 μL,在25℃培养箱培养,48 h后开始观察。每隔12 h或24 h观察1次,记录,统计。
1.2.2 原生质体法转化Bb202
原生质体的制备和转化主要参考相关文献资料[5]。
1.2.3 球孢白僵菌基因组DNA的提取
1)接种 Bb202到 SDB中,离心 150 rpm,摇晃2 d。
2)抽滤菌丝,称取湿菌丝0.1 ~0.2 g。
3)使用快速核酸提取仪,5.0 m/s,10 s,重复2次。
4)加 550 μLDNA 提取液和 5 μLβ-巯基乙醇,混匀。
5)放置于65℃水浴中30 min。其间,每隔10 min温和混匀1次。
6)加500 μL水饱和苯酚,充分混匀。
7)离心5000 rpm,5 min,转移上清液至一新的1.5 mL离心管中。加500 μL氯仿与异戊醇的混合液,比例为24∶1,混匀。离心5000 rpm,5 min。重复2~3次。转移上清液到一新的1.5 mL离心管中,加500 μL异戊醇,温和混匀。
8)置于-20℃,30 min后,离心12000 rpm,15 min。
9)弃上清液,用70%乙醇清洗沉淀。
10)在室温下干燥几分钟。
11)取300~500 μL EB缓冲液重悬沉淀,即得孢白僵菌基因组DNA。
1.2.4 真菌转化子的PCR初步筛选与验证
分别提取转化菌株的基因组DNA后,用2对引物BarF/BarR和pgdF/T1R(见表1)进行PCR验证。
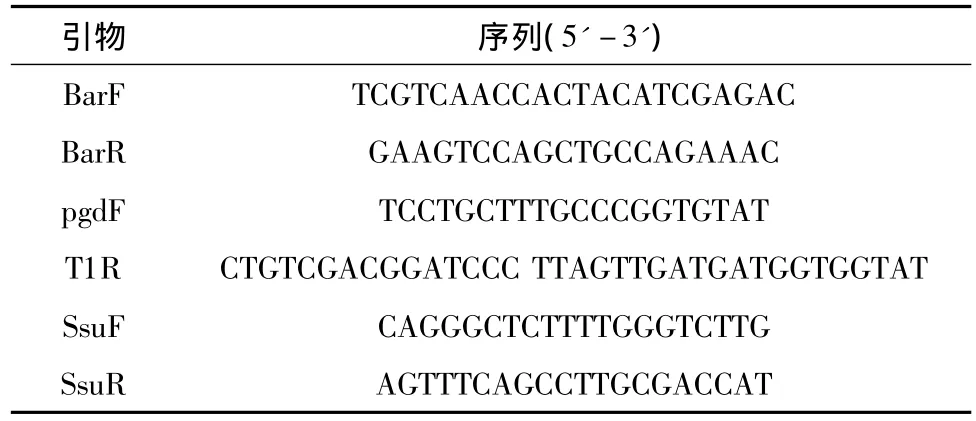
表1 文中所用引物序列
1.2.5 真菌转化子的继代培养
挑取的转化子经PCR验证后,需要进一步证明转化子的遗传稳定性。首先,对PCR验证的转化子进行单孢分离。然后,继代培养5代。5代后再对其进行PCR验证。其中的单孢分离做法如下:
1)把转化的白僵菌菌株接种到PDA培养基上,培养7~10 d。
2)铲取孢子到4 mL 0.05%的tween-20中,充分振荡混匀。
3)用5 mL针筒和玻璃丝棉过滤孢悬液。
4)稀释到在血球计数板中的一个大方格内仅有2~3个孢子。
5)再稀释50×,100×,200×,300×。
6)各取50 μL涂抗性平板。
7)2 d后挑取单菌落至PDA平板培养。
1.2.6 真菌转化子的RT-PCR验证
真菌基因组RNA的提取参照QINGEN的RNeasy Plant Mini Kit试剂盒的说明书。利用RNA PCR Kit(TAKARA)试剂盒进行RT-PCR验证,用引物T1F/T1R进行检测,内参选用18S,其引物是SsuR/SsuF。
1.2.7 工程菌株对松墨天牛幼虫的毒力测定
松墨天牛幼虫采自安徽宣城林场。带回后在室内饲养3 d,选择健康、虫龄一致的幼虫装入宽试管中。1管1虫,管内放适量湿润的松末屑(已消毒),棉塞中夹一个200 μL的枪头并且棉塞加湿,以保持足够的氧气和湿度。置于25±1℃恒温培养。
将Bb202T-7菌株的孢悬液涂布PDA平板上,置于25±1℃恒温箱中培养8 d。待其充分产孢后,将孢子粉刮下,转到适量0.01%吐温-20溶液中,用vortex将孢子粉充分振荡分散。用血球记数板测定含孢量,配制成常用浓度为1×107个/mL的孢悬液。
每株菌株的每种浓度的处理是:10头虫子1种处理,每种处理3次重复。以0.01%的吐温-20溶液作空白对照实验。
采用浸渍法接种,预先将每一种处理的试虫放进各种浓度的孢悬液中,在悬浮液中浸20~30 s后进行接种。对照实验是浸染0.01%吐温-20溶液。
处理后的试虫装到适宜的且已放有新鲜饲养物的养虫器皿中,再将器皿置放于25±1℃恒温箱中培养。
处理后的48 h内湿度控制在90%以上,以后每隔12 h清理虫粪1次,并且更换新鲜叶片或饲料。
从第2天开始,每天定时观察、记录器皿中试虫的死亡情况,并将死虫移出,放在盛有湿润吸水纸的培养皿内的载玻片上,25℃左右保湿培养。罹病昆虫均镜检记数,持续观察15 d。
2 结果和分析
2.1 球孢白僵菌对草胺磷的敏感性测定
球孢白僵菌对草胺磷的敏感性测定结果如图1所示。当草胺磷的浓度为100 μg/mL时,草胺磷对球孢白僵菌分生孢子萌发的抑制率在8 d之内都能达到90%以上,所以,本实验选用100 μg/mL作为草胺磷对球孢白僵菌的最佳抑制浓度。

图1 草铵膦对球孢白僵菌分生孢子的抑制率
2.2 白僵菌转化子的PCR和RT-PCR验证
由于原生质体转化效率较低,本次转化仅获得1个转化子,将此转化子命名为Bb202T,经基因组DNA的PCR扩增后,结果如图2所示,片段大小与目的基因大小一致,测序结果证明确实为目的基因。对转化子进行单孢分离,继代培养5代后,随机抽取3株单孢株,提取总RNA,用RT-PCR检测的结果经电泳,如图3所示,扩增条带与AaⅠT基因一致,证明目的基因已在白僵菌Bb202体内成功转录。选取Bb202T-7做为测试出发菌株。

图2 PCR检测转基因菌株Bb202T

图3 RT-PCR的电泳图谱
2.3 目的基因在菌株内经过传代后的遗传稳定性验证
为检测转化子Bb202T的遗传稳定性,经单孢分离后,随机挑选7个单菌落,继代培养5代后,提取基因组DNA,对目的基因片段进行PCR扩增,结果如图4所示。可知,继代后转化子目前仍能保持其遗传稳定性。
关于外源基因插入真菌核DNA的研究迄今尚不多见。鉴于异核现象、核异质现象可能会使白僵菌在多次继代培养中易于变异,关于工程菌株的稳定性尚需更多的传代观察才能确定。
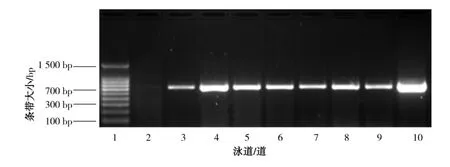
图4 PCR检测第5代工程菌株Bb202T的7株单孢株
2.4 毒力的生物测定
Bb202最初分离的寄主是松墨天牛,因此,本实验选用五龄松墨天牛作为Bb202的毒力生物测试虫。从图5可以看出,侵染转基因菌株Bb202T-7的松墨天牛的存活率要明显的低于被野生型菌株Bb202侵染的。
运用专业软件SPSS进行统计分析,结果如表2所示。野生型菌株Bb202的半致死时间为4.5±0.3 d,Bb202T-7的半致死时间为4±0.4 d。野生型菌株要比转基因菌株的致死中时间(LT50)长0.5d,杀虫效率提高了11.11%。松墨天牛经转基因菌株侵染后,产孢仍然很好。
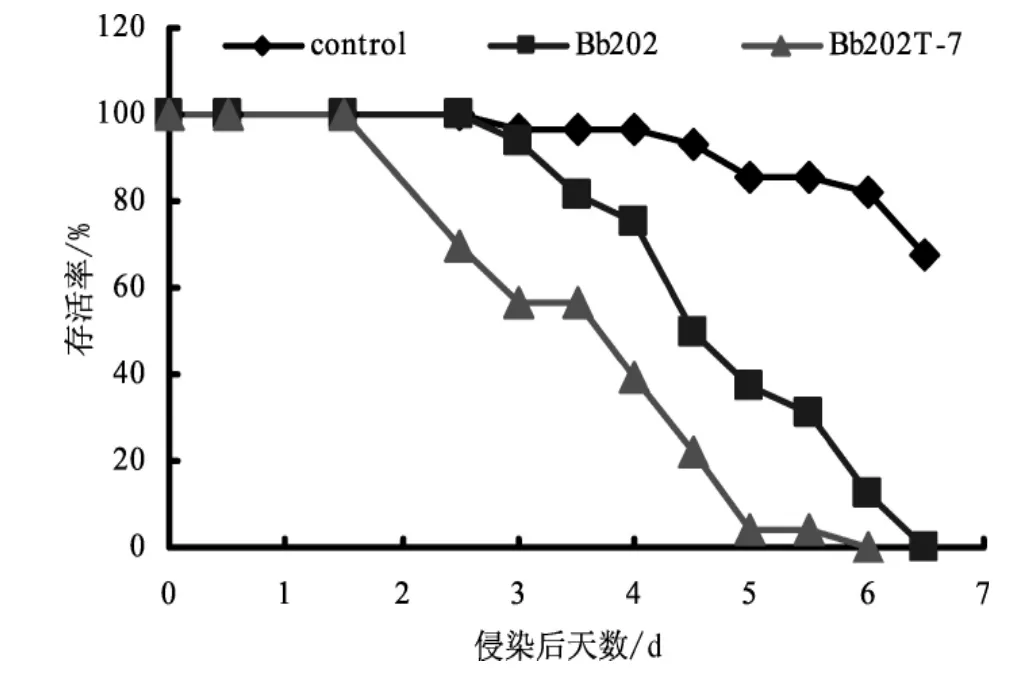
图5 不同菌株侵染的松墨天牛存活率
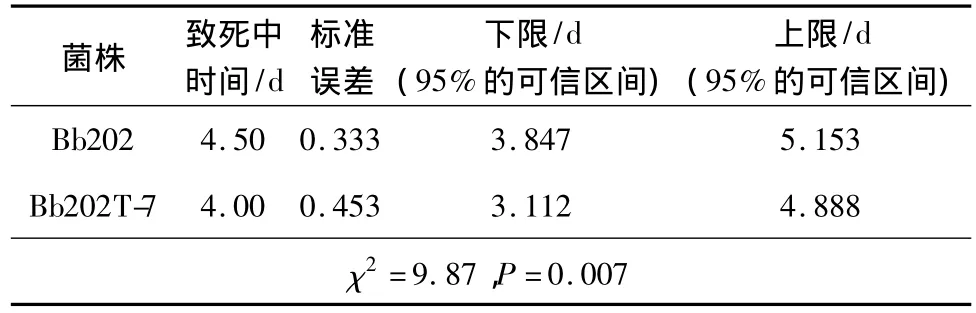
表2 松墨天牛的致死中时间(LT50)
3 讨论
随着昆虫病原真菌分子生物学研究的深入,基因工程改造的菌株出现了[6],工程菌株的安全性问题引起了人们的注意[7]。由于向已知菌株中导入的外来遗传物质会改变该菌株的一些特性,因此,这种转基因菌株在环境中可能出现一些不可知的负面效应。如遗传改造的菌株有可能在环境中保存并传播,由于它们具有很强的毒力,有可能会对未在实验室分析的非靶标生物造成危害。与野生型菌株相似,遗传改造的菌株在坏境中可能因突变而改变寄主范围,这种高毒力菌株可能对已知的非靶标生物造成更为严重的危害。导入的外源遗传物质可能会通过有性或无性的方式渗漏到其他微生物中,并赋予它们高毒力的性状,从而给非靶标生物和生态平衡造成一定的危害[8]。
对非靶标生物造成危害和遗传物质发生渗漏的前提是昆虫病原真菌在环境中存在较长时间。因此,缩短昆虫病原真菌在环境中的存在时间可以在很大程度上消除工程菌株的安全隐患。在自然环境中,由于各种不利因素的存在,病原真菌的菌丝不能适应恶劣的环境,而以孢子等形式生存下来并传播。可以通过物理、化学等手段获得孢子形成突变体,这种突变体在施用后不能产生孢子,因而难以在环境中生存或扩散[8]。然而,有些病原真菌的菌丝没有毒力,只有孢子才有毒力,必须以孢子的形式生产和使用。在这种情况下,可以采用一种类似于“终端策略”(terminator strategy)的方法来解决安全性问题。在此策略中,抑制抱子生成的基因受化学诱导型启动子的调控,在施用真菌杀虫剂之前用化学物质处理孢子,诱导抑制孢子生成的基因表达,使病原真菌释放后不能产生孢子,而只能以菌丝的形式存在[8]。由于真菌特别是昆虫病原真菌的孢子形成和萌发机制还远未阐明,因此用化学诱导系统控制真菌孢子的形成和萌发还只处在设想阶段。昆虫病原真菌大多数要通过附着胞等侵染结构致使昆虫染病,目前对附着胞形成机制研究得相对清楚,可以考虑通过调节附着胞的形成控制昆虫病原真菌对非靶标生物的危害[4]。
虽然基因工程改造的昆虫病原真菌有潜在的危害,但通过选择目的基因和在释放前对菌株的各项指标进行严格检验,成功释放基因工程改造的病原真菌是有可能的。第一个高效表达自身毒力基因PrlA的金龟子绿僵菌(M.anisopliae)工程菌株已成功获准释放[9]。
[1]吕丁丁,李增智,王成树.虫生真菌分子致病机理及基因工程改造研究进展[J].微生物学通报,2008,35(3):443-449.
[2]STLEGER R J,JOSHI L,BIDOCHKA M J,et al.Construction of an improved mycoinsecticide overexpressing a toxic protease[J].Proc Natl Acad Sci,1996(93):6349-6354.
[3]WANG C,STLEGER R J.A scorpion neurotoxin increases the potency of a fungal insecticide[J].Nat Biotechnol,2007,25(12):1455-1456.
[4]吕丁丁.球孢白僵菌基因工程菌株构建及杀虫效率评价[D].合肥:安徽农业大学林学与园林学院,2008:2-25.
[5]WANG C S,STLEGER R J.A collagenous protective coat enables Metarhizium anisopliae to evade insect immune responses[J].Proc Natl Acad Sci,2006(103):6647-6652.
[6]FREY P M.Biocontrol agents in the age of molecular biology[J].Trend in Biotechnology,2001,19(11):432-433.
[7]GOETTEL M S,HAJEK A E,SIEGEL J P,et al.Safety of Fungal biocontrol agents[M]∥Butt T M,Jackson C,Magan N.Fungi as biocontrol agents.New York:CAB International,2001:347-375.
[8]GRESSEL J.Potential failsafe mechanisms against the spread and introgression of transgenic hypervirulent biocontrol fungi[J].Trend in Biotechnology,2001,19(4):149-154.
[9]STLEGER R J,SCREEN S E.Prospects for strain improvement of fungal pathogens of insects and weeds[M]∥BUTT T M,JACKSON C,MAGAN N.Fungi as biocontrol agent.New York:CAB International,2001:219-237.
