藤黄酸对骨肉瘤中hTERT和Bcl-2蛋白的影响
2013-11-24单玉兴张海玉王立君万法青卢良杰
单玉兴,张海玉,王立君,万法青,卢良杰
(吉林大学白求恩医学部第一医院1.骨科;2.儿外科,吉林 长春130021)
藤黄酸(gambogic acid,GA)为新型抗肿瘤药物,对正常组织细胞无副作用,是很有发展前景的抗肿瘤药物[1]。端粒酶在肿瘤细胞的发生,发展中所起的作用已被认可。90%以上的肿瘤细胞都具有较高的端粒酶活性,而多数的体细胞则缺少端粒酶活性[2]。端粒酶以自身的R N A为模板逆转录合成端粒D N A重复序列并添加到端粒末端,以补偿因细胞每次分裂而丢失的末端碱基,保证染色体结构的稳定性和完整性,为肿瘤细胞的永生化提供了条件。端粒酶逆转录酶(hTERT)是端粒酶的限速成分,hTERT基因的表达调控对端粒酶表达活性调节起决定性作用,Bcl-2基因(即B细胞淋巴瘤/白血病-2基因)是一种原癌基因,具有抑制细胞凋亡的作用。hTERT和Bcl-2蛋白都是很好的肿瘤治疗靶点,本实验通过研究GA对骨肉瘤细胞中hTERT和Bcl-2蛋白的影响,为GA治疗骨肉瘤的临床应用提供理论依据。
1 材料与方法
1.1 材料 人骨肉瘤细胞株(HOS和CCK8)购于北京鼎国昌盛生物技术有限责任公司。GA购于北京易莱西诺生物科技有限公司。主要试剂:胎牛血清(HyClone)购于赛默飞世尔生物化学制品(北京)有限公司。hTERT抗体购于Santa Cruz公司;Bcl-2抗体,DAB显色试剂盒,免疫组化染色试剂盒(SP试剂盒)均购于武汉博士德生物工程有限公司。
1.2 方法
1.2.1 细胞培养 在5%CO2、饱和湿度、37℃孵箱中传代培养,培养基为含10%胎牛血清和100μ/ml双抗的高糖DMEM(含酚红)。
1.2.2 CCK-8法检测细胞增殖状况 将细胞种植于96孔板中,每孔5×103个细胞。培养24h后,每孔分别加入终浓度为0.125,0.25,0.5,1,2,4,8 μmol/L,含有 GA的培养基200μl,同时设一不加药物组,置于培养箱内继续培养24h,48h,72h,96 h,120h后每孔加入CCK-8溶液20μl,培养箱内继续培养4h。选择490nm波长,在酶联免疫检测仪上测定各孔吸光值;在显微镜下观察细胞形态并照相。以时间为横轴,吸光值为纵轴绘制细胞生长曲线。细胞存活分数(survival fraction,SF)计算公式为:SF(%)=(实验组 OD值/对照组 OD值)×100%。实验进行3次,最后以3个平行样品的SF均值±标准差(±s)绘制时间-存活曲线。
1.2.3 免疫组化检测hTERT和Bcl-2蛋白的表达
将细胞种植于24孔板中,每孔4×105个细胞,设置2个实验组,每组3个平行样,同时设立对照组。培养24h后,每孔加入含有最适浓度GA培养基1 ml,培养3d,5d。采用链霉素亲生物素-过氧化酶联接法(SP法)。常规固定,染色,10倍倒置显微镜下,选取具有适当形态学特征的细胞照相。应用Image J软件和Image Pro Plus软件对免疫组化图像进行半定量分析。
1.3 统计学分析
统计学处理:采用SPSS软件进行统计学处理。数据以(±s)表示,组间比较采用t检验,相关分析采用配对卡方检验,以P<0.05为差异有显著性。
2 结果
2.1 GA作用后细胞存活 细胞存活曲线描述了不同药物剂量在不同时间骨肉瘤细胞存活情况。见图1。
骨肉瘤HOS细胞的存活率随着时间的推移明显降低,而且未见明显的后期细胞增殖。相关性分析结果显示,细胞的存活率与药物剂量呈负相关(P<0.01)。
2.2 hTERT和Bcl-2蛋白检测 应用Image Pro Plus软件对免疫组化图像分析表明各图像灰度值逐渐增强,说明各图像蛋白含量逐渐减低。数据显示实验组的hTERT和Bcl-2蛋白表达明显低于对照组,且表达强度明显与时间呈负相关。(见表1)。
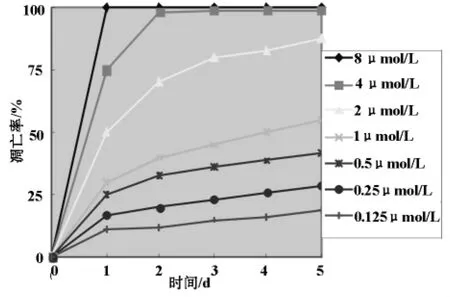
图1 凋亡率与时间、药物剂量之间的关系

表1 免疫组化图像灰度值分析
应用Image J软件对免疫组化图像进行阳性细胞计数,阳性细胞越多,说明表达hTERT和Bcl-2蛋白的细胞越多,也就意味着表达hTERT和Bcl-2蛋白的细胞分布之广,反之亦然。经配对卡方检验,差异有显著性(P<0.05).(见表2)
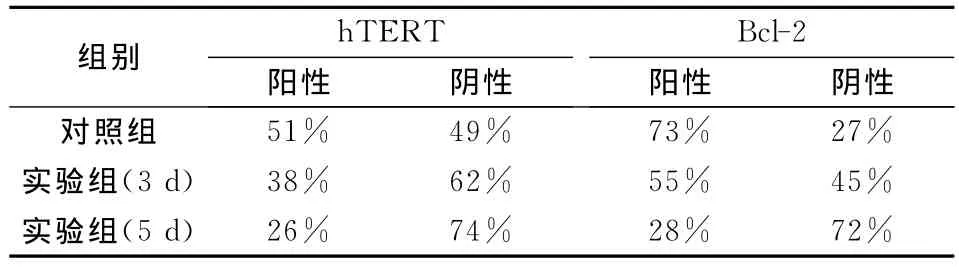
表2 免疫组化图像阳性细胞数分析
2.3 hTERT和Bcl-2蛋白表达的关系 通过配对卡方检验,发现hTERT和Bcl-2蛋白的表达具有高度的一致性,两者表达具有显著相关性(P<0.05)。
3 讨论
本实验在了解hTERT与Bcl-2蛋白的诸多行为关系的基础上,旨在了GA对骨肉瘤(HOS)中hTERT和Bcl-2蛋白的影响及可能相关性,同时为GA的临床应用提供理论依据。
骨肉瘤(成骨肉瘤)是最常见的恶性骨肿瘤。发病率很高,典型骨肉瘤一般见于10-20岁年龄段,但在任何年龄段都可发生,包括婴幼儿,儿童以及老年人。男性发病率较高,男女之比约2∶1。具有很强的局部浸润能力和肺转移能力。手术治疗已大大提高了患者的预后,但有很高的致残率。
常规化疗副作用大,且预后较差。GA为抗肿瘤一类新药,已进入临床研究。目前研究表明GA在有效剂量范围内毒副作用比较小,其抗癌作用与一般的化疗抗癌药有所区别,能选择性的杀死癌细胞,而对正常组织细胞无明显影响,有很好的发展前景。
端粒酶在90%的癌细胞中高表达,而在正常细胞中表达很少,是公认的抗癌靶点,可反映化疗的效果[3]。而端粒酶活性受hTERT 的调控[4,5],是端粒酶的限速酶[6],与端粒酶活性具有平行关系[7,8]。目前很多学者将目光转向hTERT,希望能够有所突破[9]。Bcl-2基因是大家关注热点,已有大量文献报道Bcl-2蛋白可保护细胞免于凋亡,同时提高hTERT 的表达[10-12],但是也有实验证实 Bcl-2蛋白与hTERT 无相关,甚至负相关[13,14]。
本实验发现未经处理的骨肉瘤细胞在光镜下观察主要为短梭形,细胞排列紧密,核大,核分裂多见,细胞密集时呈多层生长。经GA处理后,细胞形态变成以多角形为主,单层排列,细胞大小趋向均一,核小而深染,提示形态上出现分化改变。随着药物浓度的增高,骨肉瘤细胞的凋亡率明显增大;随着药物作用时间的延长,细胞的凋亡率也明显增大。在最适浓度的作用下,以时间为轴线,在对照组中,hTERT和Bcl-2蛋白的表达无明显变化;在实验组(3d),实验组(5d)中,hTERT和Bcl-2蛋白的表达在逐渐减弱,与药物作用时间呈负相关,与相关报道一致[15,16];二者与药物存在时间依赖关系,在表达上呈高度一致性。
GA、hTERT存在时间依赖关系,但是并不确定GA是否直接影响端粒酶活性;Bcl-2蛋白与hTERT存在高度一致性,二者之间是否存在互相协助的作用,有待进一步研究;因部分正常组织中存在端粒酶活性,所以GA对其有无副作用,同样有待进一步研究;hTERT和Bcl-2基因蛋白的表达的测定是半定量的,还存在某些假阳性和假阴性的可能;肿瘤细胞内为低PH状态[17],但本实验的肿瘤细胞是在pH7.2-7.4状态下进行的,这不能反映体内恶性肿瘤组织的低PH状态。以上问题有待进一步论证。
[1]郭青龙,赵 丽,吴照球,等.藤黄酸对实验性动物造血功能及免疫功能的影响[J].中国天然药物,2003,11(1):229.
[2]Kim N W,Piatyszek M A,Prowse K R,et al.Science,1994,266:2011.
[3]Kido A,Tsujiunchi T,Morishita T,et al.Telomerase actinity clrre-lates with growth of tranplantabl osteo-sarcomas in rates treated with cis-ciammine dichloroplatinum or the angiogenesis inhibitor AGM 1470[J].J Pn J Cancer Res,1998,89(10):1074.
[4]Rama Krishman S,Eppenber Ger V,Shin Kai H,et al.Expression profile of the putative catalgtic subunit of t heTelomerase gene[J].Cancer Res,1998,58(4):622.
[5]Yokoyama Y,et al.Biochem Biophys Res Commun[J].2000,273(1):316.
[6]Arinaga M,Shimim S,Gotoh K,et al.Expression of human telomerase subunit genes in primary lung cancer and its clinical significance[J].Ann Thorac Stag,2000,70(2):401.
[7]Sharma GG,Gupta A,Wang H,et al.hTERT associates with human telomeres and enhances genomic stability and DNArepair[J].Oncogene,2003,22(1):131.
[8]Masutomi K,Yu EY,Khurts S,et al.Telomerase maintains telomere stru-Cture in normal human cells[J].Cell,2003,114(2):241.
[9]朱 悦,郑剑玲,张 斌,等.端粒酶催化亚单位和cmyc在骨肉瘤中的表达[J].中国肿瘤临床,2003,30(1):23.
[10]Mahttosh M,Rakesh K.Bcl-2modulat-es telomerase activity[J].Journal of Biological Chemistry,1997,272(22):14183.
[11]Atsushi I,Akio Y,Kazwo H,et al.Te-lomerase activity in colorectal cancerand its relationship to Bcl-2express-ion[J].Journal of Surgical Oncology,2000,73(4):219.
[12]Fu W N,James GB,Michacl WK,et al.Anti-apoptotic role of telomerasein pheochromocytoma cells[J].1999,274(11):7264.
[13]Matin V,Stephin W,Peter G,et al.On the significance of telomerase acti-vity in human malignant glioma cells[J].European Journal of Pharmacology,2000,47:27.
[14]Ohmura Y,Ao E,Andou A,et al.Te-lomerase activity and Bcl-2 expression in non-small cell lung cancer[J].Clinc Cancer Res,2000,6(68):2980.
[15]Qing Zhao,Yong Yang,Jun Yu,et al.Posttranscriptional regulation of the telomerase hTERT by gambogic acid in human gastric carcinoma 823cells[J].Cancer Letters,2008,262(2):223.
[16]Xu XY,Liu YQ,Wang L,et al.Gambogic acid induces apoptosis by regulating the expression of Bax and Bcl-2and enhancing caspase-3activity in human malignant melanoma A375cells[J].International Journal of Dermatology,2009,48(2):186.
[17]Aghunand N,He X,Van Sluis R et al.Enhancement of chemotherapy by manipu-lation of tumor PH[J].Br J Cancer,1999,80(7):5.
