潮州地区人乳头瘤病毒52型L1基因多态性分析
2013-11-24罗招云杨立业陈默蕊
罗招云,陈 强,杨立业,林 敏,陈默蕊
(1.南方医科大学附属潮州中心医院 检验实验中心,广东 潮州521000;2.吉林大学公共卫生学院)
宫颈癌是女性常见的恶性肿瘤,仅次于乳腺癌占恶性肿瘤的第二位[1]。研究证实高危型人乳头瘤病毒(high risk human papillomavirus,HR-HPV)持续感染是宫颈癌及其癌前病变发生的最重要危险因素[2]。目前关于16及18型HPV的报道很多,对52型的研究较少见。HPV52作为HPV16簇群中的成员,具有高度致癌性的HPV型别,在亚洲等地呈现特殊的流行状况,逐渐引起人们的关注。HPV52是潮州地区 HR-HPV优势基因型别(30.55%,1005/3290)[3]。由于 HPV52与不同遗传背景的宿主相互作用会引起病毒的变异,影响HPV感染和转归,了解HPV52基因多态性将为明确宫颈癌的发生和运用免疫学策略预防HPV52相关疾病提供新的思路。由于源于中国内地的HPV52基因序列较少,本研究在潮州地区采集女性宫颈脱落细胞标本,进行HPV分型和HPV52L1测序,将所获得的HPV52L1序列与GenBank基因库中的联合进行系统全面分析,探讨HPV52L1基因多态性。
1 材料与方法
1.1 样本来源 取自2009年8月至2010年8月间潮州地区农村女性宫颈癌筛查的49458份宫颈脱落细胞标本(年龄35~60岁,平均46.98岁,均为生育女性,先前均无宫颈手术史)。先进行HR-HPV 13种高危型别的实时荧光定量PCR筛查(杭州博日),阳性者再进行21型核酸分子快速导流杂交分型检测(凯普生物技术有限公司)。HR-HPV阳性者同时进行液基薄层细胞学检查(LCT)。LCT检查采用广州安必平医药公司提供的制片仪器(LBP-2801)及其配套试剂,以 The Bethesda System(TBS)报告系统为诊断标准。选择单纯HPV52型感染阳性的标本为研究对象。
1.2 标本的采集 此次宫颈癌筛查活动通过了潮州市中心医院伦理委员会的批准。标本采集前由受检者签署知情同意书。由专科医生使用凯普公司专用宫颈刷完成。扩阴器暴露宫颈口后,棉拭子擦去分泌物,宫颈刷顺时针刷转3~5圈后将宫颈刷保存于样品管的保存液中。
1.3 DNA模板的制备 DNA提取试剂盒(凯普公司生物技术有限公司),标本制备按说明书操作。
1.4 目的序列PCR扩增和测序 HPV52L1PCR以上述提取DNA为模板。HPV52L1引物设计根据GenBank基因库天津参考株(TJ49-52,ACCESSION:GQ472848)序列设计特异性引物,并经Primer5.0分子生物学软件分析优化。参考Gen-Bank基因库中HPV52L1区通用型引物 MY09/MY11, MY09:5’-CGTCCMARRGGAWACTGATC-3’, MY11: 5 ’-GCMCAGGGWCATA-AYAATGG-3’;因L1基因序列全长1590bp较长,故将L1分为4个区段,自行设计HPV52L1区段特异引物正反向4对,分别为HPV52-L1-1,
F:5′-CCATTACCTTCGTTACCCACA-3′,
R:5′-AGGATGCCCACTAATACCC-3′HPV52-L1-2,
F:5′-GCTTGGAAATCGGTAGGG-3′,R:5′-GCAGTATTGCCAGAGTTAGACC-3′HPV52-L1-3,
F:5′-AGGGTCTAACTCTGGCAATAC-3′,
R:5′-CCTGTAGCCCTGCCTGTA-3′HPV52-L1-4,
F:5′-ATGAAAATTTTAAGGAATACC -3′,
在2017—2018秋季学期“生物化学”课程的教学中,采用“大班授课、小班研讨”、“设计问题和案例”、“网络平台实现师生互动”、“改变成绩评价体系”等方面的教学改革,在提高大班型授课效率方面取得了一定成效,并对上课模式和效果进行了无记名问卷调查,向参与的学生(参与传统教学问卷为120人,参与教学改革后问卷为110人)提出了5个问题。
R:5′-ACATACATAACATGCAAACAAC-3′上述引物均由Invitrogen生物技术有限公司(上海)合成。PCR扩增仪为ABI2700热循环仪。L1基因PCR反应条件:50μl反应体系(包含2μl模板DNA,灭菌去离子水34.0μl,10×PCR Buffer 5.0 μl,dNTPs 4.0μl(0.2mmol/L),DMSO为1μl,引物P1,P2各1.6μl(0.4μmol/L),Taq DNA 聚合酶1U/0.8μl);L1-1反应条件为:93℃5min后进行循环,93℃1min,52℃1min,72℃1min,36个循环,最后72℃延伸10min。取10μl PCR反应产物在2.0%琼脂糖凝胶电泳检测,观察结果并照相。L1-2、L1-3、L1-4的反应条件与 L1-1只有第三步的退火温度不同,分别为 L1-2(52℃),L1-3(57℃),L1-4(57℃),其它步骤与 L1-1完全一致。HPV52 L1PCR反应产物送广州英潍捷基(上海)贸易有限公司双向测序,对测序结果进行分析。Taq酶、dNTPs、PMD18-T载体为TakaRa公司产品。
1.5 HPV52L1区段序列测定 因L1序列全长1 590bp较长,故将L1分为4个区段,分别用L1-1、L1-2、L1-3、L1-4进行 DNA 测序,测序后再拼接。利用BLAST将所测序列与GenBank基因库中HPV52序列进行比对。
1.6 序列分析 通过BioEdit软件工具向Gen-Bank核酸数据库提交,利用BLAST和DNA STAR等在线分析工具对所获得序列进行分析,将所测序列与GenBank基因库中天津参考株(ACCESSION:GQ472848)的HPV52L1编码区序列进行比对。对出现的变异进行多态性分析。本研究获得的73株组成数据集,合并全同序列,然后分组。将潮州地区的HPV52L1变异株基因序列上交NCBI GenBank基因库。
1.7 建立 HPV52-L1进化树 通过BioEdit、Clustal-1.8和 Mega-5.05软件工具,以及利用 NCBI→BLAST在线分析工具,按照构建系统进化树的步骤操作。
2 结果
2.1 HPV52L1基因的PCR扩增结果及初步鉴定以选取的101例HPV52单纯感染者宫颈脱落细胞 DNA 为模板,成功获得 L1-1、L1-2、L1-3、L1-4各83份PCR扩增阳性产物,PCR扩增产物长度分别为:L1-1为526bp、L1-2为547bp、L1-3为596 bp、L1-4为560bp。PCR扩增产物经2.0%琼脂糖凝胶电泳后,分别在相应位置附近显示一条特异DNA条带,其大小与预期值一致,见图1。

图1 HPV52-L1中4片段PCR扩增产物琼脂糖电泳图
2.2 HPV52-L1序列测定和分析 将83份L1-1、L1-2、L1-3、L1-4PCR扩增阳性产物进行正、反双向测序,成功获得正、反各73条 L1-1、L1-2、L1-3、L1-4基因序列,利用BioEdit和DNA STAR等在线分析软件将 L1-1、L1-2、L1-3、L1-4再拼接成 HPV52 L1全序列。利用DNA STAR/Edit Seq软件分析,以天津参考株L1编码区序列中起始密码和终止密码处小片段,找到相对应的起始密码和终止密码,起始密码和终止密码之间的基因序列就是所测的L1编码区序列,再利用BLAST在线分析工具,将HPV52L1基因序列与GenBank收录的天津参考株L1编码区序列进行比对,一致性均为99%。对73条HPV52L1核苷酸序列进行同源性分析,L1基因型内核苷酸同源性为99.1%~99.9%,符合分型规律[4]。

表1 HPV52-L1基因测序结果与潮州地方株比对碱基突变类型和位置
2.4 HPV52L1 15组序列进化树之间的关系 进化树中上部分的潮州地区的12组编码序列与广州的、天津的、浙江等国内的和泰国、印度等东南亚国报道株亲缘关系最近;进化树中下部分的CZ52D416组编码序列与 TJ49-52(GQ472848)株和 Qv03594(HQ537740)株亲缘关系最近;进化树下部分的2组(CZ52E928、CZ52E136)编码序列与哥斯达黎加和德国等美欧国家报道的株亲缘关系最近,见图2。
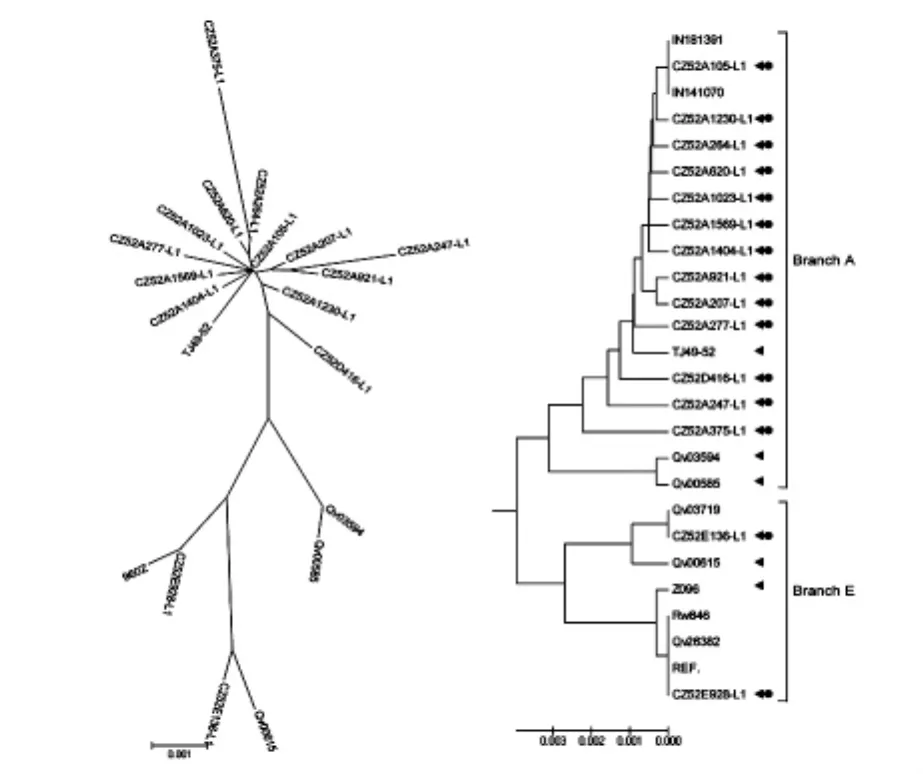
图2 HPV52-L1 15组序列进化树
2.5 HPV52不同突变株的Accession号和73株感染者的LCT结果 将潮州地区15株不同的HPV52 L1变异株基因序列上交GenBank基因库,获得15株 的 Accession 号,GenBank accession codes:JN874416、JN874417、JN874419 ~ JN874428、JN874430、JN874434、JN874436。为了了解 HPV52 L1变异株的致瘤性,比较不同的HPV52L1变异株群的宫颈病变严重程度差别,其中CZ52A105组中有1例高级别鳞状上皮内病变(high grade squamous intraepithelial lesions,HSIL),CZ52A277组为1例鳞状细胞癌(squamous cell cancer,SCC)见表2。
3 讨论
研究表明HPV52在中国和亚洲妇女中常见[5]。某些地区甚至高于 HPV16和 HPV18,在上海、四川、广东等地,高发态势尤为明显[6]。HPV52作为HPV16簇群中的成员,是具有高度致癌性的HPV型别之一[7],在亚洲等地呈现特殊的流行状况。L1基因是HPV晚期结构蛋白基因,有较强的抗原性和免疫原性,能诱导机体B细胞产生中和抗体,从而阻断病毒感染,因而L1蛋白是防治HPV感染基因工程疫苗研究的重要靶抗原[8]。研究证实,不同地域间HPV L1基因存在变异现象[9]。国内研究发现扬州地区L1基因存在7处变异[10]。本研究发现,潮州地区HPV52L1基因序列有31处碱基分别出现变异,其中6处由于核苷酸的改变,其编码氨基酸也相应发生变化;另外25处为同义突变,未影响氨基酸的改变。提示HPV52L1编码基因中可能存在一系列中国地区的高频率突变位点;结果也提示潮州地区不同L1基因序列之间存在差异,特别是氨基酸的改变,可能会造成HPV52L1蛋白免疫原性的差异。有学者报道HPV不同的变异株与子宫颈鳞状上皮内瘤变(cervical intraepithelial neoplasia,CIN)程度相关[11]。HPV16的亚美或非洲变异株比欧洲变异株具有更强的发生宫颈癌的危险性[12]。本研究分析了潮州地区HPV52L1基因的突变谱及主流型,并预测了其功能变化。L1蛋白的改变将导致病毒的组装、感染以及抗原表位的改变,使病毒逃避机体免疫识别,从而造成病毒的持续和重复感染,促进宫颈癌的发生[13]。提示L1基因突变为HPV52型种系发生提供了确凿的资料,也为HPV52型预防性疫苗研制提供新的思路和基本条件。潮州地区的L1基因多态性形成15种突变模式,分为东亚和欧洲2种谱系。主流突变的东亚群L1基因序列多与国内的(广州、天津、浙江等)和东南亚地区(泰国、印度、香港、台湾等)报道的HPV52株同源;欧美群L1基因序列与哥斯达黎加和德国等欧美国家报道的株亲缘关系最近。说明不仅在不同国家之间,即便在我国不同地区之间和不同检测对象之间,L1基因多态性也存在较大的差异。
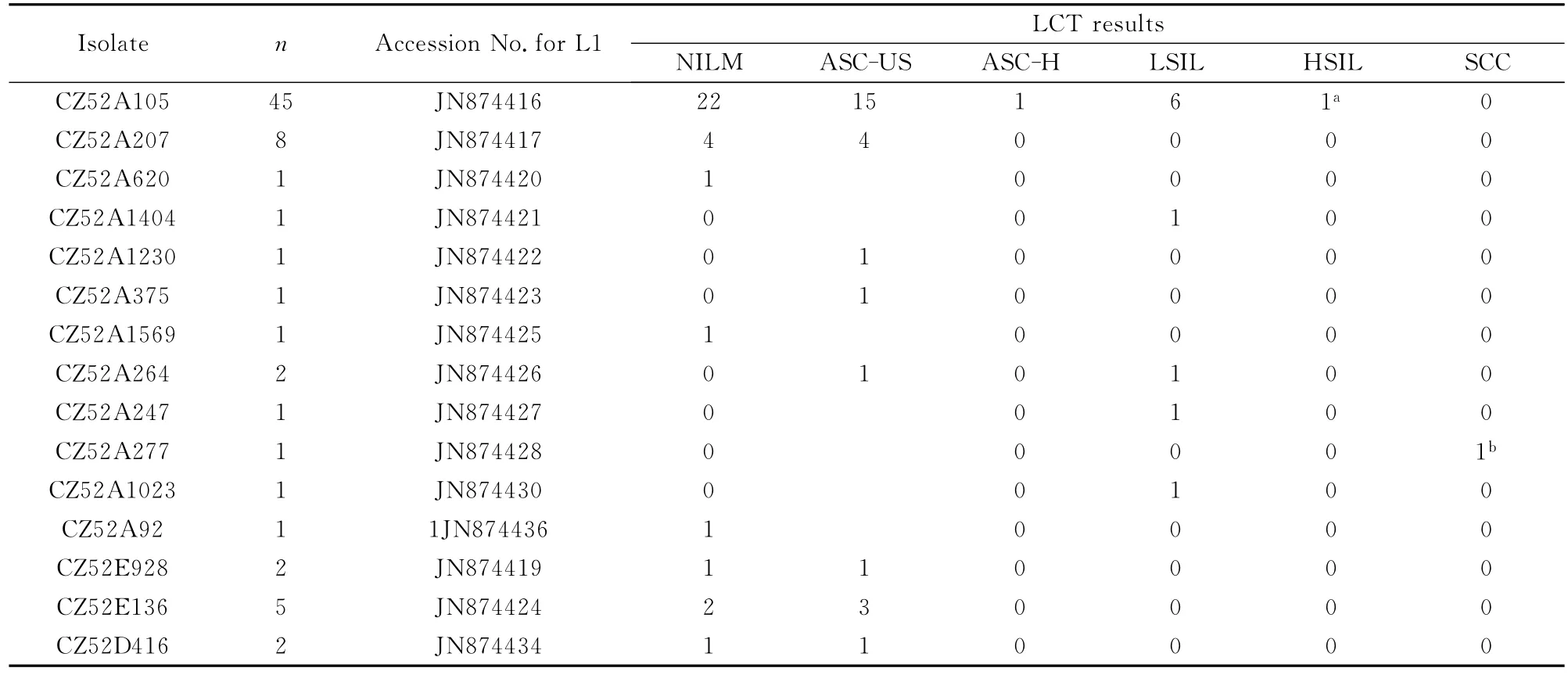
表2 HPV52不同突变株的Accession号和LCT结果(n=73)
综上所述,HPV52在亚洲CIN发生中可能占据重要地位。本研究探明了潮州地区HPV52L1基因结构特点和变异规律,为制备适合中国人群的HPV宫颈癌疫苗提供流行病学资料和理论依据。
[1]Renshaw AA,Young NA,Birdsong GG,et al.Comparison of performance of conventional and ThinPrep gynecologic preparations in the College of American Pathologists Gynecologic Cytology Program[J].Arch Pathol Lab Med,2004,128(1):17.
[2]赵戴君,龚向真,胡争光,等.上海市社区子宫颈人乳头瘤病毒感染现况及危险因素研究[J].现代预防医学,2010,37(10):1867.Zhao DJ,Gong XZ,Hu ZG,et al.The prevalence study on the human papillomavirus(HPV)infection and the risk factors of the community female popμlation in Shanghai[J].Modern Preventive Medicine,2010,37(10):1867.
[3]罗招云,杨立业,翁妙珊,等.潮州地区人乳头瘤病毒型别分布特征分析[J].分子诊断与治疗杂志,2011,3(3):177.Luo ZY,Yang LY,Weng MS,et al.Analysis of subtypes distribution of human papillomavirus in Chaozhou area[J].Journal of Molecμlar Diagnostics and Therapy,2011,3(3):177.
[4]Bernard HU,Burk RD,Chen Z,et al.Classification of papillomaviruses(PVs)based on 189PV types and proposal of taxonomic amendments[J].Virology,2010,401:70.
[5]Onuki M,Matsumoto K,Satoh T,et al.Human papillomavirus infections among Japanese women:age-related prevalence and typespecific risk for cervical cancer[J].Cancer Sci,2009,100(7):1312.
[6]Lai C H,Huang H J,Hsueh S,et al.Human papillomavirus genotype in cervical cancer:apopμlation-based study[J].Int J Cancer,2007,120(9):1999.
[7]Bouvard V,Baan R,Straif K,et al.A review of human carcinogens-Part B:biological agents[J].Lancet Oncol,2009,10(4):321.
[8]刘锡光,刘忠,田厚文,主编.人乳头瘤病毒感染及其防治[M].北京:人民卫生出版社,2009,225-229.Liu XG,Liu Z,Tian HW,chief editor.Infection and preventive of human papillomavirus[M].First published.Beijing:People health publishing company,2009,225-229.
[9]Icenogle JP,Sathya P,Miller DL,et al.Nucleotide andamino acid sequence variation in the LI and E7open reading frames of human papillomavirus type 6and type 16[J].Virology,1991,184(1):101.
[10]Mayrand MH,Coutlee F,Hankins C,et al.Detection of human papillomavirus type 16DNA in consecutive genital samples does not always represent persistent infection as determined by molecμlar variant analysis[J].J Clin Microbiol,2000,38:3388.
[11]Schiffman M,Rodriguez AC,Chen Z,et al.A Popμlation-Based Prospective Study of Carcinogenic Human Papillomavirus Variant Lineages,Viral Persistence,and Cervical Neoplasia[J].Cancer Res,2010,70:3159.
[12]Sichero L,Ferreira S,Trottier H,et al.High grade cervical lesions are caused preferentially by non-European variants of HPVs 16and 18[J].Int J Cancer.2007;120:1763.
[13]马正海,张富春,梅新娣,等.新疆南部地区维吾尔族妇女宫颈癌组织中人乳头状瘤病毒16型L1基因突变谱分析[J].中华医学杂志,2004,84(12):987.Ma ZH,Zhang FC,Mei XD,et al.Analysis of Human Papillomavirus 16E6Oncogene Mutation in Xinjiang Uygur Women with Cervical Carcinoma[J].Chinese Medical Journal,2004,84(12):987.
