应用基因测序方法检测哮喘儿童的PTEN基因突变
2013-11-24赵宏霞钟慧君
赵宏霞,曹 敏,钟慧君,刘 瑜
(南方医科大学附属深圳妇幼保健院 儿内科,广东 深圳518028)
支气管哮喘为小儿的常见病、多发病,近年来其发病率有逐年增高趋势,世界范围内儿童哮喘流行病学调查结果显示,儿童哮喘患病率较10年前明显升高,全世界每年因哮喘而死亡的病人数高达10万人,哮喘已成为当今世界威胁公共健康最常见的慢性肺部疾病,其造成的社会负担超过艾滋病与肺结核的总和[1,2]。
近几年,哮喘遗传相关基因成为研究的热点。PTEN基因是一个具有双重特异性磷酸酶活性的肿瘤抑制基因,它在过敏性气道炎症中的作用近年来逐渐受到国内外学者的关注。韩国学者Yong等首次报道了PTEN在过敏性炎症中的作用,指出PTEN可能通过抑制哮喘模型鼠气道内嗜酸性粒细胞(eosinophils,EOS)脱颗粒和活化,降低IL-4、IL-5的浓度,从而减轻嗜酸性粒细胞炎症和气道高反应性[3]。
本实验拟对哮喘及健康儿童的PTEN基因第5、第8外显子进行DNA测序分析,检测其基因突变情况,并计数外周血EOS,初步探讨PTEN基因突变与儿童哮喘的相关性,及其与外周血EOS的关系,进一步探究儿童哮喘的发病机理,为儿童哮喘预防及控制药物的药物研发等提供一定的理论和实验依据。
1 对象与方法
1.1 研究对象及分组
1.1.1 哮喘组 2011年1月到2011年12月于本院门诊随诊的30例哮喘患儿(临床缓解期),男、女各15例;年龄3-15岁,平均4.8岁。均符合儿童支气管哮喘诊断标准,入组前一周无使用激素及急性感染性疾病病史。
1.1.2 对照组 2011年1月到2011年12月于本院健康体检儿童30例,男16例,女14例;年龄3-15岁,平均4.9岁。均无过敏性疾病病史,入组前一周无使用激素及急性感染性疾病病史。
两组儿童性别、年龄差异均无统计学意义,具有可比性。两组儿童家长均知情同意参加该项课题研究。
1.2 方法
1.2.1 标本采集 两组儿童均于清晨空腹留取外周静脉血2ml,1ml提取全基因组DNA,-20℃冰箱冻存备检;其余1ml做血涂片。
1.2.2 DNA提取 全血1ml加入适当体积磷酸盐缓冲液(Phosphate Buffered Saline,PBS)、蛋白酶-K消化,使用饱和酚及酚-氯仿-异戊醇混合液依次进行抽提,提取出的DNA用无水乙醇沉淀,70%乙醇洗涤,干燥后加细胞裂解液溶解。
1.2.3 PTEN目的基因扩增 exon-5、exon-8引物由上海生工生物工程有限公司合成。引物序列祥见表1。
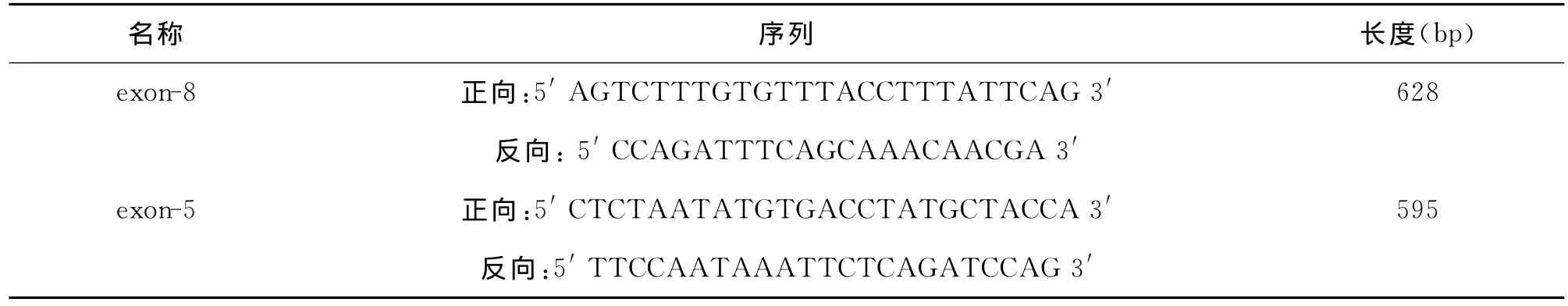
表1 引物名称及序列
PCR反应体系总体积为25μl,其中模板DNA1 μl,dNTP 0.25mmol/L,Taq DNA聚合酶0.25μl,引物0.8μmol/L,Mg2+2.5mmol/L。
反应条件:94℃5min预变性;94℃30s、52℃30s、72℃60s扩增40个循环;72℃ 延伸10min。
取PCR产物10μl在2%琼脂糖凝胶进行电泳,电泳产物进行回收、纯化。
1.2.4 基因测序 采用美国PE ABI公司310型DNA测序仪进行测序。利用DNASIS MAX V3.0软件对测序结果进行分析。
1.2.5 EOS计数 于400倍高倍镜下进行外周血嗜酸粒细胞计数。
1.2.6 统计学分析 计数资料采用χ2检验,计量资料采用t检验,用SPSS 13.0进行统计分析,P<0.05差异有显著意义。
2 结果
2.1 PTEN基因突变与儿童哮喘的关系
2.1.1 哮喘组和对照组PTEN基因第5外显子未发现存在基因突变。
2.1.2 哮喘组PTEN基因第8内含子的第32个碱基发生突变,T→G,突变率为83.3%(25/30)。对照组物基因突变。突变位点见图1所示。
2.2 外周血EOS计数结果
2.2.1 哮喘组儿童外周血EOS计数明显高于对照组儿童,差异有统计学意义(P<0.05),见表2所示。
2.2.2 哮喘患儿中,根据有无发生PTEN基因第8内含子突变,分为基因突变组和基因正常组,组间性别、年龄差异均无统计学意义。PTEN基因发生突变的哮喘患儿外周血EOS计数高于无突变的哮喘儿童,差异显著(P<0.05),见表3所示。
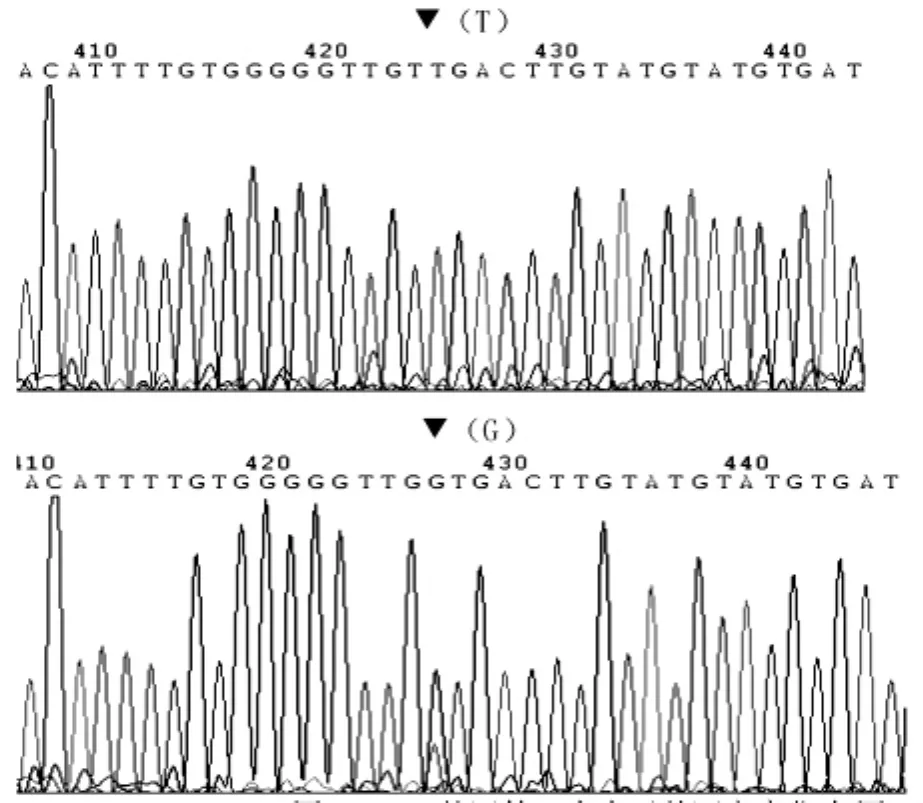
图1 PTEN基因第8内含子基因突变位点图
表2 哮喘组和对照组儿童外周血EOS计数比较(±s)
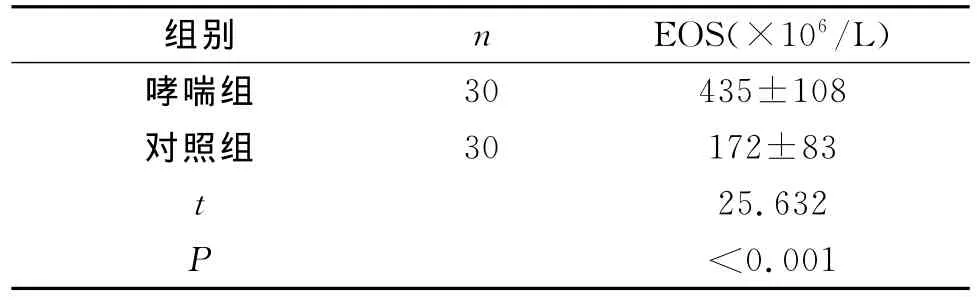
表2 哮喘组和对照组儿童外周血EOS计数比较(±s)
组别 n EOS(×106/L)30 435±108对照组 30 172±83 t 25.632 P<0.哮喘组001
表3 哮喘患儿中基因突变组和基因正常组外周血EOS计数比较(±s)
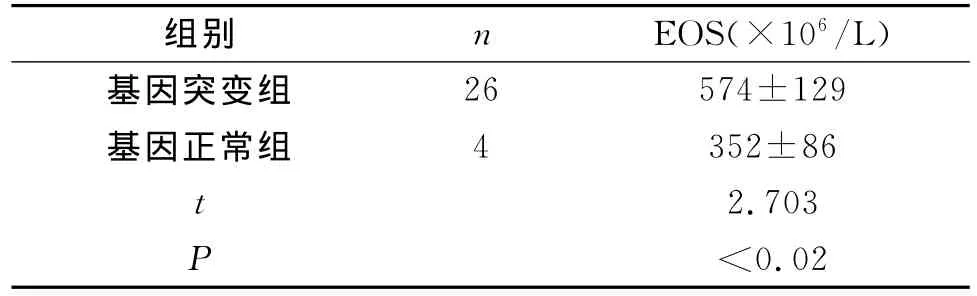
表3 哮喘患儿中基因突变组和基因正常组外周血EOS计数比较(±s)
组别 n EOS(×106/L)26 574±129基因正常组 4 352±86 t 2.703 P<0.02基因突变组
3 讨论
支气管哮喘是临床上最常见的Ⅰ型变态反应性疾病,是由嗜酸性粒细胞、肥大细胞、T细胞、中性粒细胞、巨噬细胞、呼吸道上皮细胞和树突状细胞等多种炎性细胞和细胞组分共同参与的呼吸道慢性炎症性疾病。其关键的效应细胞是T辅助细胞和EOS。
10号染色体上磷酸酶与张力蛋白同源缺失性(PTEN)基因是一个具有双重特异磷酸酶活性的抑癌基因,其定位于10q23.3上,全长200kb,包含9个外显子和8个内含子,编码由403个氨基酸组成的细胞质蛋白[4]。PTEN 基因主要通过PIK3/AKT信号途径的负性调节,对细胞增殖、生长、凋亡、黏附、迁移和血管生长等进行调节[5]。PTEN基因是人类肿瘤中突变率最高的抑癌基因[6]。目前只第9外显子未发现有突变,其中第5及8外显子有较高突变率。第5外显子是编码磷酸酶的功能区,第8外显子是PTEN的稳定性和磷酸酶生物学活性的调节区。
近年研究发现PTEN基因在非肿瘤性疾病中也发挥着重要的作用。韩国学者Yong等首次报道了PTEN在过敏性炎症中的作用,指出PTEN可能通过抑制哮喘模型鼠气道内EOS脱颗粒和活化,降低IL-4、IL-5浓度,从而减轻嗜酸性粒细胞炎症和气道高反应性[2]。有研究发现PTEN基因通过EOS存活和趋化的负向调节在过敏性炎症中发挥重要作用,PTEN可能成为治疗嗜酸粒细胞性疾病的新靶点[7]。也有学者研究提示PTEN的过表达可降低嗜酸细胞阳离子蛋白水平,减轻气道炎症和渗出[8]。目前国内外对于PTEN基因突变与哮喘的相关性研究报道相对较少。
本实验应用DNA测序法对哮喘及健康儿童PTEN基因第5、第8外显子进行检测,结果发现:哮喘组儿童第5、8外显子无突变;第8内含子存在突变,即第32个碱基点突变,T→G,突变率达83.3%(25/30);健康儿童组第5、第8外显子、内含子均无突变。
内含子是非编码蛋白质序列,随着对功能基因的逐步深入研究,越来越多的学者发现内含子在基因表达调控中有着重要的生物学功能,它不仅对基因表达有正调控作用,也存在负调控作用,有的内含子对基因表达有双向调控作用。在真核生物基因中内含子的存在是普遍现象,内含子的长度远远大于外显子的长度,甚至在人类基因组中非编码序列占到95%-97%。目前普遍认为内含子含有增强子或其他顺式作用元件,促进转录的起始或延伸,并增加了mRNA在核内的稳定性,可充当启动子等。内含子在基因表达中具有位置效应和方向依赖性,具有选择剪接功能,内含子在选择剪接过程中可以起标点符号作用来分开外显子,或提供支持选择剪接机制的作用。通过选择性剪接使单一基因产生多种蛋白质,参与基因转录、mRNA运输及翻译等[9]。内含子的嵌入增加了基因在转录过程中多样性的同时也提高了其靠性。最近研究发现内含子突变也会影响基因表达效应,引起表型显著改变。有学者发现雌激素受体α(ESRα)基因的内含子中存在突变,导致其繁殖和生产性状发生改变[10]。胰岛素样生长因子2(IGF2)3号内含子的A3072G的突变与猪生长发育和骨骼构成有关[11]。也有研究发现抑癌基因p53 7号内含子的基因多态性与口腔肿瘤的发病有关[12、13]。随着分子生物学理论及技术的进步,推测在内含子与外显子交界处的内含子突变会导致外显子的缺失或内含子不被剪切,发生在内含子中间的突变则因激活隐形剪切位点影响正常剪切导致疾病发生。
本实验结果哮喘儿童组第8内含子第32个碱基的突变,我们推测实验中发现的PTEN基因第8内含子的单碱基突变,可能通过影响RNA的选择性剪切,使得该基因编码了不同蛋白质,从而改变PTEN基因在哮喘儿童中的表达效应导致哮喘发生。
嗜酸性粒细胞(EOS)是支气管哮喘的主要效应细胞,聚集活化的EOS可以分泌多种炎性物质,引起气道上皮细胞损伤,导致支气管平滑肌收缩,微血管渗漏,黏膜水肿,产生气道高反应和哮喘发作。EOS导致气道阻塞和气道结构的改变,也参与气道炎症反应及气道重塑,还参与抑制气道的免疫反应,EOS在气道粘膜的浸润是哮喘重要的组织病理学特征之一。本实验中哮喘儿童外周血EOS计数明显高于健康儿童,证实了嗜酸粒细胞在哮喘发病中的重要作用。同时本实验中发生PTEN基因突变的哮喘患儿外周血EOS计数较无突变的哮喘患儿高。国外已有多项研究指出PI3K/AKT信号途径是PTEN基因进行负性调节的主要途径[14],PTEN基因可能通过抑制EOS的活化和趋化在哮喘中发挥重要作用[2,7]。也有研究表明在EOS的激活和趋化过程中炎症介质通过PI3K信号转导途径发挥一定作用[15],β受体激动剂可通过PI3K/AKT信号途径调控气道EOS的凋亡。由此我们推测PTEN基因可能通过PI3K/AKT信号途径对EOS进行负性调节,抑制EOS的活化和趋化。由于第8内含子的单碱基突变,改变了PTEN基因的表达,影响了它对EOS的负性调控功能,使得哮喘患儿外周血的EOS数量增多,促发了慢性气道过敏性炎症的发生。
本实验发现PTEN基因在儿童支气管哮喘中存在第8内含子的单碱基突变,它可能通过对EOS的调节在哮喘气道的过敏性炎症中发挥重作用。相信通过后续对哮喘儿童PTEN基因的进一步研究,将为哮喘综合治疗新策略提供更多的可靠依据。
[1]Eisner MD,Anthonisen N,Coultas D,et al.An official American Thoracic Society public policy statement:Novel risk factors and the global burden of chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2010,182(5):693.
[2]Boehmer AL.Paediatric asthma:everything that seemed to be certain no longeris[J].Paediatr Respir Rev,2010,11(3):185.
[3]Yong-Geun Kwak,Chang H.Song,Ho K.Yi,et al.Involvement of PTEN in airway hyperresponsiveness and inflammation in bronchial asthma[J].Clin Invest,2003,111(7):1083.
[4]Steck PA,Pershouse MA,Jasser SA,et al.Identification of a candidate tumour suppressor gene,MMAC1,at chromosome 10q23.3 that is mutated in multiple advanced cancers[J].Nat Genet,1997,15(4):356.
[5]Salmena L,Carracedo A,Pandolfi PP.Tenets of PTEN tumor suppression[J].Cell,2008,133(3):403.
[6]Chu EC,Tarnawski AS.PTEN regulatory functions in tumor suppression and cell biology.Med Sci Monit[J].2004,10(10):RA235.
[7]Tetsuya Adachi,Satoko Hanaka,Tomoko Masuda,et al.Transduction of Phosphatase and Tensin Homolog Deleted on Chromosome 10into Eosinophils Attenuates Survival,Chemotaxis,and Airway Inflammation[J].The Journal of Immunology,2007,179,8105.
[8]Lee KS,Kim SR,Park SJ,et al.Phosphatase and tensin homolog deleted on chromosome 10(PTEN)reduces vascular endothelial growth factor expression in allergen-induced airway inflammation[J].Mol Pharmacol,2006,69(6):1829.
[9]Rubin G M.Comparing Species[J].Nature,2001,409:820.
[10]Joyce B J,Meurs V,Stephanie C E,et al.Association of 5’estrogen receptor alpha gene polymorphisms with bone mineral density,vertebral bone area and fracture risk[J].Human Molecular Genetics,2003,12:1745.
[11]M.Oczkowicz,M.Tyra,K.Walinowicz,et al.Known mutation(A3072G)in intron 3of the IGF2gene is associated with growth and carcass composition in Polish pig breeds[J].Appl Genet,2009,50(3):257.
[12]Li YQ,Li YL,Gu QH,et al.p53gene intron 7polymorphism and its association with oral neoplasms[J].Zhonghua Kou Qiang Yi Xue Za Zhi,2005,40(5):386.
[13]Gu QH,Chen Q,Hu CP,et al.Study on the relationship between the polymorphism of p53gene intron 7and non-small cell lung cancer(NSCLC)and p53mutation in NSCLC tissues[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2007,(24)3:319.
[14]Kentaro Machida,Hiromasa Inoue,Koichiro Matsumoto,et al.Activation of PI3K-Akt pathway mediates antiapoptotic effects ofβ-adrenergic agonist in airway eosinophils[J].Am J Physiol Lung Cell Mol Physiol,2005,288:L860.
[15]Tigani B,Hannon JP,Mazzoni L,et al.Effects of wortmannin on airways inflammation induced by allergen in actively sensitised Brown Norway rats[J].Eur J Pharmacol,2001,433(2-3):217.
