高危型HPV联合TCT检测在宫颈病变Leep术后的应用价值
2013-11-24关嵩青
关嵩青,叶 菲
(深圳市第二人民医院 妇科,广东 深圳518035)
近年来宫颈上皮内瘤样病变(CIN)发病率明显升高,且有年轻化的倾向,目前世界各国学者的多项研究已经证实,高危型人乳头瘤病毒(HR-HPV)的持续感染是CIN和宫颈癌发病的必要条件[1,2]。CIN常用治疗方法有子宫切除术、宫颈锥形切除术、宫颈环形电切术(Leep术)等,其中Leep术已逐渐成为国内外广泛用于治疗CIN的主要手段,成功率高达90%,是最为经济、简便、且对患者损害小的方法[3]。但治疗后可能会有不同程度的病灶残留或复发,因此手术治疗和术后随访同等重要。本研究自2006年以来,对528例CIN患者在Leep术治疗后完成至少1年的正规随访,以探讨HR-HPV联合TCT检测在Leep术治疗CIN后对评判手术效果及术后随访中的价值。
1 资料与方法
1.1 资料来源 2006年1月至2011年8月,在我院妇科门诊就诊患者中,经TCT、阴道镜检查及宫颈活组织病理检查初步诊断为CIN共573例,其中CINⅠ447例,CINⅡ69例,CINⅢ12例,共528例接受Leep手术治疗。患者年龄22-58岁,平均年龄32±8岁;孕次0-10次,平均孕次2次;产次0-5次,平均产次1次;有接触性出血或不规则阴道流血或阴道分泌物增多等病史者226例,占42.80%(226/528),无临床症状者302例,占57.20%(302/528)。
1.2 方法
1.2.1 HR-HPV和TCT检测 所有患者术前均进行宫颈HR-HPV和TCT检查。HR-HPV DNA检测采用HR-HPV DNA核酸扩增荧光检测试剂盒(凯普上海孟德尔基因研究中心),可检测出13种HR-HPV(HPV16、18、31、33、35、39、45、51、21、56、58、59、68)。所有操作均严格按说明书进行。TCT诊断采用TBS分类法(the bethesda system)。
1.2.2 阴道镜检查及宫颈活组织检查 对TCT结果为 ASCUS且 HR-HPV阳性、TCT结果为LSIL或HSIL患者均进行阴道镜检查,采用北京电子阴道镜,由专门的妇科阴道镜医师进行检查操作,对可疑病变区予以宫颈活组织检查或颈管搔刮术,所有病理标本由病理科两名固定的医师阅片,做出最后诊断。
1.3 Leep手术
1.3.1 手术指征 经TCT和阴道镜发现下列情况之一,则进行Leep手术治疗:CINⅠ随访不方便者或持续发现CINⅠ、拟诊CINⅡ或CINⅢ、多次怀疑宫颈非典型鳞状细胞者。
1.3.2 手术经过 征得患者同意,依照手术指征,528例CIN患者进行Leep手术治疗,由壹名固定医师进行手术操作,采用美国伟伦公司生产的QUUAN-M2000型Leep环切刀。术前用2%碘化钾液标志出宫颈病变范围,根据此范围选择不同型号的电切刀,在距碘不着色区外缘3-4mm处开始进刀,采取从下至上或从左至右连续、缓慢、均匀地移动电刀切割宫颈组织,至对侧病缘3-4mm处提出电刀,部分病例再用小号电刀切除部分宫颈管组织,最后电凝止血。切出组织标记后全部送病理检查。
1.4 手术后随访方案 术后1个月第一次复查,所有患者肉眼观察宫颈癒合情况、阴道清洁度检查等;术后3个月复查TCT;术后6个月起每半年复查一次,均进行宫颈HR-HPV和TCT检测,对TCT结果为ASCUS且HR-HPV阳性、TCT结果为LSIL或HSIL患者行阴道镜检查,必要时宫颈多点活组织病理学检查,明确是否为病灶残留或复发病例,必要时再次手术。随访终点是3年或病理结果为≥CINⅠ。
1.5 疗效标准 为方便对照分析,细胞学结果、阴道镜诊断及组织学诊断均统一采用TBS描述语。若Leep术后病理检查结果与宫颈活组织病理检查不一致时,诊断标准以级别较高的病理诊断为最终诊断。病灶残留或病变持续存在:治疗后半年内再发现CIN病变。复发:治疗半年后再发现病变,发现前至少有1次随访TCT结果阴性。治疗失败:指病灶残留和复发;治愈:治疗后的随访过程中未发现CIN病变。
1.6 统计学方法 应用SPSS1110软件包对数据进行处理及统计学分析。
2 结果
2.1 宫颈活检病理与Leep术后病理的关系 528例Leep手术病例,术前宫颈活检病理诊断与术后病理诊断相同的有412例,占78.03%(412/528),术后病理诊断升级有74例,占14.02%(74/528),术后病理诊断下降有42例,占7.95%(42/528)。见表1。
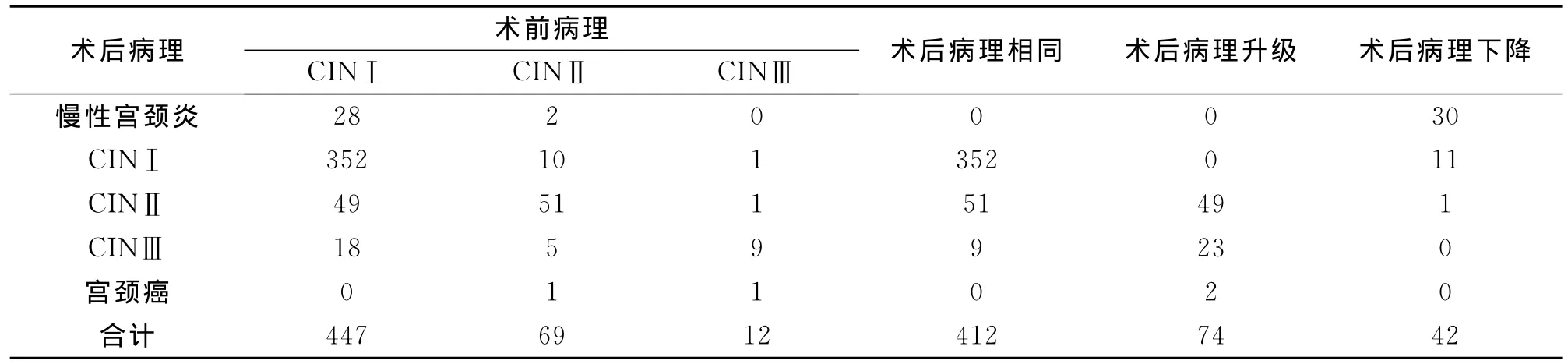
表1 Leep术前术后病理诊断对比(n)
2.2 Leep手术的疗效 共有528例CIN患者进行Leep术后随访,随访时间为12-36个月。其中9例患者(宫颈癌1例、CINⅢ4例、CINⅡ2例、CINⅠ2例)在半年内发现病灶残留,14例患者(宫颈癌1例、CINⅢ和CINⅡ各5例、CINⅠ3例)半年后发现复发,505例患者在随访过程中未发现异常。治疗失败率为4.36%(23/528),治愈率为95.64%(505/528),见表2。
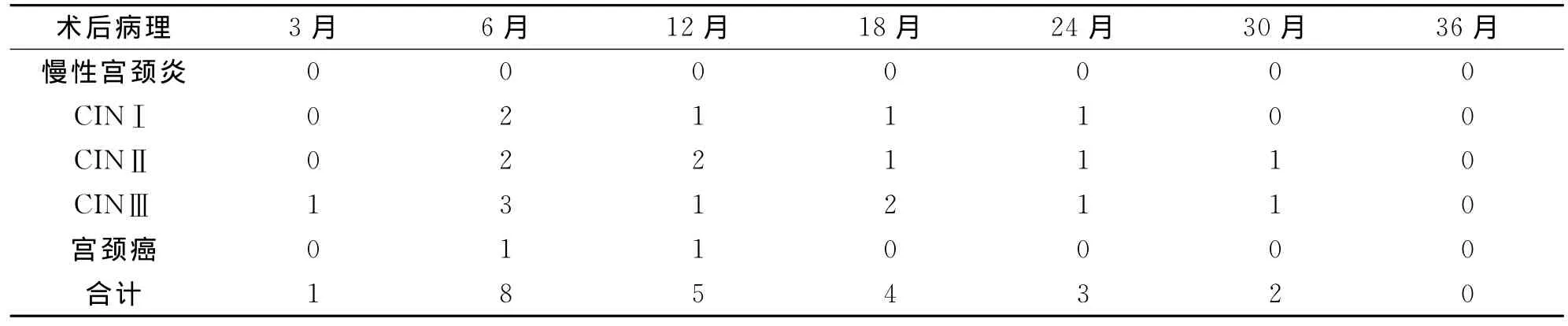
表2 Leep术治疗失败病例随访结果统计(n)
2.3 手术切缘受累与病变持续或复发的关系 507例Leep术后病理诊断手术切缘阴性患者,随访中发现病灶残留≥CINⅠ2例,病变复发≥CINⅠ4例,发生率1.18%(6/507);术后病理诊断手术切缘阳性患者21例,随访中发现病灶残留≥CINⅠ5例,病变复发≥CINⅠ10例,发生率71.42%(15/21),明显高于手术切缘阴性患者,P<0.01。
2.4 宫颈HR-HPV联合TCT检测的随访结果528例患者Leep术后3月、6月、12月、18月、24月、30月和36月进行随访,统计TCT≥ASCUS病例,异 常 率 分 别 为 0.12% (1/528)、2.84% (15/528)、1.33%(7/528)、1.17%(6/528)、0.76%(4/528)、0.38%(2/528)、0%;统计 HR-HPV阳性率分别为0%(未查)、26.89%(142/528)、19.32%(102/528)、12.12%(64/528)、6.06% (32/528)、3.60%(19/528)、2.46%(13/528)。见表3。病变持续或复发的23例患者中 HR-HPV阳性17例,占73.91%(17/23),TCT≥ASCUS 16 例,占 69.57%(16/23);HR-HPV联合TCT双项检测病理诊断符合率为91.30%(21/23)。经统计学处理,两组比较P<0.05,有显著意义。见表3。
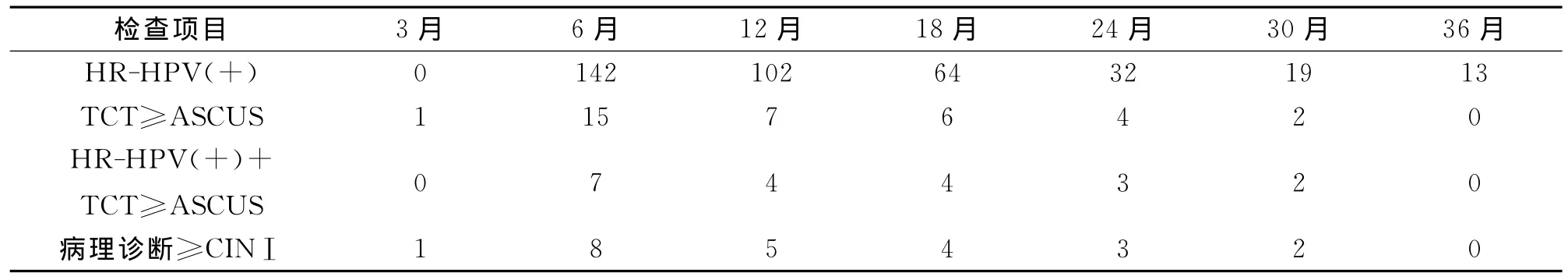
表3 HR-HPV联合TCT检测随访与组织病理诊断的比较(n)
3 讨论
3.1 Leep术是诊断和治疗CIN的有效方法
宫颈上皮内瘤变(CIN)是一组与宫颈浸润癌密切相关的宫颈癌前病变统称,它反映宫颈癌发生发展中的连续过程。近十多年来CIN发病率明显升高,逐渐成为妇科门诊的常见病,发病呈年轻化趋势和上升趋势。据统计,美国每年超过100万人被诊断为CINⅠ,约50万人被诊断为CINⅡ或CINⅢ[4]。1999年世界妇产科协会(society of international gynecology and obstetrics,SIGO)制定的CIN治疗指南及欧洲的CIN治疗指南,均推荐CINⅠ用电凝治疗,CINⅡ用Leep或激光治疗,CINⅢ用Leep或冷刀锥切[5]。近10多年来Leep术在宫颈病变诊断和治疗中的广泛应用,有效阻断了宫颈癌前病变进展为宫颈癌,明显降低了宫颈癌的发病率,缺点是可能会在术中或术后出现出血或感染,术中可能会对局部组织产生热损伤,也有可能是过度治疗。
组织学诊断是宫颈病变诊断的金标准。阴道镜下多点活检能确诊多数CIN及宫颈癌,其优点是对患者的损伤较小,取材较方便,且有组织标本供病理组织学检查,但因多点活检取材无法覆盖全宫颈,钳取组织深度受限,容易造成漏诊。本资料中,528例患者Leep术前阴道镜下定位活检,Leep术后标本病理组织学检查发现,术前宫颈多点活检病理与术后病理相同412例,占78.03%,术后病理升级74例,占14.02%,这可能是因为病变向颈管深处生长,阴道镜下准确诊断颈管内病变受限,或因部分病变组织无明显镜下异常图像导致活检不到位,而Leep术可完整切除转化区组织,并可切除颈管内部分组织减少漏诊[6]。由此可见,Leep术不仅可治疗CIN,还可提高早期宫颈癌的诊断率。笔者认为Leep术的最佳适应证是随访困难的CINⅠ和CINⅡ,若阴道镜检查发现病变延伸或累及到宫颈管内,应能看见病变远端或顶端界限,以减少术后病变残留。
Leep术是采用高频电刀,通过电极尖端的loop金属丝传导高频交流电磁波(3.8MHz)在病灶局部产生瞬时高热,迅速加热局部组织细胞内水分,形成蒸汽波而达到快速切割组织、止血的目的。Leep术比传统冷刀锥切手术时间短、对邻近组织损伤小、简便,治疗和诊断一次进行,在手术祛除病变同时,又能提供标本供组织病理学诊断,近年来已经成为诊断和治疗宫颈癌前病变和早期宫颈癌的重要方法之一,在很大程度上替代了冷刀锥切[7]。文献报道Leep术用于治疗宫颈鳞状上皮内瘤变的成功率为91%-98%[6]。本组资料528例Leep术后随访结果表明总治愈率为97.74%,与文献报道一致。
3.2 宫颈环形电切术(Leep)后随访的必要性和重要性
美国专家委员会制定的CIN治疗指南(2007年)中[4],建议使用Leep术切除宫颈病变部位及鳞-柱上皮交界区治疗CINⅡ和CINⅢ。但有临床数据显示,在Leep术治疗高度CIN后有超过10%的病例出现复发或病灶残留[8]。但临床上复发与病变持续存在常常难以区分,本组资料以Leep术后发现组织学异常的时间为分界点,术后半年内再次发现的组织学异常为病变持续存在,半年后发现则为复发。笔者认为病变持续存在可能是术中只切除了部分而不是全部宫颈病变组织,也可能是术中Leep电极对宫颈组织标本产生一定的热损伤,干扰了病理医生判断,可能会导致病检结果假阴性。Mirosh-nichenko等[9]总结资料显示,Leep术与冷刀锥切相比较,前者切除标本病检结果的可信度低,切缘阳性率高,更重要的是即使切缘阴性的病例仍有病变持续存在的可能,特别是宫颈高度病变患者。因此手术标本病检为多发病灶、切缘有高级别CIN或累及腺体或可作为预测残留或复发的指标。
本研究在528例Leep术后随访中发现,9例病灶残留,14例复发,治疗失败率达4.36%。Soutter等[10]汇总了2216例分别在英国4个医学中心的宫颈CIN Leep术后患者8年的随访资料,进展为宫颈浸润癌有33例,数据还显示CIN患者Leep术治疗后的宫颈癌发病率仍比同时期正常女性大约高5倍,因此建议在Leep术治疗宫颈CIN后应规范随访10年以上。所以本研究旨在探索一个适合CIN Leep术后患者的能及时监测复发的长期随访模式。
3.3 CIN Leep术后HR-HPV联合TCT检测的临床应用价值
美国专家委员会制定的CIN治疗指南[4]中推荐的CIN Leep术后随访方案:每间隔4-6个月进行TCT检测(≥ASCUS为异常),治疗后6个月起还应进行HR-HPV检测。本组资料的随访方案遵循此治疗指南。有临床资料显示,Leep术后仅用TCT检测并不能筛查出CIN全部病例,随访中联合阴道镜检查可明显提高CIN的检出率[11]。但是我们认为由于Leep术后部分患者的宫颈鳞-柱状上皮转化区可能会退至宫颈管内,导致反复阴道镜检查没有满意结果,影响随访质量。
Alonso等[12]数据显示,经过随访203例CIN II-IIILeep术后患者,病灶残留或复发的发病率与HR-HPV滴度呈正比例关系。提示HR-HPV持续性感染不仅与CIN的发生有关,而且与CIN Leep术后病灶残留或复发有关,是CIN Leep术治疗后复发的多种高危因素之一。目前多项临床数据[13-14]已证实了在CIN患者Leep术后随访中HR-HPV检测的应用价值,所以我们认为可以将HR-HPV检测作为随访的手段之一。本研究发现,治疗失败的18例高度CIN患者随访中HR-HPV检测均为阳性,证实了持续HR-HPV感染是CIN治疗失败的高危因素。本文结果也可以看到,全部病例Leep术后3个月TCT检查,术后6个月起HR-HPV+TCT检测,结果显示TCT单项阳性的病理符合率为69.57%;HR-HPV单项阳性的病理符合率为73.91%,而HR-HPV+TCT双项检测的病理符合率为91.30%,提示HR-HPV联合TCT检测对于预测病变残留或复发有重要价值。
令人遗憾的是目前对持续性HR-HPV感染尚无明确有效的治疗方法,因此对该类患者应适当增加随访次数、延长随访时间,有选择性对随访过程中出现TCT异常、HR-HPV阳性患者进行阴道镜检查,必要时宫颈定位、多点病理检查或颈管搔刮,以防遗漏复发病例,对随访中TCT和HR-HPV检测同时阴性的妇女则可以适当延长随访间隔。
通过上述分析我们认为将细胞学异常结果ASCUS作为阳性阈值,联合HR-HPV检查是适合我国国情的有效的CIN Leep术治疗后的长期随访手段,既可以及时了解宫颈病变Leep术后患者病情的进展和转归,还可节约患者医疗费用,节约国家医疗资源。
[1]Burd EM.Human papillomavirus and Cervical cancer[J].Clin Micro Rev,2003,16(1):1.
[2]Bekkers BL,Massuger LF,Bumen J,et al.Epidemiological and clinical aspects of human papillomavirus detection in the prevention of cervical cancer[J].Rev Med Virol,2004,14(2):95.
[3]Giacalone PL,Laffargue F,AligierN,et a.l Randomized study comparing two techniques of conization:cold knife versus loop excision[J].Gynecol Onco,l 1999,75:356.
[4]Wright T C Jr,Massad L S,Dunton C J,et al.2006consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ[J].Am J Obstet Gynecol,2007,197:340.
[5]Di-Roma E,Parlavecchio E,VettrainoG,et a.l CIN:multicentric study of therapeutic strategies[J].Minerva Gineco,l 2001,53:379.
[6]戴丽玉,郑锦文.宫颈环形电切术阻断宫颈癌的临床研究[J].海峡预防医学杂志,2004,10(1):15.
[7]樊庆泊,Tay Sun Kuit,沈铿.子宫颈环形电切术在子宫颈上皮内瘤变治疗中的价值[J].中华妇产科杂志,2001,36:271.
[8]Tillmanns T D,Falkner C A,Engle D B,et al.Preoperative predictors of positive margins after loop electrosurgical excisional procedure-Cone[J].Gynecol Oncol,2006,100:379.
[9]MiroshnichenkoGG,ParvaM,Holtz DO,et a.l Interpret-ability of excisional biopsies of the cervix:cone biopsy and loop excision[J].J Low GenitTractDis,2009,13:10.
[10]Soutter W P,de Barros Lopes A,Fletcher A,et al.Invasive cervical cancer after conservative therapy for cervical intraepithelial neoplasia[J].Lancet,1997,349:978.
[11]Ayhan A,Boynukalin F K,Guven S,et al.Repeat LEEP conization in patients with cervical intraepithelial neoplasia grade 3and positive ectocervical margins[J].Int J GynaecolObstet,2009,105:14.
[12]Alonso I,Tome A,Puig-Tintore LM.Pre-and post-conization high-risk HPV testing predicts residual/recurrent disease in patients treated for CIN2-3[J].Cancer Epiderniol Biomarkers Prev,2005,14(11):2544.
[13]Kreimer A R,Guido R S,Solomon D,et al.Human papillomavirus testing following loop electrosurgical excision procedure identifies women at risk for posttreatment cervical intraepithelial neoplasia grade 2or 3disease[J].Cancer Epidemiol Biomarkers Prev,2006,15:908.
[14]申 艳.宫颈上皮内瘤变LEEP术后检测HPV评价疗效的临床应用探讨[J].实用妇产科杂志,2007,23:513.
