革兰阴性杆菌产β-内酰胺酶及其耐药分子机制的研究
2013-11-24冯体玉徐韫健
冯体玉,徐韫健,李 宁,余 琳
(1.梅州市人民医院 检验科,广东 梅州514031;2.广州医学院第一附属医院 检验科,广东 广州510120)
青霉素和头孢菌素等β-内酰胺类抗菌药物在长期使用中,细菌逐渐对其产生抗药性。β-内酰胺酶的产生是革兰阴性杆菌对该类抗菌药物耐药的主要机制之一,临床上的β-内酰胺酶主要是ESBLs、AmpC酶和MBL。目前,β-内酰胺酶的传播机制仍不是很明确,质粒携带的β-内酰胺酶耐药基因在质粒间及质粒与染色体间转移可能是通过转座子或插入序列为工具实现的[1]。本文对173株革兰阴性杆菌进行可疑产酶株筛选,鉴定其基因型,并对β-内酰胺酶周围的“基因环境”进行了分析,进而对基因元件整合子、转座子、插入序列与革兰阴性杆菌耐药的关系进行探讨。
1 材料与方法
1.1 菌株 2010年4月-2010年12月,梅州市人民医院和广州医学院第一附属医院检验科分离的173株(无重复)革兰阴性杆菌,大肠埃希菌38株,肺炎克雷伯菌32株,鲍曼不动杆菌30株,铜绿假单胞菌27株,阴沟肠杆菌20株,洋葱假单胞菌10株,弗劳地枸橼酸杆菌8株,摩根摩根菌8株。质控菌株:大肠埃希菌 ATCC25922、肺炎克雷伯菌ATCC700603和铜绿假单胞菌ATCC27853均购自卫生部药品鉴定所。
1.2 主要试剂与仪器 K-B法药敏纸片购自英国OXID公司,Taq酶、dNTPs、DL2000标志物均购自日本 TaKaRa公 司,VITEK-2GNP药敏卡和VITEK-2全自动微生物鉴定仪购自法国生物梅里埃公司,PCR扩增仪购自美国Bio-Rad公司,超声细胞粉碎仪购自宁波新芝公司,超高离心机购自美国Beckman公司。
1.3 PCR引物 均由上海英俊生物公司合成,根据文献设计如表1。

表1 PCR引物序列表
1.4 细菌药敏实验 药敏试验用K-B药敏试验和VITEK-2GNP药敏卡进行,结果判定按照美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)2010制定的规则及标准进行[2]。
1.5 三维试验 将大肠埃希菌标准菌株ATCC25922按K-B法涂布在MH平板上。在平板的中央贴一张头孢西丁纸片,从距离纸片5mm处用无菌刀片在平板的琼脂上向外切一裂隙。每一裂隙中加入30μl的一种待测菌株的β-内酰胺酶粗提物。35℃培养24h,观察裂隙的内测端(头孢西丁纸片的抑菌环内)周围有无细菌生长。判断标准:裂隙的内测端周围有细菌生长、导致头孢西丁纸片的抑菌环有缺失者为阳性。
1.6 ESBLs表型检测 按2010年CLSI推荐的纸片扩散法ESBLs实验指南进行,以肺炎克雷伯菌ATCC700603为质控菌株跟随试验。初筛法:0.5麦氏浊度菌液均匀涂抹于MH平板,贴上纸片头孢他啶、头孢曲松、头孢噻肟、氨曲南,于35℃温箱中放置18-24h后观察结果。当受试菌对头孢他啶(30μg/片)纸片的抑菌环直径≤22mm、氨曲南(30 μg/片)纸片的抑菌环直径≤27mm、头孢噻肟 (30 μg/片)纸片的抑菌环直径 ≤27mm或头孢曲松(30 μg/片)纸片的抑菌环直径≤25mm,只要有一种可视为疑产ESBLs菌株。
确证法:对初筛阳性菌株,采用头孢他啶(30 μg/片)、头孢他啶/克拉维酸(30μg/10μg/片)、头孢噻肟(30μg/片)、头孢噻肟/克拉维酸(30μg/10 μg/片)检测,一对纸片间相距2 5mm,于35℃温箱中放置18-24h后观察结果。任一组药物的抑菌环直径相差≥5mm,判定为ESBLs阳性菌株。
1.7 纸片协同试验检测金属酶 0.5麦氏单位待测菌菌液均匀涂布MH琼脂平板,中间贴10μg亚胺培南和30μg头孢他啶纸片,距纸片1.5-2.5cm处贴一空白纸片,加2-3μl 2-巯基乙醇原液。35℃培养过夜,如靠近2-巯基乙醇侧亚胺培南和头孢他啶抑菌环有扩大者为产金属酶菌株。
1.8 PCR扩增目的基因 用加热裂解法制备DNA模板。反应体系总体积20μl,其中正反引物各1μl,10×PCR缓冲液2μl,dNTP及Taq酶各1 μl,DNA模板2μl。反应条件为除退火温度不同外,95℃预变性3min,95℃30s,56℃35s,72℃45s,30个循环,72℃延伸10min。扩增产物送上海英俊生物公司测序,结果在GenBank中经BLAST分析以确定其基因型别。
1.9 统计学处理 采用 WHONET5.0软件进行统计分析革兰阴性杆菌的耐药率。
2 结果
2.1 β-内酰胺酶表型检出率 革兰阴性杆菌β-内酰胺酶的总检出率为24.28%(42/173),主要由单产ESBLs引起,检出率为13.29%;其次为产ESBLs+AmpC引起,检出率为6.36%,见表2。
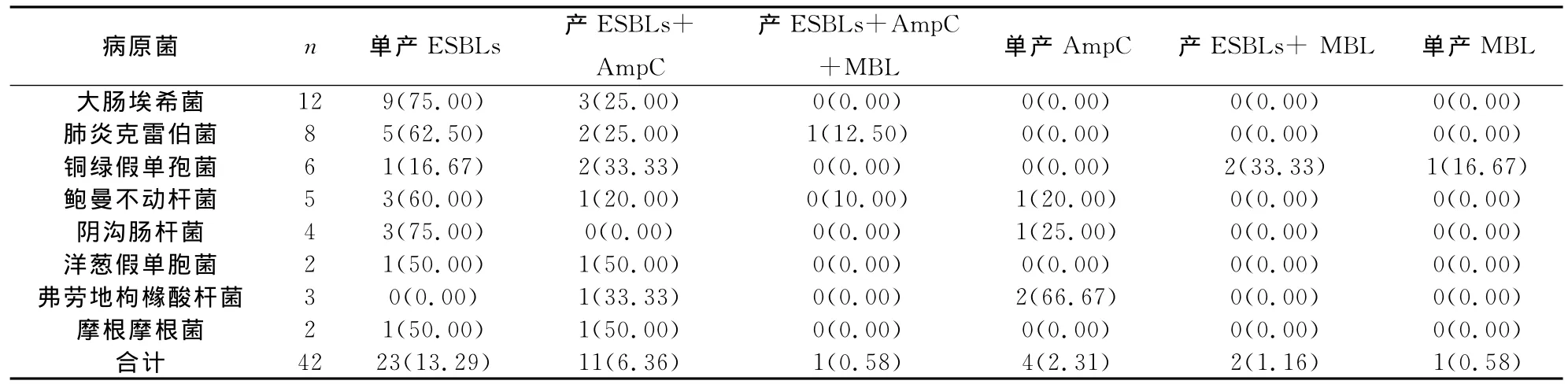
表2 42株革兰阴性杆菌株产β-内酰胺酶表型检出率(%)
2.2 β-内酰胺酶基因型检出率 革兰阴性杆菌β-内酰胺酶基因的总检出率为24.86%(43/173),TEM、SHV、CTX-M-G1、PSE、ACT-1、DHA-1、CMY及IMP-1总阳性率在临床分离的革兰阴性杆菌中分别为:24.86%、8.09%、11.56%、1.16%、2.89%、5.20%、4.62%及0.58%。大肠埃希菌、肺炎克雷伯菌、铜绿假单孢菌、鲍曼不动杆菌、阴沟肠杆菌、洋葱假单胞菌、弗劳地枸橼酸杆菌、摩根摩根菌都携带5-7种β-内酰胺酶基因,见表3。

表3 β-内酰胺酶在革兰阴性菌属中基因型的分布
2.3 基因元件在革兰氏阴性菌属中的分布 整合子、插入序列ISEcp1B和转座子tnpU在173株革兰氏阴性菌属中检出率分别为28.32%,16.76%,16.18%,在各菌属中的分布见表4,基因元件阳性的菌株大多数β-内酰胺酶表型为阳性。
2.4 β-内酰胺酶阳性与阴性菌株药敏结果比较从173株革兰阴性杆菌药敏结果中,42株β-内酰胺酶阳性菌株对氨苄西林、头孢曲松、头孢唑啉均耐药;对丁胺卡那霉素、亚胺培南敏感率最高,见表5。42株β-内酰胺酶阳性菌株对抗生素的耐药性显著高于阴性菌株,P<0.05。

表4 基因元件在革兰阴性菌属中的分布(株)

表5 β-内酰胺酶阳性和阴性菌株对15种抗菌药物敏感率的比较
3 讨论
临床上ESBLs、AmpC酶最为常见,这与本研究表2中β-内酰胺酶表型和表3中β-内酰胺酶基因分型结果相符。产β-内酰胺酶多重耐药革兰阴性杆菌基因的总检出率为24.86%,略低于表型试验24.28%,其中有3株菌检出β-内酰胺酶基因,但表型为阴性;有2株菌的β-内酰胺酶表型为阳性,但实验所检的基因都为阴性。可能是设计引物不能测出菌株携带的基因型,或者菌株虽携带基因但不表达β-内酰胺酶。研究结果显示,所分离出的革兰阴性杆菌中,产β-内酰胺酶最常见的菌种是大肠埃希菌、肺炎克雷伯菌、铜绿假单孢菌及鲍曼不动杆菌。其他革兰阴性杆菌如阴沟肠杆菌、洋葱假单胞菌、弗劳地枸橼酸杆菌、摩根摩根菌也检出β-内酰胺酶,说明携带β-内酰胺酶耐药的基因在不同种类的菌属中进行了广泛转移。本研究中的产β-内酰胺酶的菌株对许多β-内酰胺类的抗菌药物以及其他抗菌药物呈多重耐药,给临床抗感染构成严重威胁,其中对氨苄西林、头孢曲松、头孢唑啉均耐药,对丁胺卡那霉素、亚胺培南敏感率最高,对抗生素的耐药性显著高于不产酶菌株。
近年来通过对β-内酰胺酶周围的“基因环境”进行研究发现:质粒携带的β-内酰胺酶耐药基因在质粒间及质粒与染色体间转移主要是通过转座子或插入序列为工具实现的。质粒通过接合作用、整合子通过整合酶俘获耐药基因,通过共用的启动子进行表达的研究已有大量的报道[3,4]。本研究中基因元件阳性的菌株大多数β-内酰胺酶表型为阳性,大量文献也报道基因元件可介导病原菌各种耐药基因[5],获得基因元件的病原菌可表现为多重耐药。这也是本研究中的产β-内酰胺酶的菌株对抗生素的耐药性显著高于不产酶菌株的另一个原因。整合子是可移动的基因元件,可携带多种内酰胺酶和氨基糖苷类修饰酶基因,在同种和不同种细菌中进行基因的水平转移,从而使细菌的耐药性得以快速传播。本研究检测的是Ⅰ类整合子,在大多数革兰阴性杆菌中均可检出,与文献报道的有所不同[6],这可能与研究的菌株数量和种属不同有关。插入序列ISEcp1B长度1,655bp,其转座酶能够识别反向重复序列,并催化转座因子发生删除作用。文献报道[7,8]在CTX-M基因的侧翼发现有插入序列ISEcplB,参与耐药基因从染色体到质粒的播散。本研究对ISEcp1BPCR产物进行测序,发现大部分ISEcp1B的右端均连接一个反向重复序列,为转位酶提供作用位点,下游均连接CTX-M型ESBLs基因,为其水平转移提供作用识别位点;并提供-35及-10两个启动子,对下游CTX-M型ESBLs的高水平表达和传播起重要的调控作用。转座子是指能将自身插入基因组中一个在序列上无关的新位点的DNA序列,位于β-内酰胺酶基因的两侧,很容易携带着抗生素抗性基因从细菌染色体转移到质粒或噬菌体基因组上,使细菌基因具有重组和重排的潜力。本研究的革兰阴性菌其tnpU基因阳性检出率为16.18%,较其它文献报道率低[9,10]。可能是由于感染菌株及细菌的耐药特性各不相同有关。转座子tnpU基因在大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌中均有检出,在非发酵菌中的检出率相对较高。基因元件整合子、插入序列和转座子基因元件广泛分布于革兰阴性杆菌中,其俘获及启动β-内酰胺酶表达的能力,可能在多重耐药机制中起重要作用。
[1]Marie-F L,Laurent P,Daniel A,et al.In Vitro Analysis of ISEcp1B-mediated Mobilization of Naturally Occurring Lactamase Gene blaCTX-M ofKluyveraascorbata.Antimicroblal A-gents and Chemotherapy[J].2006,50(4):1282.
[2]Clinical and Laboratory Standards Institute.Performance standards for antmicrobial susceptibility testing;twentieth informational supplement M100-S20.Clinical and Laboratory Standards Institute,2010.
[3]张永标,张扣兴,唐英春,等.产质粒介导的AmpC酶和ESBLs细菌的耐药性及β-内酰胺酶基因型研究[J].中华微生物学和免疫学杂志,2004,24(7):577.
[4]李心晖,石 垒,杨维青,等.三类整合酶基因(intI)的简并引物PCR方法建立及应用[J].中国微生物学和免疫学杂志,2005,25(2):156.
[5]糜祖煌,秦 玲.多药耐药鲍氏不动杆菌5类抗菌药物耐药机制研究[J].中华医院感染学杂志,2008,18(7):901.
[6]Flutt AG,Schmitz FJ.Resistance integrons and super-integrons[J].Clin Microbiol Infect,2004,10(4):272.
[7]Ho PL,Shek RH,Chow KH,et al.Detection and characterization of extended-spectrum beta-lactamases among bloodstream isolates of Enterobacter spp.in Hong Kong,2000-2002[J].J Antimicrob Chemother.2005,55(3):326-332.
[8]Marie-F L,Laurent P,DanieA,et al.In Vitro Analysis of ISEcp1B-Mediated Mobilization of Naturally Occurring -Lactamase Gene blaCTX-M ofKluyveraascorbata[J].Antimicroblal Agents and Chemotherapy,2006,50(40):1282.
[9]林 宁,孙海平.多药耐药大肠埃希菌整合子、转座子遗传标志研究[J].中华医院感染学杂志,2008,18(10):1361.
[10]朱健铭,王建敏,姜如金,等.鲍曼不动杆菌多重耐药及转座子Tn1548携带频率的研究[J].中国人兽共患病学报,2009,25(1):95.
