急性脑梗死患者颈动脉斑块稳定性与血浆IL-18、MMP-9的相关性研究
2013-11-23毕显梅王永久刘坤于敦波李云龙
毕显梅 王永久 刘坤 于敦波 李云龙
动脉粥样硬化(atherosclerosis,As)是一种慢性炎症性疾病,在这一病变过程中,免疫调节起着至关重要的作用[1]。越来越多的证据表明,白细胞介素-18(IL-18)、基质金属蛋白酶-9(MMP-9)等炎性因子参与了As形成的病理过程,包括粥样斑块的形成、破裂。不稳定性颈As斑块破裂、继发血栓形成是缺血性脑卒中的主要机制[2]。本研究旨在探讨急性脑梗死(acute cerebral infarction,ACI)患者颈As斑块稳定性程度与血清炎性指标IL-18、MMP-9水平的关系。
1 对象和方法
1.1 观察对象 选取2010-10-2012-03在作者医院神经内科住院的ACI患者200例,其中男122例、女78例,年龄33~87岁,平均(68±10)岁。患者均符合1995年全国第四届脑血管病学术会议修订的脑梗死诊断标准[3],均于发病5d内经头部CT或MRI确诊,并排除腔隙性梗死。本组患者均无明显的肝、肾或心功能衰竭,无肿瘤、外科手术、风湿性疾病、狼疮等免疫病史及全身感染史。另选择80名健康体检者为对照组,男49名、女31名,年龄34~85岁,平均(52±8)岁,均行彩色多普勒超声检查排除有颈动脉斑块。
1.2 方法 所有ACI患者和健康对照均经详细的神经系统检查,血压,血脂、血糖、肝肾功能、血常规及纤维蛋白原(Fbg)、血清IL-18、MMP-9水平等检测,以及颈动脉超声检查。记录患者是否有高血压、糖尿病、冠心病史及吸烟史。
1.2.1 标本采集:患者均在入院后48h内常规采空腹静脉血查血脂、血糖、肝肾功能、血常规、Fbg,同时采空腹静脉血5mL,以3000转/min离心10 min后分离血清,置于-20℃冰箱内保存。血清IL-18、MMP-9水平的测定采用双抗体一步夹心酶联免疫吸附法(ELISA),ELISA试剂盒均购自美国R&D公司,严格按试剂说明检测。对照组均经本人同意抽取空腹静脉血做相同处理。
1.2.2 颈动脉检查:颈动脉超声检查采用PHILIPS iu22型彩色多普勒超声诊断仪,周围血管探头频率为5~l5Hz。受检者取平卧位,头部偏向检查区对侧,分别测量颈总动脉内径(分叉近2.0cm处)及颈内动脉、颈外动脉内径(分叉远1.0cm处)及颈动脉内膜-中膜厚度(intima-media thickness,IMT)。将IMT≥1.2mm定义为斑块,IMT<1.2 mm为非斑块组。根据超声特点颈动脉斑块的病理学分型分为扁平斑块、软斑块、硬斑块及溃疡斑块四型;软斑块及溃疡斑块易于损伤、破裂脱落,定义为不稳定性斑块,扁平斑块及硬斑块不易发生破裂,定义为稳定性斑块[4]。详细记录所有患者颈部动脉斑块类型及数量,并根据超声结果将患者分为斑块组和非斑块组,其中斑块组又分为不稳定性斑块组及稳定性斑块组两个亚组。
1.2.3 相关性分析:斑块稳定性程度用斑块稳定性级别体现,将稳定斑块、不稳定斑块的斑块稳定性级别分别定义为1级和2级,分析ACI患者血清IL-18水平、MMP-9水平与颈动脉斑块稳定性级别的相关性。
1.3 统计学处理 采用SPSS 11.5统计软件进行分析。计量资料(年龄、血脂、Fbg、IL-18及 MMP-9水平)以表示,组间两两比较采用成组t检验;计数资料(高血压、糖尿病、冠心病及吸烟者的例数)组间比较采用卡方检验;血清IL-18水平、MMP-9水平与颈动脉斑块稳定性级别的相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 颈动脉超声检查 200例ACI患者中,检测出颈As斑块139例(69.5%),其中发现1个或多个不稳定性斑块者96例,稳定性斑块者43例。139例中,双侧颈动脉均有斑块84例,斑块发生于颈总动脉分叉处和颈内动脉起始段20cm范围内109例,颈动脉狭窄60%以上23例。
2.2 各组脑梗死危险因素比较 ACI患者颈动脉斑块组年龄及总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平明显高于非斑块组(P<0.01),伴有高血压(71.2%)及糖尿病的患者比例(46.8%)高于非斑块组(分别为54.1%、29.5%,均P<0.05),吸烟、患冠心病的比例及三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、Fbg水平等危险因素两组间比较差异无统计学意义(均P>0.05);ACI患者斑块组年龄,TC、TG、LDL-C水平及伴有高血压、冠心病、糖尿病比例比对照组升高(均P<0.05);非斑块组仅 TC、LDL-C水平及伴有高血压、冠心病比例高于对照组(均P<0.05)(表1)。
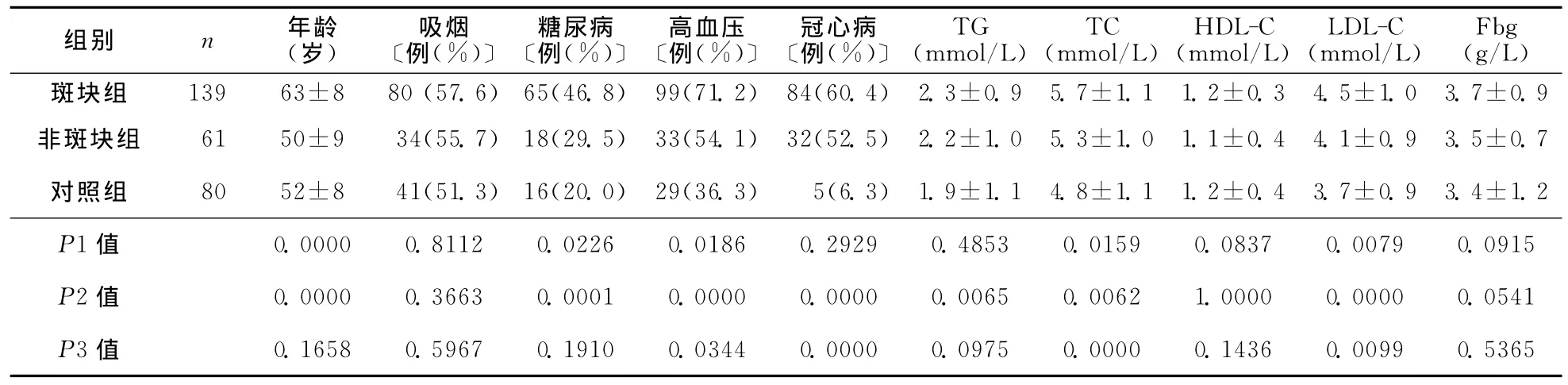
表1 各组脑梗死危险因素比较
2.3 血清IL-18、MMP-9水平比较 ACI患者血清IL-18、MMP-9水平颈动脉不稳定性斑块组明显高于稳定性斑块组(P<0.01);稳定斑块组明显高于非斑块组(P<0.01);稳定斑块组明显高于对照组(P<0.01);非斑块组与健康对照组比较血清IL-18、MMP-9水平差异无统计学意义(P>0.05)(表2)。
表2 各组血清IL-18、MMP-9水平比较 ()

表2 各组血清IL-18、MMP-9水平比较 ()
注:P1、t1值:不稳定斑块组与稳定斑块组比较;P2、t2值:稳定斑块组与非斑块组比较;P3、t3值:非斑块组与对照组比较;P4、t4值:稳定斑块组与对照组比较
组别 n IL-18(pg/mL) MMP-9(μg/L)不稳定斑块组96230.56±41.79 90.97±30.08稳定斑块组 43209.87±38.67 66.81±28.67非斑块组 61171.48±22.51 47.54±29.03对照组 80167.42±26.47 39.92±25.99 P1值(t1值) 0.0066(2.7595) 0.0000(4.4416)P2值(t2值) 0.0000(5.8488) 0.0011(3.3507)P3值(t3值) 0.3379(0.9616) 0.1034(1.6394)P4值(t4值) 0.0000(6.4337) 0.0000(5.2766)
2.4 血清IL-18、MMP-9水平与颈动脉斑块稳定性级别的相关性分析 ACI患者血清IL-18水平、MMP-9水平均与颈动脉斑块的稳定性级别相关(r=0.4531,P=0.0000;r=0.4588,P=0.0000)。
3 讨论
颈动脉As是缺血性脑卒中的重要危险因素。既往认为缺血性脑卒中发生的主要原因是As斑块引起局部管腔狭窄继而导致脑血栓形成。近年研究发现,导致急性心脑血管病事件的主要原因是As斑块破裂和局部血栓形成,后者取决于斑块的易损性。因此寻找能反映As斑块易损性的循环标志物对于脑血管疾病的防治具有重要意义。最近国内外研究发现颈As斑块的发生、去稳定、破裂与 IL-18、MMP-9 等 炎 性 因 子 水 平 密 切 相关[5-6]。IMT增厚是 As的早期指征,IMT 与IL-18的关系是近年来心脑血管病领域一个热门的研究课题。IL-18主要由活化的巨噬细胞产生,无病动脉组织中因没有巨噬细胞存在而不含IL-18。既往研究表明,IL-18具有促进As形成的作用,可导致As斑块增大,还可以控制斑块内单核细胞/巨噬细胞的聚集和死亡,是斑块破裂和血栓形成的重要因素[5]。本研究发现,ACI患者血清IL-18水平在颈动脉不稳定斑块组高于稳定斑块组(P<0.01),在稳定斑块组高于非斑块组(P<0.01),而ACI患者非斑块组与健康对照组比较IL-18水平差异没有统计学意义(P>0.05);相关分析结果显示外周血IL-18水平与颈动脉斑块的稳定性级别相关(r=0.4531,P=0.0000)。这提示血清IL-18水平越高,颈动脉斑块稳定性程度可能越差,与李薇等[7]、张 苑 等[8]的 研 究 结 果 类 似。 综 上,IL-18可能是预示As斑块稳定性的一种新的标志物。
细胞外基质降解是斑块不稳定的主要原因之一。基质金属蛋白酶家族(MMPs)是一组锌离子依赖性蛋白酶,其中与As关系密切的是MMP-1、MMP-2和 MMP-9。MMP-9主要由巨噬/泡沫细胞和T淋巴细胞以前酶原形式分泌,激活后变成活性酶降解胶原、弹性蛋白等。MMP-9主要位于大量巨噬细胞浸润的粥样斑块肩部,能破坏粥样斑块纤维帽完整性,导致斑块易于破裂[9],进而启动血栓形成过程。本研究结果显示,ACI患者血清MMP-9水平在颈动脉不稳定斑块组明显高于稳定斑块组(P<0.01),稳定斑块组明显高于非斑块组,ACI患者非斑块组MMP-9水平与健康对照组比较差异无统计学意义(P>0.05);相关分析显示外周血MMP-9水平与颈动脉斑块稳定性级别相关。这提示血清MMP-9水平越高,颈动脉斑块稳定性程度可能就越差,与成勇等[10]、薛飞等[11]的研究结果类似。一项回顾性分析表明血清 MMP-9水平在中风发作后明显升高,并且MMP-9水平与脑梗死体积、严重程度相关[12]。丁士芳等[13]的研究提示 MMP-9在颈动脉粥样斑块破裂导致的ACI中发挥作用,颈动脉粥样斑块稳定性与ACI有关。Fisher等[2]报道颈动脉斑块破裂,栓子脱落造成的栓塞是脑卒中的主要机制。因此,推断血清MMP-9水平在脑卒中发作后明显升高有可能为斑块破裂所引发。
本研究结果显示ACI患者血清IL-18与MMP-9水平与颈动脉As斑块的不稳定性有一定相关性。血清IL-18与 MMP-9水平升高对颈动脉斑块的易损或破裂可能有一定提示作用,有可能为缺血性脑血管病的早期干预提供依据。目前针对颈动脉斑块稳定性的影像学检测方法无论是有创(血管内镜)还是无创(彩色多普勒超声、MRI)的,都有一定局限性。因此,需要更多的临床对照研究来验证这些方法对斑块稳定性诊断的敏感性。同时,为进一步排除ACI本身对血清炎性因子的影响,今后应选择未导致ACI的短暂性脑缺血发作患者进一步研究颈动脉As斑块稳定性与血浆IL-18、MMP-9水平的相关性。
[1]Hansson GK,Robertson AK,Söderberg-Nauclér C.Inflam-mation and atherosclerosis[J].Annu Rev Pathol,2006,1:297-329.
[2]Fisher M,Paganini-Hill A,Martin A,et al.Carotid plaque pathology:thrombosis,ulceration,and stroke pathogenesis[J].Stoke,2005,36:253-257.
[3]中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29:379-380.
[4]王新房,李治安.彩色多普勒诊断学[M].北京:人民卫生出版社,1991.224.
[5]Mallat Z,Corbaz A,Scoazec A,et a1.Expression of interleukin-18in human atherosclerotic plaques and relation to plaque instability[J].Circulation,2001,104:1598-1603.
[6]韩轶鹏,王大明,刘加春.血清炎性标志物水平与颈动脉斑块稳定性的相关研究[J].中华外科杂志,2012,50:70-73.
[7]李薇,杨全玉,李时光.急性脑梗死患者血清白介素-18水平与颈动脉斑块的关系[J].神经损伤与功能重建,2011,6:184-186.
[8]张苑,刘其强.炎性因子与颈动脉硬化斑块稳定性的相关性研究[J].实用心脑肺血管病杂志,2012,20981-982.
[9]Johnson J L.Matrix metalloproteinases:influence on smooth muscle cells and atherosclerotic plaque stability[J].Expert Rev Cardiovasc Ther,2007,5:265-282.
[10]成勇,李朝武,涂明义.颈动脉斑块类型与 MMP-9的相关性研究[J].第三军医大学学报,2007,29:1812-1814.
[11]薛飞,袁新建,杨秀平.MMP-9、TMP-1与颈动脉粥样硬化斑块稳定性的研究[J].中国老年医学杂志,2008,28:992-994.
[12]Ramos-Fernandez M,Bellolio MF,Stead LG.Matrix metalloproteinase-9as a marker for acute ischemic stroke:a systematic review[J].J Stroke Cerebrovasc Dis,2011,20:47-54.
[13]丁士芳,张运,张梅.颈动脉粥样斑块稳定性与急性脑梗死发病机制关系的临床研究[J].中华超声影像学杂志,2006,15:597-600.
