人原代肥大细胞体外诱导和组织分离方法的建立
2013-11-22翟荣荣蒋金凤张济丁永斌王建华魏继福
翟荣荣,蒋金凤,张济,丁永斌,王建华,魏继福
(1.南京医科大学第一附属医院药学部研究室,江苏 南京210029;2.中国科学院上海巴斯德研究所病毒免疫学实验室,上海200025;3.南京医科大学第一附属医院普外科,江苏南京210029)
肥大细胞是定位于组织的一类胞质内富含嗜碱性颗粒的细胞[1],与哮喘、变态反应等疾病的发生密切相关。近年来,肥大细胞在调节机体免疫、防御病原微生物入侵等方面的作用正在引起人们的关注。目前主要采用HMC-1,一种从肥大细胞淋巴瘤(mast cell leukaemia)患者中分离转化的细胞系研究肥大细胞。HMC-1与机体生理条件下肥大细胞的差异,限制了对肥大细胞功能的深入研究。鉴于此,我们建立了两种人原代肥大细胞的体外诱导培养和分离方法,两法均可获得纯度较高、状态良好的肥大细胞,可适用于肥大细胞在免疫调节和病原防御中作用的后续研究。
1 材料和方法
1.1 材料
1.1.1 细胞和组织 健康人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)购于上海市血液中心;直肠和(或)结肠组织由南京医科大学第一附属医院普外科提供。患者签署知情同意书,并获得南京医科大学第一附属医院伦理委员会批准。
1.1.2 主要试剂和抗体 β-巯基乙醇和 RPMI 1640培养基(Gibco公司),胶原蛋白水解酶Ⅰ型和甲苯胺蓝(Sigma公司),透明质酸酶(Worthington公司),脱氧核糖核酸酶(DNase)Ⅰ型(Roche公司),Percoll分离液(GE公司),抗CD34抗体包被的磁珠、抗CD117抗体包被的磁珠和MACS细胞分选缓冲液(Miltenyi公司),重组人源干细胞因子(Stem cell factor,SCF)、IL-6 和 IL-3(R&D 公司),类胰蛋白酶抗体(Millipore公司),荧光封片试剂(DAKO公司),APC(Allophycocyanin)标记的抗人CD117抗体(Biolegend公司),APC标记的抗人 FcεR I抗体(eBioscience公司),藻红蛋白(phycoerythrin,PE)标记的抗人CD4抗体、APC标记的抗人CXCR4抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗人CD34抗体和APC-cy7标记的抗人CCR5抗体(BD公司)。
1.2 CD34+细胞向肥大细胞的诱导分化
根据Saito等[2]描述的方法分离 CD34+细胞。PBMC中加入相应量的抗CD34抗体包被的磁珠,4℃孵育30 min,用MACS细胞分选缓冲液洗涤2次,重悬细胞,过MACS细胞分选柱(规格:LS)进行分选,收集CD34+细胞。将CD34+细胞用含100 ng/mL SCF、50 ng/mL IL-6和5 ng/mL IL-3的 RPMI-1640(含10%胎牛血清)培养基[3]培养1周后,更换为含100 ng/mL SCF和50 ng/mL IL-6的培养基培养,以后每周半量换液,细胞密度保持在2×105/mL。培养4周作为肥大细胞前体(progenitor mast cells),培养11周作为成熟的肥大细胞。
1.3 分离人肠道黏膜细胞
取直肠癌或结肠癌患者手术后的无病变组织,用含高浓度抗生素(1 000 U/mL青霉素、1 000 U/mL链霉素、5%甲硝唑和2%庆大霉素)的 Hank's平衡盐溶液(HBSS)洗涤组织,除去表面血迹,剥离肠道表面的脂肪和结缔组织;纵向剖开肠道,将组织置于无菌纸上,吸去黏膜表面多余黏液,然后剥离黏膜组织,在HBSS液中洗涤,直至液体澄清;将组织剪成1 cm3小块,放入含2 mmol/L EDTA/7 mmol/L β-巯基乙醇的 HBSS液,37℃,60 r/min磁力搅拌10 min,洗涤2次,再放入含5 mmol/L EDTA的HBSS液,37℃,60 r/min磁力搅拌20 min,洗涤1次,然后转入含5%FBS、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640溶液,37℃,60 r/min磁力搅拌30 min,平衡组织中Ca2+和Mg2+;接着将组织剪成1 mm2,加入含5%FBS、75 U/mL 胶原酶(0.278 mg/mL)、72 U/ml透明质酸酶(0.1 mg/mL)和 50 U/mL脱氧核糖核酸酶(0.025 mg/mL)的 RPMI-1640培养基中消化组织4次,将收集的单细胞悬液混合,过 100目尼龙网,400×g离心 10 min,1 mmol/L EDTA-PBS溶液重悬细胞,细胞密度保持在107/mL左右。
1.4 Percoll密度梯度离心富集细胞
在50 mL离心管中依次加入12 mL 1.119 g/mL Percoll分离液和 1.077 g/mL Percoll,然后加入24 mL上述肠道黏膜细胞悬液,700×g,升降速为0,离心10 min,单个核细胞位于1.077 g/mL Percoll上层,粒细胞位于1.077 g/mL和1.119 g/mL Percoll交界处。收集粒细胞,用5倍体积的含5%FBS和1%Pen/strep的RPMI 1640溶液洗涤,200×g离心10 min,重复1次,MACS缓冲液重悬细胞。
1.5 抗CD117抗体包被的磁珠纯化肥大细胞
MACS缓冲液重悬细胞,加入相应量抗CD117抗体包被的磁珠,4℃,孵育15 min,MACS缓冲液洗涤2次,重悬细胞,过LS柱,收集CD117阳性细胞,用含100 ng/mL SCF和50 ng/mL IL-6的RPMI-1640(含10%胎牛血清)培养基进行培养。
1.6 肥大细胞的鉴定
1.6.1 甲苯胺蓝染色 肥大细胞贴片,用4%低聚甲醛固定,再用酸性甲苯胺蓝染色60 min,流水冲至无色,封片,在光学显微镜下观察。
1.6.2 免疫荧光染色 肥大细胞贴片,4% 低聚甲醛固定,0.1%Triton-10%牛血清白蛋白-PBS封闭破膜,室温1 h,洗涤,加鼠抗人类胰蛋白酶抗体,4℃,孵育过夜;洗涤,Alexa Fluor 488绿色荧光二抗室温孵育1 h,洗涤,DAPI染色5 min,洗涤,封片,用德国Leica公司激光共聚焦显微镜(SP5)观察。
1.6.3 流式细胞术(FCM)检测表型 加入抗人CD34、FcεRⅠ、CD117、CD4、CXCR4 和 CCR5 抗体,4℃孵育15 min,PBS洗涤2次,重悬细胞后用BD公司的流式细胞仪LSRⅡ进行检测。
2 结果
2.1 CD34+干细胞的分离与肥大细胞的诱导
CD34是造血干细胞表面标志物,用抗CD34包被的磁珠分离PBMC中的CD34+干细胞。流式细胞仪分析表明,CD34+细胞的纯度高达80%~90%,见图1。台盼蓝拒染显示,细胞活力约为95%。
类胰蛋白酶在肥大细胞中含量高,且具有高度选择性[4],因此可作为此处的鉴定指标。由图2可以看出,刚分离出的CD34+细胞,类胰蛋白酶荧光染色阴性。诱导培养4周后,即成为前体肥大细胞,此时类胰蛋白酶阳性细胞已经出现,且百分率较高。随着培养时间的延长,前体肥大细胞逐渐成熟,11周后,单个细胞中的类胰蛋白酶表达量进一步提高,且细胞阳性率接近百分之百。
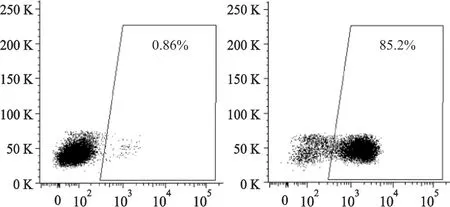
图1 CD34+细胞的分离Fig 1 Isolation of CD34+cells
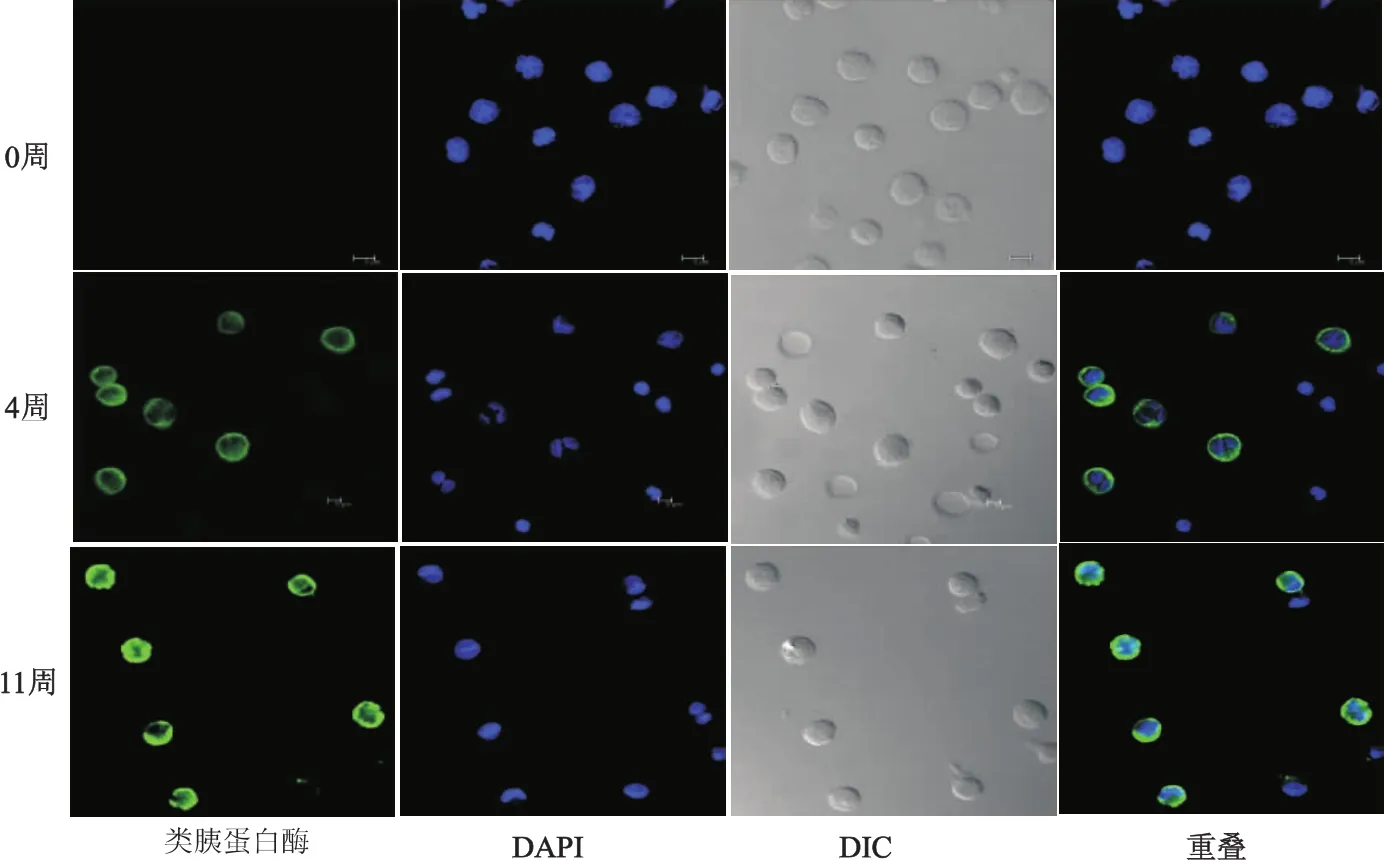
图2 CD34+细胞来源的肥大细胞内类胰蛋白酶的表达(免疫荧光染色×63)Fig 2 Tryptase expression in CD34+cell-derived mast cell
2.2 肠道黏膜组织分离的肥大细胞
先将肠道黏膜组织制成单细胞悬液,经抗CD117抗体包被的磁珠分选后获得成熟肥大细胞。甲苯胺蓝可将肥大细胞胞内颗粒染成紫红色,核染成浅蓝色,以此鉴定肥大细胞[5]和分析分选效果(图3),黏膜组织单细胞悬液中偶见肥大细胞,而免疫磁珠分离后的细胞则大多呈甲苯胺蓝染色阳性。
2.3 肥大细胞胞内类胰蛋白酶和膜表面分子标志物
肥大细胞的功能有赖于其胞内的生物活性介质(如类胰蛋白酶)和膜表面CD117和FcεRⅠ的表达水平。图4显示,类胰蛋白酶荧光染色,CD34+细胞来源的成熟肥大细胞虽然比前体肥大细胞的荧光强度略高,但两者都明显弱于肠道黏膜肥大细胞。流式分析显示相似的结果(图5),培养4周和11周的肥大细胞不再表达干细胞分子标志CD34;CD117和FcεRⅠ虽有表达,但表达率低于肠道黏膜肥大细胞。
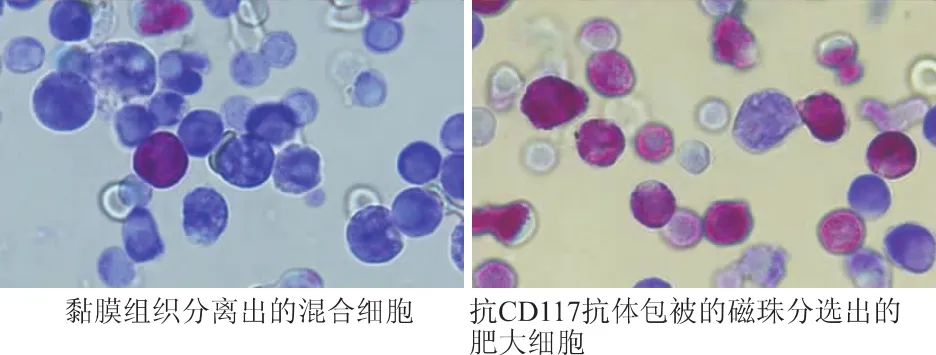
图3 肠道黏膜组织分离出的肥大细胞(甲苯胺蓝染色×100)Fig 3 Mast cells isolated from human intestinal
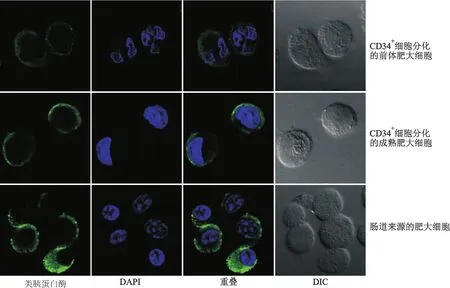
图4 两种来源的肥大细胞胞内类胰蛋白酶染色(免疫荧光染色×480)Fig 4 Expression of tryptase in mast cells generated by two methods
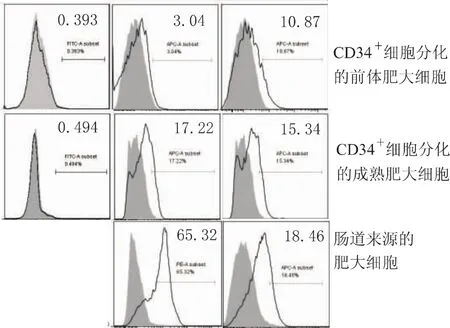
图5 两种来源的肥大细胞表型Fig 5 Phenotype of mast cells generated by two methods
另外,肠道黏膜是人类免疫缺陷病毒Ⅰ型(HIV-1)感染的重要部位,于是我们从HIV-1相关研究的应用方面将这两类肥大细胞与实验常用的肥大细胞系HMC-1进行比较。HIV-1膜表面gp120与细胞膜上CD4结合,再借助CXCR4、CCR5等辅助受体进入细胞内[6-7]。图6所示,HMC-1几乎不表达CD4、CXCR4;CD34+细胞来源的肥大细胞表达低水平的CD4,较高水平的CXCR4和CCR5;3种CD分子在肠道黏膜肥大细胞均有很好的表达,提示在病毒感染相关研究方面,原代肥大细胞比细胞系的使用价值更高。
3 讨论
肥大细胞来源于骨髓CD34+造血干细胞,经血液循环归巢到不同组织中。肥大细胞不同于其他免疫细胞,仅在组织中发现成熟的肥大细胞,血液中为前体肥大细胞。因此成熟肥大细胞只存在血管周围和与外界环境接触的皮肤及黏膜组织,且受不同组织微环境的影响,具有特异性的表型。因而获得成熟肥大细胞是一个复杂的过程。FcεRⅠ和CD117(c-kit)是肥大细胞表面调控其功能的重要受体[8-10]。因此,鉴于肥大细胞的骨髓造血干细胞分化起源和细胞表面分子表达特征,我们描述了两种人原代肥大细胞的体外刺激培养和分离方法。
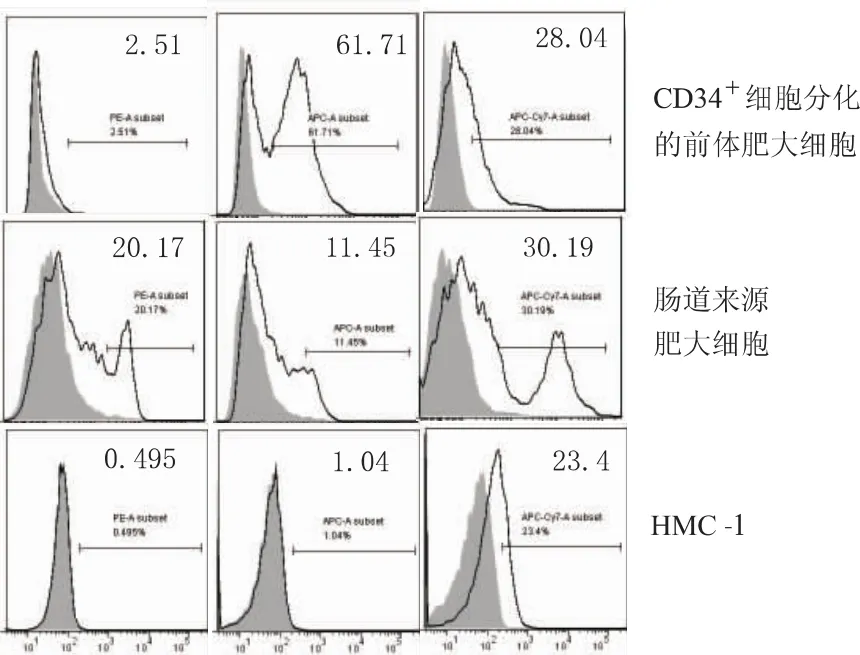
图6 原代肥大细胞与肥大细胞系HMC-1的表型比较Fig 6 Phenotype comparison of primary mast cells generated by two methods and HMC-1
结合机械分离、酶消化、Percoll密度梯度离心富集和单克隆抗体磁珠纯化方法而建立的人肠道组织肥大细胞分离法,提供了一种独特组织来源肥大细胞。但是分离过程中会受到如下因素的限制:①供体年龄和组织保存时间。年龄较大、保存时间较长,分离出的细胞存活率低,不能用于后续磁珠纯化。②不同密度Percoll的密度精确度。精确度不好会导致细胞分层错误,降低得率。③ 细菌或真菌污染。肠道本身菌群复杂,即使加入高浓度广谱抗生素和真菌类抗生素(如两性霉素B)后,仍存在污染的风险。④组织块大小。10 g肠道组织只可以分离得到0.5×106~4×106个肥大细胞,与肺部组织中分离肥大细胞的得率相近。⑤耗时,整个分离过程大概需要8 h以上。鉴于组织肥大细胞分离方法的复杂性,一种通过细胞因子刺激来自骨髓、脐带血或外周血CD34+造血干细胞体外分化,生成成熟肥大细胞的替代方法展现了其吸引力。本文通过SCF、IL-6和IL-3刺激外周血CD34+造血干细胞得到了大量形态一致的、纯度较高、活性较好的肥大细胞。但是这些肥大细胞因培养时缺乏体内复杂的微环境,有时和细胞系(如HMC-1)一样,在表型上趋于不成熟,导致不能更真实地模拟肥大细胞体内功能。此外,由于我们是加入血清培养,增加了CD34+细胞多向分化的能力[11],一定的未知类型细胞可能干扰后续的实验。
肥大细胞通过其表面受体及释放的炎症介质和免疫调节因子发挥作用。早期研究中主要介绍肥大细胞参与过敏和炎症反应,如肠道肥大细胞参与了肠过敏、乳糜泻和炎症性肠病(IBD)等肠道疾病的致病过程。近年来,肥大细胞在感染性疾病中的作用和免疫防御功能受到关注,更有研究指出肥大细胞是HIV-1潜伏感染储存库[12]。我们的数据显示两种原代肥大细胞都表达CD4、CXCR4和CCR5,这与Sundstrom等[12]的数据并不矛盾,因为肠道肥大细胞本身就存在5% ~15%前体细胞[13],且Sundstrom等研究的胎盘肥大细胞与肠道肥大细胞也存在差异。肠道黏膜是HIV-1感染的重要部位,因此,原代肥大细胞在HIV-1的黏膜感染和潜伏感染研究方面也具有重要的意义。
[1] Krishnaswamy G,Ajitawi O,Chi DS.Methods in Molecular Biology[M].Clifton,New Jersey:Humana Press,2006:13 -34.
[2] Saito H,Kato A,Matsumoto K,et al.Culture of human mast cells from peripheral blood progenitors[J].Nat Protoc,2006,1(4):2178 -2183.
[3] Jamur MC,Oliver C.Origin,maturation and recruitment of mast cell precursors[J].Front Biosci(Schol Ed),2011,3(6):1390 -1406.
[4] Hagel AF,Derossi T,Zopf Y,et al.Mast cell tryptase levels in gut mucosa in patients with gastrointestinal symptoms caused by food allergy[J].Int Arch Allergy Immunol,2012,160(4):350 -355.
[5] Huang S,Lu F,Chen Y et al.Mast cell degranulation in human periodontitis[J].J Periodontol,2013,84(2):248-255.
[6] Pollakis G,Paxton WA.Use of(alternative)coreceptors for HIV entry[J].Curr Opin HIV AIDS,2012,7(5):440-449.
[7] Cashin K,Roche M,Sterjovski J,et al.Alternative coreceptor requirements for efficient CCR5-and CXCR4-mediated HIV-1 entry into macrophages[J].J Virol,2011,85(20):10699-10709.
[8] Jensen BM,Akin C,Gilfillan AM.Pharmacological targeting of the KIT growth factor receptor:a therapeutic consideration for mast cell disorders[J].Br J Pharmacol,2008,154(8):1572 -1582.
[9] El-Agamy DS.Targeting c-kit in the therapy of mast cell disorders:current update[J].Eur J Pharmacol,2012,690(1):1-3.
[10] Ray P,Krishnamoorthy N,Oriss TB,et al.Signaling of c-kit in dendritic cells influences adaptive immunity[J].Ann N Y Acad Sci,2010,1183(5):104 -122.
[11] Xu Y,Liu L,Zhang L,et al.Efficient commitment to functional CD34+progenitor cells from human bone marrow mesenchymal stem-cell-derived induced pluripotent stem cells[J].PLoS One,2012,7(4):e34321.
[12] Sundstrom JB,Ellis JE,Hair GA,et al.Human tissue mast cells are an inducible reservoir of persistent HIV infection[J].Blood,2007,109(12):5293 -5300.
[13] Sellge G,Bischoff SC.Methods in molecular biology[M].Clifton,New Jersey:Humana Press,2006:123 -138.
