糖尿病心肌病小鼠心肌成纤维细胞miR-375表达及其对胶原蛋白Ⅰ合成的影响
2013-11-22黄燕张赢予王好周艳芳张国辉芮涛
黄燕,张赢予,王好,周艳芳,张国辉,芮涛
(江苏大学附属人民医院心内科,江苏镇江212002)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的常见并发症,其临床诊断是基于糖尿病患者独立于冠心病、高血压和乙醇性心肌病等出现心功能不全[1]。心肌纤维化是糖尿病心肌病发生发展过程中共同的、标志性的病理特征。心肌纤维化主要是心肌成纤维细胞合成细胞外基质蛋白增加,如Ⅰ型胶原蛋白(collagenⅠ),Ⅲ型胶原蛋白(collagen Ⅲ)[2]。微小RNA(microRNA)是由18~24个核苷酸组成的非编码的小分子RNA,通过与靶mRNA的3'-UTR区域的互补配对结合而抑制靶mRNA的翻译或促进该mRNA的降解从而降低目标蛋白的表达,进而发挥其生物学功能[3]。以往研究表明,miR-375直接调节胰腺β细胞胰岛素的分泌,其表达与糖尿病的形成密切相关[4]。本研究旨在检测糖尿病状态下心肌成纤维细胞中miR-375的表达,同时探讨miR-375在糖尿病心肌纤维化中的可能作用机制。
1 材料和方法
1.1 动物和主要试剂
C57BL/6小鼠,2~4周龄,雌雄不限,由江苏大学动物实验中心提供。DMEM(高糖及低糖)购自美国Gibco公司;标准小牛血清购自美国Hyclone公司,胰酶购自美国Sigma公司;细胞RNA提取试剂盒,RNA反转录试剂盒,实时荧光定量 PCR试剂盒,小鼠 miR-375引物,RNU6B购自QIAGEN公司;小鼠miR375抑制剂(荧光素标记)购自上海吉玛制药技术有限公司;转染试剂,无血清培养基购自Invitrogen公司;免疫组化试剂盒购自北京厚德生物科技有限公司;波形蛋白(vimentin)一抗购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 原代心肌成纤维细胞的分离、培养及传代脱颈法处死C57BL/6小鼠,75%乙醇消毒2次,无菌条件下取出心脏,将其剪成1 mm×1 mm×1 mm左右的组织块,用无Ca2+-Mg2+的Hank's缓冲液清洗组织块,0.08%胰酶加0.06%胶原酶37℃水浴消化,收集消化后的上清并用含20%血清的低糖(5 mmol/L)DMEM中和,直至组织块变透明终止消化。将收集的细胞离心重悬,接种至10 cm2细胞培养皿,37℃ 5%CO2培养箱内培养2 h,差速贴壁法除去未贴壁的其他细胞,用含10%小牛血清的低糖DMEM培养基培养心肌成纤维细胞。当细胞长满至培养皿的70%~80%时,用0.25%胰酶消化按1∶2的比例进行传代。
1.2.2 心肌成纤维细胞形态学观察及鉴定 倒置显微镜下观察第2代心肌成纤维细胞的形态。取第2代的心肌成纤维细胞采用免疫组化法进行波形蛋白鉴定,波形蛋白阳性率作为心肌成纤维细胞纯度鉴定的指标,阴性对照用PBS代替一抗。400倍显微镜下随机选取5个视野计数20~30个细胞,计算波形蛋白阳性细胞的比例。
1.2.3 实时定量PCR检测心肌成纤维细胞中miR-375的表达 心肌成纤维细胞分为2组,即对照组和高糖处理组,对照组采用5 mmol/L葡萄糖的DMEM培养,高糖处理组采用25 mmol/L葡萄糖的DMEM培养。利用细胞RNA提取试剂盒提取总RNA,DEPC水溶解获得的RNA,核酸蛋白分析仪(Beckman Coulter,USA)检测 RNA浓度及纯度;RNA反转录试剂盒将细胞总RNA反转录成cDNA;构建miR-375和RNU6B的实时定量PCR反应体系(20 μL):实时定量PCR 混合试剂10 μL、通用引物2 μL、去核糖核酸酶水 4 μL、小鼠 miR-375 引物2 μL、cDNA 模板2 μL;反应条件:95 ℃变性15 min,94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s,共 40 个循环,每个样本均作复管PCR反应,至少重复2次(实时定量PCR仪采用Bio-rad CFX96)。采用RNU6B作为内参照,用RNU6B的拷贝数作为校正基数,通过Light Cycler软件直接获得各个样本中miR-375的ΔCt值;以对照组的 ΔCt值作为校正,得出 - ΔΔCt,按目的基因表达量 =2-ΔΔCt公式计算各个样本中miR-375的相对表达量。
1.2.4 miR-375抑制剂转染心肌成纤维细胞 在37℃、5%CO2孵育箱中,以含10%胎牛血清的高糖DMEM培养心肌成纤维细胞。转染前以胰酶消化心肌成纤维细胞,计数后,以105/mL接种于6孔板中,待细胞的融合率达到80%左右时,换为不含血清的高糖DMEM培养液,饥饿细胞6 h,按照说明书转染细胞,阴性对照组转染miR-375抑制剂阴性对照。转染6 h后,换为含10%胎牛血清的高糖DMEM培养液,培养48 h后采用实时定量PCR方法检测细胞转染效率。
1.2.5 免疫组化检测各组心肌成纤维细胞Ⅰ型胶原蛋白的表达 心肌成纤维细胞按105/mL接种于置有无菌盖玻片的6孔板内进行细胞爬片,细胞贴壁后,用高糖培养基处理6 h,瞬时转染miR-375抑制剂;转染48 h后采用免疫组化试剂盒检测Ⅰ型胶原蛋白的表达。操作步骤:PBS漂洗,3%H2O2-甲醛处理,PBS漂洗,血清封闭,一抗(1∶200,PBS稀释)孵育过夜,PBS漂洗,二抗孵育,PBS漂洗,SABC孵育,PBS漂洗,DAB显色,自来水冲洗,苏木青复染,自来水冲洗,脱水、透明、封片、镜检。阴性对照用PBS代替一抗。200倍显微镜下随机选取5个视野,每个视野计数20~30个细胞,计算Ⅰ型胶原蛋白阳性细胞的比例。
1.3 统计学处理
用SPSS 16.0统计软件进行分析。数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 C57BL/6小鼠心肌成纤维细胞形态学观察及纯度鉴定
在倒置显微镜下观察,心肌成纤维细胞呈梭形,多角形,细胞质透明,细胞核大,呈椭圆形,常含有2~3个核。培养第2代的心肌成纤维细胞波形蛋白鉴定,心肌成纤维细胞胞质呈棕黄色,即表达阳性,非心肌成纤维细胞表达阴性,结果显示心肌成纤维细胞纯度达90%。见图1。

图1 免疫组化染色鉴定心肌成纤维细胞纯度(×400)Fig 1 The purity of cardiac fibroblasts evaluated by immunohistochemical staining with vimentin
2.2 高糖对心肌成纤维细胞中miR-375表达的影响
实时定量PCR方法检测结果显示,心肌成纤维细胞经高糖处理6,12,24 h后,miR-375表达增加(F=91.263,P<0.05),均显著高于对照组(P均<0.05),见图2。

图2 实时定量PCR检测miR-375的差异性表达Fig 2 The different expression of miR-375 in cardiac fibroblasts detected by qRT-PCR
2.3 miR-375抑制剂的转染效率
荧光实时定量PCR检测结果显示,miR-375抑制剂转染心肌成纤维细胞的效率约70%,见图3。心肌成纤维细胞转染48 h后用于实验。
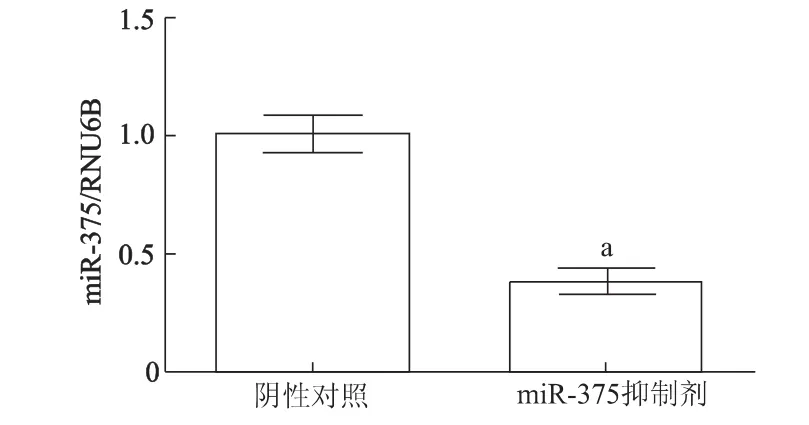
图3 实时定量PCR检测miR-375抑制剂转染效率Fig 3 The transfection efficiency of miR-375 inhibitor detected by qRT-PCR
2.4 miR-37抑制剂对高糖处理心肌成纤维细胞中Ⅰ型胶原蛋白表达的影响
免疫组化Ⅰ型胶原蛋白阳性心肌成纤维细胞胞质呈棕褐色。Ⅰ型胶原蛋白阳性率=Ⅰ型胶原蛋白阳性细胞数/总细胞数×100%。免疫组化结果表明,miR-375抑制剂组的心肌成纤维细胞Ⅰ型胶原蛋白阳性表达率(37.84±3.34)%显著低于miR-375抑制剂阴性对照组的(76.20±6.96)%,差异有统计学意义(t=5.346,P <0.05)。见图4。

图4 免疫组化染色检测心肌成纤维细胞中Ⅰ型胶原蛋白的表达(×200)Fig 4 Expression of collagenⅠin cardiac fibroblasts evaluated by immunohistochemical staining
3 讨论
糖尿病心肌病是糖尿病的常见并发症之一,也是导致糖尿病患者致残率和致死率较高的主要原因。其发病机制至今未明,对该病的治疗仍缺乏有效手段。心肌纤维化是糖尿病心肌病的病理性改变之一。心肌纤维化是心肌成纤维细胞合成细胞外基质蛋白,如Ⅰ型胶原蛋白﹑Ⅲ型胶原蛋白等增加,进而在心肌细胞间隙沉积,导致心室壁僵硬,顺应性下降,影响心室的舒张和收缩功能,最终导致心力衰竭,甚至死亡。近年来,在探索心肌纤维化发生机制的过程中,微小RNA的作用引人关注。微小RNA是一类非编码的小分子RNA,通过与靶mRNA特异性以碱基互补配对的方式结合,促进靶mRNA的降解或抑制该mRNA的翻译而发挥其生物学功能[3]。微小RNA在许多生物学过程中发挥重要的调控作用,如细胞增殖、分化、凋亡、癌症发生等。最近研究表明,微小RNA也参与调控心血管系统的发育和疾病发生过程。目前已经证明miR-133和miR-30通过靶向作用于结缔组织生长因子,一种关键的促纤维化蛋白,而参与心肌纤维化的形成[5]。另外,也已证明在冠状动脉结扎的心肌梗死小鼠模型中miR-29的表达下降与胶原蛋白的表达增加相关,所以被认为参与心肌纤维化[6]。Feng等[7]发现糖尿病心肌 miR-133表达下降导致糖尿病小鼠心肌肥厚。
本课题组前期通过微阵基因序列检测分析,发现糖尿病小鼠的心肌有多个微小RNA的表达上调,其中包括 miR-375,miR-99a,miR-133a等。miR-375最初被发现在胰腺胰岛中表达,调节胰岛素的分泌和葡萄糖的代谢[8],影响胰腺α和β细胞的质量并参与胰腺癌的发展[8-10]。最近报道 miR-375与肿瘤的发展有关,其在一些恶性肿瘤中表达下调如肝癌、胃 癌[11-13],头 颈 部 鳞 状 细 胞 癌[14-15]、胰 腺癌[16]。但到目前为止,miR-375调节糖尿病心肌纤维化相关的蛋白表达,参与糖尿病心肌纤维化的发生和发展尚未见文献报道。
本实验通过体外培养C57BL/6小鼠的心肌成纤维细胞经高糖处理制成DCM模型,发现心肌成纤维细胞经高糖处理6,12,24 h后,miR-375的表达均显著增加,这一研究结果表明糖尿病高血糖影响心肌成纤维细胞miR-375的表达;另外,高糖处理的心肌成纤维细胞在转染miR-375抑制剂抑制miR-375表达后,胞质中Ⅰ型胶原蛋白的表达显著降低,这提示,miR-375在糖尿病心肌纤维化中起一定的作用,其具体的作用机制尚不清楚。基于生物信息工具,miR-375靶向作用于IL-33的3'-UTR,而新近研究报道IL-33具有抗纤维化的作用。因此,我们推测miR-375可能通过靶向作用于IL-33参与糖尿病心肌纤维化的发生发展。为研究miR-375在糖尿病心肌病心肌纤维化中的确切机制,需明确高血糖是否能导致心肌成纤维细胞IL-33的表达下调从而促进心肌纤维化的发生,以及IL-33mRNA 3-UTR是否为miR-375的靶标。
本研究结果提示miR-375在糖尿病心肌纤维化中起一定的作用,为探讨糖尿病心肌病心肌纤维化发病机制提供了新的线索,对糖尿病心肌病心肌纤维化的治疗提供了新的理论依据。
[1] Maya L,Villarreal FJ.Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis[J].J Mol Cell Cardia,2010,48(3):524 -529.
[2] Ban CR,Twigg SM.Fibrosis in diabetes complications:Pathogenic mechanisms and circulating and urinary markers[J].Vasc Health Risk Manag,2008,4(3):575 -596.
[3] Fabian MR,Sonenberg N,Filipowicz W.Regulation of mRNA translation and stability by microRNAs[J].Annu Rev Biochem,2010,79:351 -379.
[4] Poy MN,Eliasson L,Krutzfeldt J,et al.A pancreatic islet-specific microRNA regulates insulin secretion[J].Nature,2004,432(7014):226 -239.
[5] Duisters RF,Tijsen AJ,Schroen B,et al.miR-133 and miR-30 regulate connective tissue growth factor:implications for a role of microRNAs in myocardial matrix remodeling[J].Circ Res,2009,104(2):170 -178.
[6] van Rooij E,Sutherland LB,Thatcher JE,et al.Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J].Proc Natl Acad Sci USA,2008,105(35):13027 -13032.
[7] Feng B,Chen S,George B,et al.miR133a regulates cardiomyocyte hypertrophy in diabetes[J].Diabetes Metab Res Rev,2010,26(1):40 -49.
[8] Poy MN,Hausser J,Trajkovski M,et al.miR-375 maintains normal pancreatic alpha-and beta-cell mass[J].Proc Natl Acad Sci USA,2009,106(14):5813 -5818.
[9] Kloosterman WP,Lagendijk AK,Ketting RF,et al.Targeted inhibition of miRNA maturation with morpholinos reveals a role for miR-375 in pancreatic islet development[J].PLoS Biol,2007,5(8):e203.
[10] Avnit-Sagi T,Kantorovich L,Kredo-Russo S,et al.The promoter of the pri-miR-375 gene directs expression selectively to the endocrine pancreas[J].PLoS One,2009,4(4):e5033.
[11] Tsukamoto Y,Nakada C,Noguchi T,et al.MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta[J].Cancer Res,2010,70(6):2339 - 2349.
[12] Liu AM,Poon RT,Luk JM.MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties[J].Biochem Biophys Res Commun,2010,394(3):623 -627.
[13] Ding L,Xu Y,Zhang W,et al.miR-375frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2[J].Cell Res,2010,20(7):784 -793.
[14] Hui AB,Lenarduzzi M,Krushel T,et al.Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas[J].Clin Cancer Res,2010,16(4):1129 -1139.
[15] Avissar M,Christensen BC,Kelsey KT,et al.MicroRNA expression ratio is predictive of head and neck squamous cell carcinoma[J].Clin Cancer Res,2009,15(8):2850-2855.
[16] Bloomston M,Frankel WL,Petrocca F,et al.MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J].JAMA,2007,297(17):1901 -1908.
