建立高分辨熔解曲线分析法检测SF3B1基因突变
2013-11-22杨静姚冬明钱军王翠竹杨小飞林江李云陈星星肖高飞马吉春
杨静,姚冬明,钱军,王翠竹,杨小飞,林江,李云,陈星星,肖高飞,马吉春
(江苏大学附属人民医院1.血液科,2.中心实验室,江苏 镇江212002)
RNA剪接是真核细胞基因表达中一个非常重要的生物过程,它通过选择性剪切在维持蛋白质的多样性方面起着重要的作用[1-2]。近年来研究发现,肿瘤中存在的RNA剪接的异常改变可引起多个基因突变的发生[2-3]。SF3B1蛋白是剪切因子3b蛋白复合物的一个亚单位,在RNA剪接过程中发挥着重要作用[4]。最新研究发现,6.5% ~28.1%的骨髓增生异常综合征(myelodysplastic syndrome,MDS)和5% ~15%的慢性淋巴细胞白血病患者中存在着SF3B1基因突变,其突变位点主要发生于密码子E622、H662、K666 和 K700[5-11]。高分辨熔解曲线分析(high-resolution melting analysis,HRMA)是一种灵敏度高、特异性好、可靠及快速的突变检测方法[12]。我们拟建立HRMA技术检测MDS患者的SF3B1基因突变。
1 对象和方法
1.1 病例
我院血液科初诊MDS患者30例,其中男18例,女12例;年龄 30~78岁,平均年龄58岁。MDS诊断按 WHO标准[13],其中难治性贫血(refractory anemia,RA)9例、伴环形铁粒幼细胞的难治性贫血(RA with ringed sideroblasts,RARS)1例、伴多系病态造血的难治性血细胞减少症(refractory cytopenia with multilineage dysplasia,RCMD)18例、伴环形铁粒幼细胞的RCMD(RCMDRS)2例。本研究获得了江苏大学附属人民医院伦理委员会的批准。
1.2 主要试剂和仪器
Ficoll-Hypaque,上海试剂二厂;基因组DNA提取试剂盒,Gentra公司;PCR试剂,X-gal和 IPTG,TaKaRa公司;Taq DNA酶,MBI Fermentas公司;AxyPrep DNA凝胶回收试剂盒,AxyPrep质粒提取试剂盒,PCR耗材,Axygen公司;T4 DNA连接酶,Promega公司;1×LCGreen Plus,Idaho公司;PCR引物和温度内标校准品片段序列由上海基康生物工程技术服务有限公司合成;ABI7300 PCR仪,美国ABI公司;凝胶成像仪,英国 Syngene公司;LightScanner分析仪,美国Idaho公司。
1.3 骨髓单个核细胞分离和基因组DNA提取
用人淋巴细胞分离液(Ficoll-Hypaque)分离骨髓单个核细胞,应用基因组DNA提取试剂盒提取基因组DNA,-20℃保存备用。
1.4 引物设计及PCR扩增
应用LightScanner引物设计软件 V 1.0(Idaho Technology,Salt Lake City,Utah)设计针对4个突变位点的引物,引物序列见表1。25 μL PCR反应体系包括 1×PCR 缓冲 液、0.25mmol/L dNTP、2.5 mmol/L MgCl2、引物 0.8 μmol/L、高温和低温内标校准品 0.8 μmol/L[14]、1 × LCGreen Plus、1 U Taq DNA酶及样本DNA 50 ng。将25 μL体系置于PCR仪上进行PCR扩增。反应条件为95℃预变性5 min,然后94 ℃ 30 s,60 ℃ 30 s,72 ℃ 延伸 30 s,共40个循环,72℃延伸7 min。
1.5 HRMA 检测
将PCR扩增产物置于LightScanner分析仪中,从55℃到95℃以0.1℃/s逐步加热,应用CALLIT 2.0软件(美国Idaho Technology公司)对采集后的荧光曲线进行分析,应用低温内标和高温内标的Tm值对标本进行校准、标化处理。
1.6 PCR 产物测序
应用ABI 3730 DNA测序仪来验证HRMA检测的结果,测序引物序列见表1。
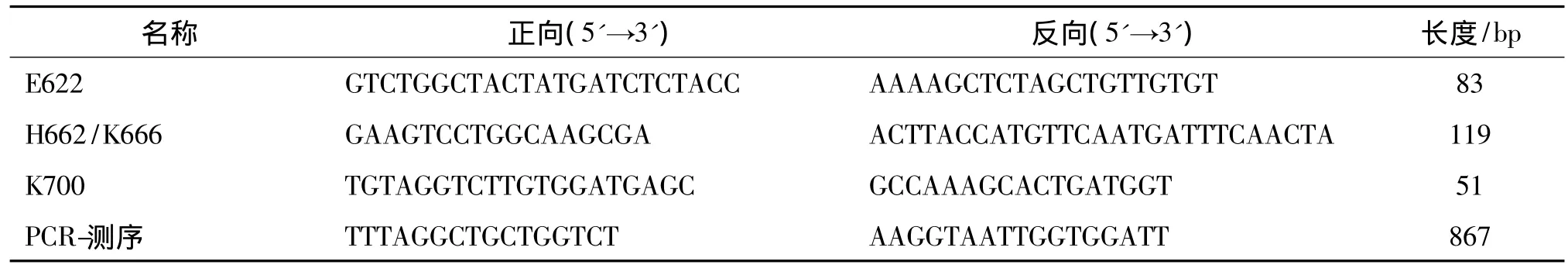
表1 高分辨熔解曲线分析及DNA测序的PCR引物序列Tab 1 Primers for high-resolution melting analysis and DNA sequencing
2 结果
2.1 HRMA 检测结果
温度内标校准品能使PCR扩增产物的熔解曲线较校准前更为均一(图1a和1b)。通过HRMA结果中熔解曲线和熔解峰的形状能对SF3B1基因突变进行鉴别。30例MDS标本中2例呈现复杂坡度的标化熔解峰(图1c和1d),为突变型SF3B1基因标本;而其余标本均呈现典型而对称的标化熔解曲线和熔解峰,为野生型SF3B1基因标本。2例突变分别见于1例RARS患者和1例RCMD-RS患者。
2.2 DNA 测序结果
对30例标本进行DNA测序验证,结果显示,具有异常熔解曲线的2例标本中1例为K666M杂合性突变,即 c.1997A>T(AAG→ATG);1例为K700E杂合性突变,即c.2098A>G(AAA→GAA),其余例标本均为野生型。见图2。
2.3 HRMA法的灵敏度
我们对1例具有SF3B1 K700E突变的MDS标本的突变PCR产物和野生型PCR产物进行克隆,然后应用野生型克隆对突变型克隆进行稀释(分别含突变型100%、50%、25%、10%、5%、2%、1%和 0%),HRMA 检测SF3B1 K700E突变的灵敏度为5%,即0.05(图3)。

图1 30例骨髓增生异常综合征患者SF3B1基因突变的高分辨熔解曲线Fig 1 High-resolution melting analysis results of SF3B1 mutations in 30 patients with myelodysplastic syndrome

图2 骨髓增生异常综合征患者中K666M与K700E突变的测序结果Fig 2 Sequencing results of K666M and K700E mutations in patients with myelodysplastic syndrome

图3 高分辨熔解曲线分析检测SF3B1基因突变的灵敏度Fig 3 Sensitivity of high-resolution melting analysis in detecting SF3B1 mutations
3 讨论
RNA剪接是一个多步骤依次进行的生物过程,剪接体在这个过程中起着重要的作用,其由5个小核糖核蛋白(snRNP)复合体组成,包括U1、U2、U4、U5、U6 和50 ~100 种非 snRNP[15]。其中,小核糖核蛋白 U2由剪接因子 3A(SF3A)、剪接因子 3B(SF3B)及12 S RNA 亚基组成[15],SF3B1 参与剪接体组装的早期过程。目前发现SF3B1基因突变主要为K700E突变,此外还有E622、H662、K666等突变,主要见于骨髓中以环形铁粒幼红细胞为特征的MDS亚型[5-9]。研究发现,伴有 SF3B1 基因突变者的总体生存率高于未突变者,且向急性髓系白血病转化的风险率较未突变者低[6-7]。
目前,DNA直接测序法常被用来检测SF3B1基因突变[5-8]。本研究中,我们建立了一种快速的、高通量的HRMA技术来检测SF3B1基因突变。与其他技术相比,HRMA技术成本低、省时、省力,无需序列特异性探针,且一个人一次能独立完成多达96个DNA标本的突变检测。只有被HRMA检测出的突变样本才需要进行DNA测序验证。从提取基因组DNA开始到完成突变检测分析过程,HRMA只需2.5 h,而直接DNA测序法整个过程需要4 d。此外,PCR产物可以直接进行HRMA突变检测,无需后续处理;并且,HRMA的灵敏度能达到0.05。虽然我们初步检测到SF3B1基因的突变率(6%)低于其他文献的报道[5-8],这有可能由于我们筛查的骨髓标本中以环形铁粒幼红细胞为特征的MDS亚型类比较少,而不是由应用的技术所导致。本研究结果显示,3例骨髓中伴有环形铁粒幼细胞增多的患者中存在2例SF3B1基因突变,即SF3B1基因突变常见于RARS与RCMD-RS这两类MDS亚型,这与其他文献报道一致。
总之,我们建立了一种高通量、快速、特异和灵敏度高的筛选SF3B1基因突变的HRMA方法,该方法更适用于对临床标本进行SF3B1基因突变的分子诊断。
[1]Pajares MJ,Ezponda T,Catena R,et al.Alternative splicing:an emerging topic in molecular and clinical oncology[J].Lancet Oncol,2007,8(4):349 -357.
[2]David CJ,Manley JL.Alternative pre-mRNA splicing regulation in cancer:pathways and programs unhinged[J].Genes Dev,2010,24(21):2343-2364.
[3]Grosso AR,Martins S,Carmo-Fonseca M.The emerging role of splicing factors in cancer[J].EMBO Rep,2008,9(11):1087-1093.
[4]Golas MM,Sander B,Will CL,et al.Molecular architecture of the multiprotein splicing factor SF3b[J].Science,2003,300(5621):980-984.
[5]Yoshida K,Sanada M,Shiraishi Y,et al.Frequent pathway mutations of splicing machinery in myelodysplasia[J].Nature,2011,478(7367):64 -69.
[6]Papaemmanuil E,Cazzola M,Boultwood J,et al.Somatic SF3B1 mutation in myelodysplasia with ring sideroblasts[J].N Engl J Med,2011,365(15):1384-1395.
[7]Malcovati L,Papaemmanuil E,Bowen DT,et al.Clinical significance of SF3B1 mutations in myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms[J].Blood,2011,118(24):6239-6246.
[8]Damm F,Thol F,Kosmider O,et al.SF3B1 mutations in myelodysplastic syndromes:clinical associations and prognostic implications[J].Leukemia,2012,26(5):1137 -1140.
[9]Patnaik MM,Lasho TL,Hodnefield JM,et al.SF3B1 mutations are prevalent in myelodysplastic syndromes with ring sideroblasts but do not hold independent prognostic value[J].Blood,2012,119(2):569 -572.
[10]Wang L,Lawrence MS,Wan Y,et al.SF3B1 and other novel cancer genes in chronic lymphocytic leukemia[J].N Engl J Med,2011,365(26):2497-2506.
[11]Rossi D,Bruscaggin A,Spina V,et al.Mutations of the SF3B1 splicing factor in chronic lymphocytic leukemia:association with progression and fludarabine-refractoriness[J].Blood,2011,118(26):6904-6908.
[12]Montgomery J,Wittwer CT,Palais R,et al.Simultaneous mutation scanning and genotyping by high-resolution DNA melting analysis[J].Nat Protoc,2007,2(1):59 -66.
[13]Vardiman JW,Thiele J,Arber DA,et al.The 2008 revision of the World Health Organization(WHO)classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood,2009,114(5):937 -951.
[14]Qian J,Lin J,Yao DM,et al.Rapid detection of JAK2 V617F mutation using high-resolution melting analysis with LightScanner platform[J].Clin Chim Acta,2010,411(23/24):2097-2100.
[15]Nagai K,Muto Y,Pomeranz Krummel DA,et al.Structure and assembly of the spliceosomal snRNPs.Novartis Medal Lecture[J].Biochem Soc Trans,2001,29(Pt 2):15 -26.
