大剂量冲击法建立胶质瘤耐替莫唑胺细胞株及生物学鉴定
2013-05-07向定朝王存祖陆晓峰欧阳琦
向定朝,王存祖,陆晓峰,欧阳琦
(1.江苏大学临床医学院,江苏 镇江212001;2.苏北人民医院神经外科,江苏 扬州225001;3.江苏大学基础医学与医学技术学院,江苏镇江212013)
胶质瘤一直是神经外科领域的治疗难题,化疗是胶质瘤术后重要治疗方法之一。目前国际上公认的胶质瘤化疗首选药物是替莫唑胺(temozolomide,TMZ)[1],但研究显示替莫唑胺也仅能小幅延长患者生存时间,因胶质瘤耐药而不能改善其预后。胶质瘤化疗耐药,是胶质瘤化疗失败和胶质瘤复发的原因。近年来“肿瘤干细胞学说”认为,从胶质瘤中分离出来的胶质瘤干细胞(glioma stem cells,GSCs)具有较强的耐药性,是胶质瘤耐药以及复发的根本原因。为深入了解胶质瘤对替莫唑胺耐药的原因,体外构建人脑胶质瘤耐替莫唑胺U251 细胞株(U251/TMZ),是研究胶质瘤耐药的基础。本实验通过大剂量冲击法[2]建立胶质瘤耐替莫唑胺细胞模型,并比较U251/TMZ 与亲代细胞U251 之间的生物学特征。
1 材料和方法
1.1 实验材料及主要试剂
人脑胶质瘤U251 细胞株购于上海生命科学研究所细胞库;培养细胞贴壁生长的特级胎牛血清、DMEM 低糖培养基、DMSO、胰酶、青链双抗等购于Gibco 公司;CD133、ABCG2 鼠抗人单抗购于Neo-Markers 公司;CD133(AC133)、羊抗鼠IgG(二抗)、CY3等均购于Miltenyi 公司;ECL 化学发光试剂盒购于Merck Millipore 公司;TMZ、噻唑盐(MTT)等购于Sigma 公司。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM 培养基培养U251 细胞,置于CO2培养箱内(37 ℃,5%CO2)培养。当细胞铺满培养瓶底壁时进行消化、传代。
1.2.2 药物大剂量冲击法建立U251/TMZ 细胞细胞接种于75 mL 玻璃培养瓶中,贴壁生长至铺满瓶底时,参考我们前期实验及预实验数据[3],加入120 μmol/L 的TMZ 进行诱导。常规条件下培养72 h,弃含药培养液,PBS 洗2 次,加正常培养液,此后1 ~2 天换液1 次,以清除死亡的漂浮细胞。待存活下来的细胞恢复了生长增殖能力并形成较大的细胞克隆(>100 个细胞)时,胰酶消化,接种至25 mL的玻璃培养瓶中传代培养,当细胞增殖到足够数量时,再接种于75 mL 玻璃培养瓶中,按上法再次筛选。培养细胞时间约5 个月,平均每月可筛选1 ~2次。把实验最后所获得的细胞作为耐药细胞,并命名为U251/TMZ。
1.2.3 MTT 法检测药物敏感性 取对数期细胞制备细胞悬液,调整细胞数为5 ×104/mL,接种至96孔培养板,每孔200 μL,培养24 h 后加入含不同浓度TMZ 的培养基。TMZ 设6 个试验浓度,即10,50,100,200,500,1000 μmol/L 和一个空白对照组,每个实验浓度设置5 个复孔。继续培养72 h 后,每孔加入0.5% MTT 20 μL,培养箱继续培养4 h,弃上清,PBS 小心冲洗3 次后,加入DMSO 150 μL,震荡均匀后酶标仪检测,设定波长为540 nm 测定每孔的光密度(D)值。采用SPSS 软件的Probit 程序计算药物的半数抑制浓度(IC50),耐药指数(resistance index,RI)=耐药细胞IC50/亲本细胞IC50。
1.2.4 细胞生长增殖曲线绘制 取生长状态良好的细胞,将U251/TMZ 和亲代细胞悬液(1 ×104个/mL)分别接种至6 孔板中,不同细胞设3 个复孔,每孔接种1 mL,分别于接种后每间隔24 h 计数1 次,连续观察1 周。每次计数取3 个复孔细胞数的平均值,以培养时间为横坐标,细胞数为纵坐标绘制生长曲线。
1.2.5 免疫荧光检测CD133 表达 细胞接种于24孔培养板中,细胞贴壁生长好后(约12 h),用4%低聚甲醛固定,3% BSA 4 ℃封闭30 min,加入CD133一抗,放入4 ℃冰箱过夜。第2 天用PBS 漂洗3 次后,加入带CY3荧光标记的二抗,37 ℃水浴箱温热2 h,经Hoechst 33342 复染后,PBS 漂洗3 次,置荧光显微镜下观察并摄片。
阳性细胞判断:CD133 阳性为细胞膜出现红色荧光,Hoechst 33342 复染后,阳性细胞为细胞核出现蓝色荧光。结果分析:置于高倍镜下观察,每孔随机取3 个不同视野拍照,采用ImageJ 软件计算细胞数,并计算阳性细胞率。阳性细胞率=CD133 阳性细胞数/Hoechst 33342 阳性细胞数。
1.2.6 蛋白质印迹法检测ABCG2 蛋白的表达 取对数生长期的U251/TMZ 和亲代细胞,调整细胞数为1 ×106个/mL,分别接种于6 孔板中。细胞培养24 h 后,收集细胞并提取总蛋白。用考马斯亮蓝法测定蛋白浓度,按12 μg 上样加入凝胶孔中,开始SDS-PAGE 凝胶电泳。电泳结束后,使用半干膜法转印到PVDF 膜上。5%脱脂奶粉室温封闭2 h,加入ABCG2 一抗4 ℃孵育过夜后,洗涤3 次,每次10 min,二抗室温孵育2 h 洗涤3 次,每次10 min,使用ECL 化学发光试剂盒显影,通过CCD 凝胶成像系统采集图像,采用Lane1D 软件分析条带灰度。
1.3 统计学分析
应用统计软件SPSS 16.0 进行统计学处理,计量资料以均数±标准差(±s)表示,成组资料比较采用两样本t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 成功构建U251/TMZ 细胞株
在早期加入TMZ 后,大量U251 细胞死亡。经过约3 个周期培养后,细胞耐药性产生,再次加入TMZ后细胞死亡数目逐渐减少。约经过5 个月的培养,获得相对稳定的胶质瘤耐药细胞株U251/TMZ。显微镜下观察,亲代胶质瘤细胞多为梭形,大小均匀,边界清楚,贴壁生长。耐药细胞株大部分贴壁形态相似,异形性不显著,有少部分细胞变形,并有巨细胞产生。和亲代细胞株相比,细胞轮廓更清晰。见图1。
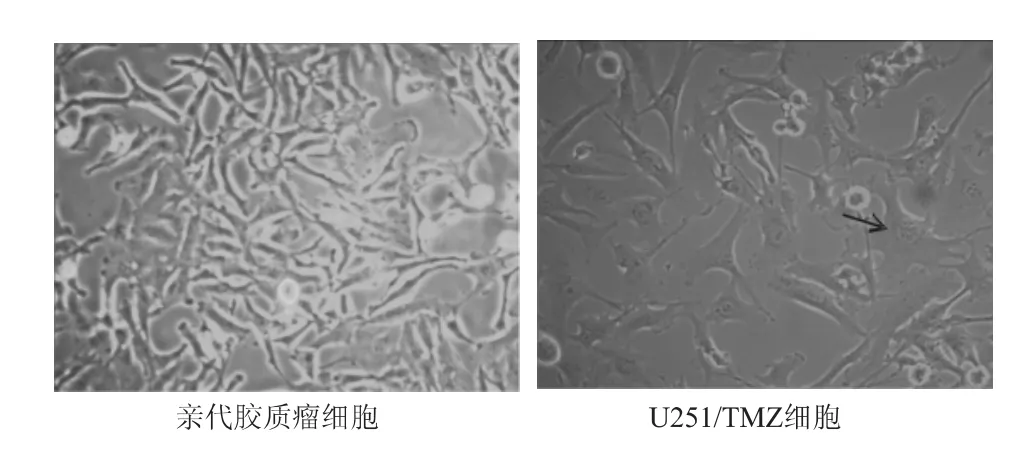
图1 耐药胶质瘤细胞株的形态变化(×100)Fig 1 Morphological changes of temozolomide resistant glioma cell line
2.2 U251/TMZ 对替莫唑胺的敏感性变化
使用不同浓度梯度的TMZ 作用于U251/TMZ 和亲代细胞,采用SPSS 的Probit 程序计算IC50,结果亲代细胞的IC50为(35.62 ±2.97)μmol/L,U251/TMZ的IC50为(286.76 ±8.36)μmol/L,U251/TMZ 是亲代细胞的8.1 倍,差异具有统计学意义(t=-63.28,P=0.00)。
2.3 细胞增殖倍增的改变
U251/TMZ 和亲代细胞以相同数量接种后,于第3 天可以观察到两种细胞生长速度明显不一样,亲代细胞第3 天进入对数生长期,而U251/TMZ 生长缓慢,第4 天进入对数生长期,且生长曲线的斜率也减小,表明耐药细胞较亲代细胞增殖减慢,倍增时间增加。见图2。
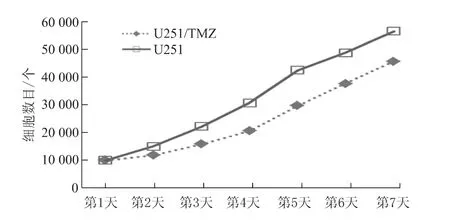
图2 U251/TMZ 与亲代U251 细胞增殖曲线Fig 2 Proliferation curve of U251/TMZ and U251 cell
2.4 U251/TMZ 细胞CD133 的表达
免疫荧光检测结果显示,亲代细胞中CD133 阳性率为(3.9 ±0.99)%,U251/TMZ 中CD133 阳性率为(65.3 ±4.16)%,差异具有统计学意义(t=45.35,P=0.00)。
2.5 U251/TMZ 细胞ABCG2 蛋白的表达
蛋白质印迹结果见图3,定量分析显示U251/TMZ 细胞ABCG2 蛋白的相对表达量为(71.3 ±25.8),明显高于亲代细胞的(0.11 ±0.3),差异具有统计学意义(t=6.19,P<0.00)。
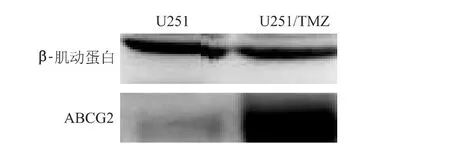
图3 U251 及U251/TMZ 细胞ABCG2 的表达Fig 3 ABCG2 expression of U251 and U251/TMZ cell
3 讨论
3.1 胶质瘤耐药细胞的培养
在体外建立耐药细胞株的常用方法为药物浓度连续递增法和大剂量冲击法[4]。这两种方法建立的细胞模型在生物学特性及形态结构方面有很大差别。浓度梯度递增法建立的细胞模型是通过化疗药物逐渐缓慢增加浓度而诱导细胞发生获得性耐药,这种方法获得的耐药性很高,细胞的形态及亚细胞结构常常发生很大的变化。大剂量冲击法是通过化疗药物大剂量、短时间内作用于细胞,从而筛选出本身就具有较强耐药性的细胞。大剂量冲击法的给药过程与临床化疗过程中的给药方法非常接近。目前认为通过大剂量冲击法建立胶质瘤耐药细胞模型,比较符合临床耐药实际[5]。为了减少临床化疗的不良反应,提高疗效,临床上常常大剂量短程给药,使药物浓度迅速地达到较高的血峰浓度,持续数天后停药,间隔一段时间后再行第2 次化疗。该模型与临床化疗耐药产生的过程相似,有助于研究临床耐药的原因。本研究采用大剂量冲击法成功建立胶质瘤耐药细胞株,其生物学特征有明显的改变,细胞生长速度减慢,增殖倍增时间延长。
3.2 U251/TMZ 耐药性的改变
多药耐药是恶性肿瘤的一种特殊生物学特征,是指恶性肿瘤细胞接触一种抗癌药后,继而对多种结构不同、作用机制各异的其他抗癌药产生耐药性。ABCG2 转运蛋白是一种与肿瘤多药耐药有关的新的药物排出泵,具有维持干细胞稳定性、维持组织细胞的稳态等生理功能,在低氧环境中ABCG2 的上调可增加肿瘤细胞对化疗药物的抗药性。ABCG2 通过结合和水解ATP 并利用能量,能转运多种化疗药物,把具有不同化学结构和作用于细胞内不同位置靶点的化疗药物泵出胞外,从而使肿瘤对多种抗癌药物产生抗药性,其表达特性与恶性肿瘤化疗效果有密切关系,高表达者化疗效果不佳,而低表达则疗效较好。本研究结果表明,U251/TMZ 细胞ABCG2的表达比亲代细胞显著增加,说明其耐药性显著性增加。U251/TMZ 的这种获得性耐药使得胶质瘤的治疗具有多变性、复杂性。
3.3 胶质瘤耐药细胞与干细胞存在相关性
GSCs 是维持胶质瘤发生、发展以及复发的关键因素[6],肿瘤干细胞是胶质瘤细胞耐药的主体细胞。而以往的观点认为,胶质瘤耐药细胞是导致胶质瘤复发的根源。那么能否认为GSCs 与胶质瘤耐药细胞就是同一类细胞呢?在本实验中,我们应用免疫荧光法检测了U251/TMZ 细胞CD133 表达情况,结果U251/TMZ 细胞CD133 阳性率显著高于亲代细胞,即有较多耐药细胞表达干细胞的特征,而不是所有的耐药细胞都表达干细胞特征。为此,我们认为胶质瘤耐药细胞与GSCs 之间存在一定相关性,两者并不是同一类细胞。这也预示了肿瘤化疗的复杂性,胶质瘤化疗耐药呈现为十分复杂的生物学过程,具有多机制、多因素的特点[7-8]。胶质瘤的先天性耐药和这种获得性化疗耐药是导致化疗复杂的根本原因。
综上所述,通过大剂量冲击法构建的耐药细胞株具有耐药性,所获得的耐药细胞株中有大量的细胞具有胶质瘤干细胞特性,提示胶质瘤化疗具有复杂多变性。
[1]Villano JL,Seery TE,Bressler LR. Temozolomide in malignant gliomas:current use and future targets[J]. Cancer Chemother Pharmacol,2009,64(4):647-655.
[2]Tabatabai G,Weller M. Glioblastoma stem cells[J]. Cell Tissue Res,2011,343(3):459-465.
[3]杨伟现,向定朝,王存祖,等. 替莫唑胺化疗对胶质瘤U251 中CD133+细胞的影响[J]. 江苏医药,2012,38(10):1124-1127.
[4]Yang LY,Trujillo JM. Biological characterization of multidrug-resistant human colon carcinoma sublines induced/selected by two methods[J]. Cancer Res,1990,50(11):3218-3225.
[5]邵泽勇,沈鼎明,伍烽,等. 两种方法建立的人肝癌细胞多药耐药模型的比较[J]. 肿瘤,2005,25(1):51-54
[6]Mclendon RE,Rich JN. Glioblastoma Stem Cells:A Neuropathologist's View[J]. J Oncol,2011,2011:397195.
[7]宗志涛,黄燕,于军. 胶质瘤耐药机制研究进展[J]. 山东医药,2011,51(2):111-112
[8]孙国臣,许百男,马晓东. 脑胶质瘤化疗耐药机制的研究进展[J]. 临床军医杂志,2011,39(2):392-394.
