非小细胞肺癌患者外周血中生存素和血管内皮细胞生长因子的表达及临床意义
2013-11-22唐兴萍李坚汪毅
唐兴萍,李坚,汪毅
(江苏大学附属医院1.呼吸科;2.中心实验室,江苏 镇江212001)
在全球范围内,肺癌的发病率和病死率居高不下,虽然近年来诊疗技术有很大的进步,但是肺癌患者的5年生存率并没有明显升高。临床上诊断为早期肺癌的患者在获得肿瘤的根治性切除后,5年生存率约60% ~70%,许多患者仍然死于肿瘤的复发和转移。这可能与肿瘤早期癌细胞经血液循环或淋巴结循环播散到远处脏器有关。实时荧光定量PCR(RT-PCR)技术的发展使得检测外周血中微量癌细胞成为可能,其检测敏感性达70% ~80%。然而,在肺癌微转移的检测中,仍缺少公认的特异分子标志物[1]。因此,我们迫切需要寻找高敏感和高特异的分子标志物,从而建立一种有效的检测肺癌患者外周血微转移的方法。本实验采用RT-PCR技术检测42例非小细胞肺癌(non-small cell lung cancer,NSCLC)患者外周血中生存素mRNA和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)mRNA的表达,以探讨其诊断NSCLC患者血循环中肿瘤细胞播散的临床价值。
1 对象和方法
1.1 病例
本研究为前瞻性研究。将2011年11月至2012年8月期间在本院就诊,经病理组织学检查确诊为NSCLC的患者42例,作为研究对象(NSCLC组),其中男26例,女16例,年龄42~88岁,平均年龄68.5岁。根据国际抗癌协会2009年修订的肺癌TNM分期标准,符合Ⅰ+Ⅱ期14例,Ⅲ+Ⅳ期28例;病理类型为鳞癌23例,腺癌19例;低分化癌9例,中高分化癌33例。选择同期诊断为肺部良性疾病患者20例作为对照(肺部良性疾病组),其中男14例,女6例,年龄18~75岁,平均年龄57岁,该组患者均同时排除合并有其他部位恶性肿瘤,其中肺炎9例,慢性支气管炎4例,结核性胸膜炎2例,硅肺、气胸、间质性肺病、脓胸、肺结节病各1例。所有受试患者均在确诊后未进行任何治疗前抽取外周血作为检测标本。所有患者皆有完整的临床资料。
1.2 方法
1.2.1 主要试剂和仪器 淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司,Trizol购自上海普飞生物公司,反转录试剂盒购自Fermentas公司,荧光定量试剂盒购自日本东洋纺公司,聚合酶链反应扩增仪和CFX96荧光定量PCR仪购自美国BioRad公司。
1.2.2 引物设计 引物序列全长选自PubMed基因库,由上海生工生物工程技术服务有限公司合成,引物序列及扩增片段,见表1。

表1 引物序列及其扩增片段长度Tab 1 Oligonucleotide sequemces of primers
1.2.3 标本的收集与总RNA的抽提 分别抽取NSCLC患者及肺部良性疾病患者静脉血4 mL,EDTA抗凝。用淋巴细胞分离液进行有核细胞的分离,用Trizol提取总RNA。
1.2.4 反转录反应 按照Fermentas试剂盒说明书提供的操作程序进行反转录反应,cDNA于-70℃保存。1.2.5 荧光定量PCR反应 每份外周血标本均扩增β-肌动蛋白、生存素及VEGF。每个反应终体积为20 μL,其中反转录产物2 μL,10 μmol/L 上下游引物各0.5 μL,SYBR10 μL,无菌水 7 μL。PCR 循环参数:95℃预变性30 s,然后按95℃ 5 s,57℃ 30 s,72℃30 s,共做40个循环。每份标本重复3次进行目的基因生存素、VEGF和内参照基因β-肌动蛋白扩增。
1.2.6 结果分析 用2-ΔΔCT的方法计算基因的相对表达水平,根据ROC曲线找出折点(上限值),对于生存素,折点≥1.48为阳性,<1.48为阴性。对于 VEGF,折点≥1.45为阳性,<1.45为阴性。
1.3 统计学分析
用SPSS 16.0软件进行统计学处理,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 生存素mRNA和VEGF mRNA在外周血中的相对表达量
生存素mRNA和VEGF mRNA在NSCLC患者和肺部良性疾病患者外周血中的相对表达量,见表2。两组间比较,差异有统计学意义(P=0.006;P=0.001)。
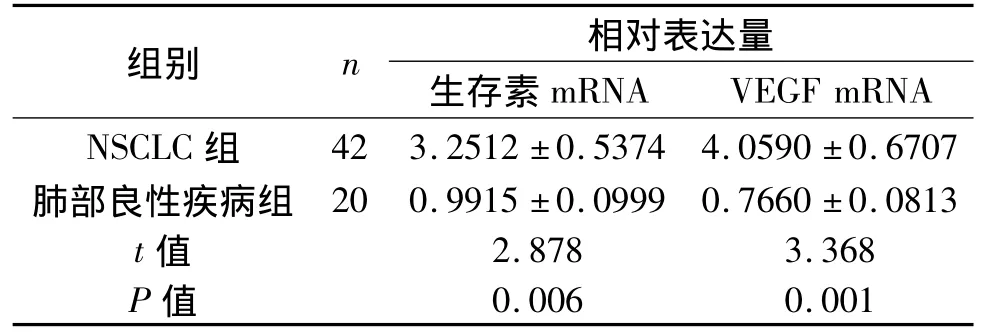
表2 生存素mRNA和VEGF mRNA在两组患者外周血中的表达Tab 2 mRNA expression of survivin and vascular endothelial growth factor in two groups
2.2 生存素mRNA和VEGF mRNA在外周血中的阳性表达
42例NSCLC患者外周血中生存素mRNA和VEGF mRNA阳性表达率分别为59.5%(25/42)和57.1%(24/42);20例肺部良性疾病患者外周血中生存素mRNA和VEGF mRNA阳性表达率分别为5%(1/20)和0%(0/20);两组间比较,差异有统计学意义(P均<0.001)。
2.3 NSCLC患者外周血中生存素mRNA和VEGF mRNA表达与临床病理特征的关系
42例NSCLC患者外周血中生存素mRNA和VEGF mRNA的阳性表达率与肿瘤的分期呈显著相关,Ⅲ期 +Ⅳ期患者外周血中生存素 mRNA和VEGF mRNA的阳性率明显高于Ⅰ期+Ⅱ期患者(P<0.001;P=0.008);与年龄、性别、吸烟、肿瘤的组织学类型及分化程度无明显相关性。见表3。
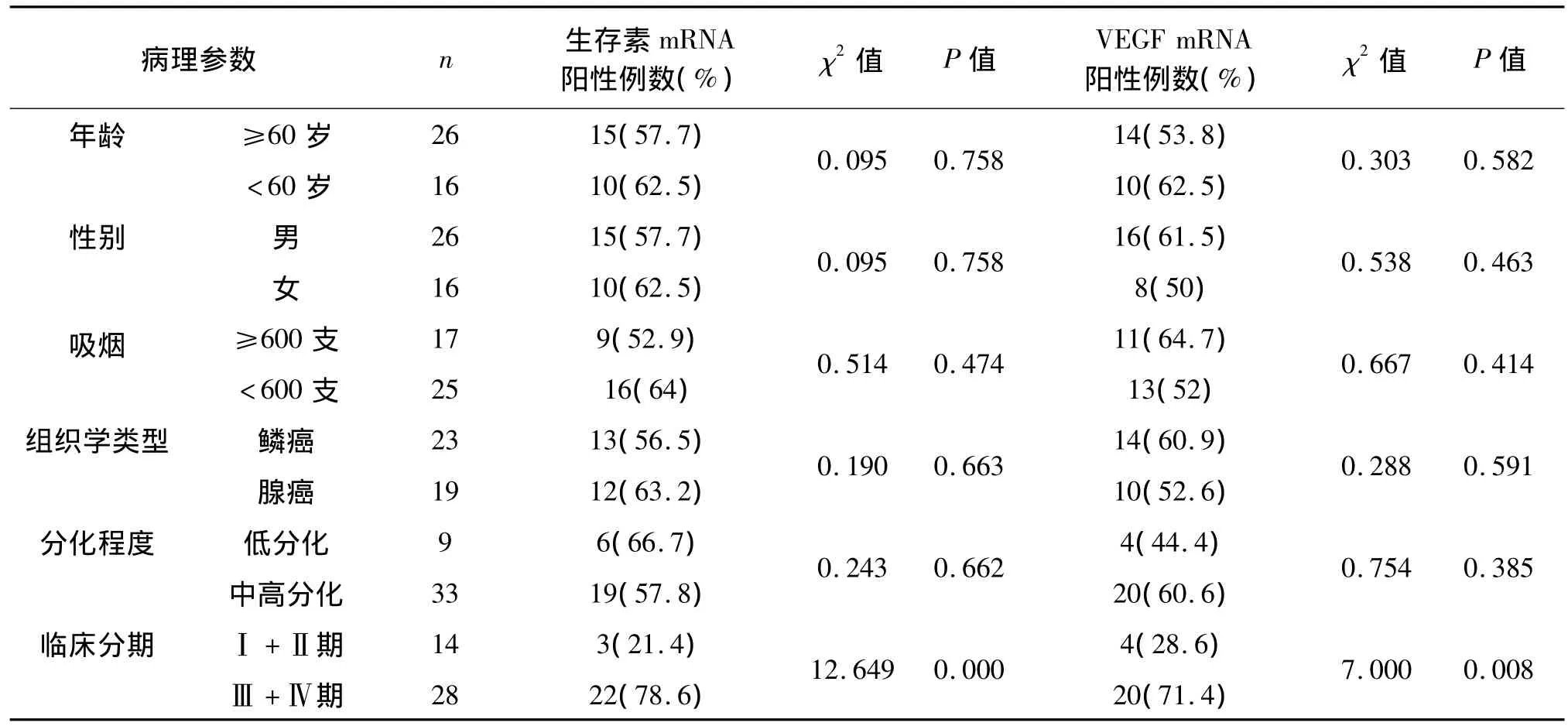
表3 NSCLC患者外周血中生存素mRNA和VEGF mRNA表达与临床病理特征的关系Tab 3 Relationship between clinical characteristics and mRNA expression of survivin and vascular endothelial growth factor in patiens with non-small cell lung cancer
2.4 生存素mRNA和VEGF mRNA联合检测的意义
检测外周血生存素mRNA和VEGF mRNA诊断肺癌具有较高的特异性和较好的敏感性,联合检测2种基因时可显著提高诊断的敏感性。见表4。

表4 外周血生存素mRNA和VEGF mRNA对NSCLC的诊断价值 %(n/n)Tab 4 Diagnostic effect of mRNA expression of survivin and vascular endothelial growth factor in peripheral blood from patients with non-small cell lung cancer
2.5 NSCLC患者外周血中生存素 mRNA与VEGF mRNA表达的相关性
生存素mRNA与VEGF mRNA在NSCLC患者外周血中共同表达有16例,生存素mRNA阳性组VEGF有9例阴性,生存素mRNA阴性组VEGF有8例阳性,根据一致性检验,结果表明两者之间无相关性(P >0.05)(表5)。
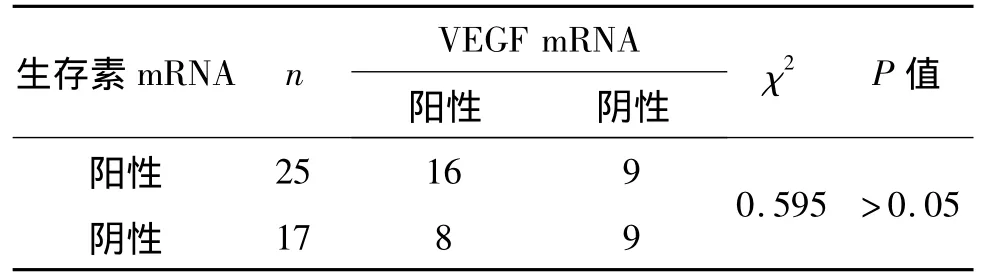
表5 NSCLC患者外周血生存素mRNA与VEGF mRNA表达的相关性Tab 5 Relationship between mRNA expression of survivin and vascular endothelial growth factor in peripheral blood from patients with non-small cell lung cancer
3 讨论
生存素是凋亡抑制蛋白家族中的重要成员,具有抑制细胞凋亡,促进细胞增生,调节细胞有丝分裂及血管生成等多种生物学功能。生存素的高表达可抑制多种因素,如Fas(CD95)、Caspase及抗癌药物等诱导的细胞凋亡。生存素在人类多种肿瘤组织中广泛表达,也表达于人类胚胎组织,但是在正常成人终末分化组织中不表达或呈低表达[2-3]。Velculescu等[4]报道,生存素几乎在所有的人类肿瘤组织中均有不同水平的表达,在100多种肿瘤特异性表达基因中,其表达的特异性排前4位。生存素在肿瘤组织高表达和在成人正常组织中低表达或不表达,这使其完全有可能成为肿瘤诊断和治疗的靶基因[5]。通过检测尿液和胸腔积液标本中的生存素mRNA表达来诊断膀胱癌和恶性胸腔积液,已被证明具有较高的敏感性和特异性,是一种无创性诊断膀胱癌和恶性胸腔积液的方法[6-9]。Shen 等[10]采用荧光定量PCR方法测定结、直肠癌患者外周血中生存素mRNA,发现其阳性率明显高于良性结肠疾病者与健康对照者,且阳性表达与肿瘤分期及淋巴结转移明显相关。Cao等[11]研究结果显示,食管鳞癌患者外周血中生存素mRNA表达水平明显高于良性疾病者及健康对照者,其阳性率与肿瘤血管侵犯、淋巴结状态和临床分期明显相关。Yie等[12]在对肺癌患者的研究中指出,在接受肿瘤切除术的NSCLC患者中,外周血中生存素mRNA阳性者肿瘤复发率明显高于生存素mRNA阴性者,生存期明显短于生存素mRNA阴性者。本研究结果显示,NSCLC患者外周血中生存素mRNA阳性表达率为59.5%,与文献报道结、直肠癌和乳腺癌患者的检测结果相似[10,13],但高于其他文献报道的肺癌和食管鳞癌的测定结果[11-12],这可能与本研究中Ⅲ+Ⅳ期NSCLC患者较多有关。我们发现,NSCLC患者外周血中生存素mRNA阳性表达与肿瘤分期呈显著相关,与其他临床病理学特征无相关性,这可能是由于在不同的研究中患者临床分期不同所致。
肿瘤血管生成是肿瘤发生和转移过程中的关键环节。VEGF是目前所知最重要的血管生长因子,它直接或间接地作用于血管生成的每一个环节,促进肿瘤组织中血管生成,肿瘤细胞的增殖、黏附、侵袭和转移。VEGF在50% ~70%的人类肺癌、乳腺癌和直肠癌组织中呈过表达,而在造血细胞上通常不表达[13],故外周血中检测到VEGF mRNA说明循环血液中存在肿瘤细胞。De Luca等[13]测定了肺癌、乳腺癌和膀胱癌患者外周血VEGF mRNA表达,其阳性率分别为57%、48%和73%,且这些患者外周血VEGF mRNA表达与其原发肿瘤组织中VEGF蛋白表达高度一致。Zhong等[14]应用 ELISA方法测定手术治疗前肝癌患者血清中VEGF,结果显示,手术后肿瘤复发患者的VEGF阳性率明显高于未复发患者,VEGF阳性患者的1年、2年和3年生存率显著低于VEGF阴性患者,表明在影像学检查未发现有显性转移而可手术的患者中,血清VEGF阳性是存在血循环隐匿性微转移的证据。本研究结果显示,VEGF mRNA在NSCLC患者中的阳性表达率明显高于肺部良性疾病组;Ⅲ+Ⅳ期 NSCLC患者VEGF mRNA的阳性率显著高于Ⅰ+Ⅱ期患者。同时,部分Ⅰ+Ⅱ期NSCLC患者外周血生存素mRNA和VEGF mRNA也呈阳性表达,提示某些无显性转移的早期可手术患者在手术之前可能已经存在肺癌的血循环转移。由于本研究中Ⅰ+Ⅱ期患者例数少,且研究时间短,因而未能评估外周血生存素mRNA和VEGF mRNA阳性表达对接受手术治疗患者预后的影响。
多数研究显示,与检测单一肿瘤特异性标志比较,联合检测外周血中的肿瘤标志可显著提高测定结果的敏感性,从而改善诊断效果[15-17]。本研究发现,联合检测外周血中生存素mRNA和VEGF mRNA的表达可提高阳性检出率。
综上所述,荧光定量PCR技术测定外周血中生存素mRNA和VEGF mRNA的表达,对于检出血循环中的肿瘤细胞,早期发现肺癌微转移有一定实用价值;其结果对于筛选出需手术前诱导化疗的非小细胞肺癌患者,实施个体化治疗具有重要的临床意义。
[1]Osaki T,Oyama T,Gu CD,et al.Prognostic impact of micrometastatic tumor cells in the lymph nodes and bone marrow of patients with completely resected stageⅠnonsmall-cell lung cancer[J].J Clin Oncol,2002,20(13):2930-2936.
[2]Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):17-21.
[3]Tamm I,Wang Y,Sausville E,et al.IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas(CD90),Bax,caspase,and anticancer drugs[J].Cancer Res,1998,58(23):5315 -5320.
[4]Velculescu VE,Madden SL,Zhang L,et al.Analysis of human transcriptomes[J].Nat Genet,1999,23(4):387-388.
[5]Fukuda S,Pelus LM.Survivin,a cancer target with an emerging role in normal adult tissues[J].Mol Cancer T-her,2006,5(5):1087 -1098.
[6]Moussa O,Abol-Enein H,Bissada NK,et al.Evaluation of survivin reverse transcriptase-polymerase chain reaction for noninvasive detection of bladder cancer[J].J Urol,2006,175(6):2312-2316.
[7]Kenney DM,Geschwindt RD,Kary MR,et al.Detection of newly diagnosed bladder cancer,bladder cancer recurrence and bladder cancer in patients with hematuria using quantitative rt-PCR of urinary survivin[J].Tumor Biol,2007,28(2):57-62.
[8]Wu YK,Chen KT,Kuo YB,et al.Quantitative detection of survivin in malignant pleural effusion for the diagnosis and prognosis of lung cancer[J].Cancer Lett,2009,273(2):331-335.
[9]Lan CC,Wu YK,Lee CH,et al.Increased survivin mRNA in malignant pleural effusion is significantly correlated with survival[J].Jpn J Clin Oncol,2010,40(3):234 -240.
[10]Shen C,Hu LH,Xia L,et al.Quantitative real-time RTPCR detection for survivin,CK20 and CEA in peripheral blood of colorectal cancer patients[J].Jpn J Clin Oncol,2008,38(11):770-776.
[11]Cao M,Yie SM,Wu SM,et al.Detection of survivin-expressing circulating cancer cells in the peripheral blood of patients with esophageal squamous cell carcinoma and its clinical significance[J].Clin Exp Metastasis,2009,26(7):751-758.
[12]Yie SM,Luo B,Ye NY,et al.Detection of Survivin-expressing circulating cancer cells in the peripheral blood of breast cancer patients by a RT-PCR ELISA[J].Clin Exp Metastasis,2006,23(5/6):279 -289.
[13]De Luca A,Pignata S,Casamassimi A,et al.Detection of circulating tumor cells in carcinoma patients by a novel epidermal growth factor receptor reverse transcription-PCR assay[J].Clin Cancer Res,2000,6(4):1439 -1444.
[14]Zhong C,Wei W,Su XK,et al.Serum and tissue vascular endothelial groth factor predicts prognosis in hepatocellular carcinoma patients after partial liver resection[J].Hepatogastroenterology,2012,59(113):93-97.
[15]Vlems FA,Diepstra JH,Cornelissen IM,et al.Investigations for a multi-marker RT-PCR to improve sensitivity of disseminated tumor cell detection[J].Anticancer Res,2003,23(1A):179-186.
[16]Chen CC,Chang TW,Chen FM,et al.Combination of multiple mRNA markers(PTTG1,Survivin,UbcH10 and TK1)in the diagnosis of Taiwanese patients with breast cancer by membrane array[J].Oncology,2006,70(4):438-446.
[17]Pu XY,Wang ZP,Chen YR,et al.The value of combined use of survivin,cytokeratin 20 and mucin 7 mRNA for bladder cancer detection in voided urine[J].J Cancer Res Clin Oncol,2008,134(6):659 -665.
