4 5 12血清型副猪嗜血杆菌外膜蛋白提取及分析
2013-11-22臧莹安李婉雁庞木生李春玲
臧莹安,李婉雁,庞木生,李 淼,宋 帅,李春玲
(1.仲恺农业工程学院动物科学系,广东 广州510225;2.广东省农业科学院兽医研究所,广东 广州510640;3.广东省兽医公共卫生公共实验室,广东 广州510640)
副猪嗜血杆菌病是近年来严重危害世界养猪业的疾病,并已证实在中国绝大多数猪场存在和流行,且流行的主要血清型为4型、5型、12型[1-2]。目前对Hps致病机理的研究日益受到国内外学者的重视。然而,对这些致病因子在致病过程中的作用机制还缺乏系统深入的了解和认识[3-4]。外膜蛋白(OMP)是重要的致病因子之一,具有良好的免疫原性,不仅可刺激机体产生良好的体液免疫反应,也可产生细胞免疫反应[5],但OMP是否为主要的免疫原仍需进一步研究[6]。且由于OMP的疏水特性,其分离和分析较为困难,从而成为当今微生物界的一个研究重点和难点。本研究通过蛋白质组学相关技术,探索4、5、12血清型副猪嗜血杆菌OMP的提取方法,为OMP的深入研究奠定基础。
1 材料与方法
1.1 菌株 4、5、12型Hps由广东省农业科学院兽医研究所猪病研究室保存。
1.2 主要仪器 SCIENTZ-ⅡD超声波细胞粉碎机,购自上海兰科仪器;Mycycler PCR仪,购自TaKaRa公司;BIO-RAD Model 680酶标仪,购自上海天呈科技有限公司;DYY-5型稳压稳流电泳仪,购自北京六一仪器厂;Tanon全自动凝胶图像分析系统,购自上海天能公司。
1.3 主要试剂 牛血清蛋白、过硫酸铵、β巯基乙酸均购自北京鼎国昌盛生物技术有限责任公司;Protein MW Marker,购自TaKaRa公司;考马斯亮蓝R-250、丙烯酰胺、N,N-甲叉双丙烯酰胺、十二烷基磺酸钠(SDS)、十二烷基肌氨酸钠、甘氨酸,N,N,N,N-四甲基乙二胺(TEMED),均购自河南华美生物工程有限公司;BCA蛋白浓度测定试剂盒,购自北京索莱宝生物技术有限公司。
1.4 试验方法
1.4.1 细菌外膜蛋白的提取 利用十二烷基肌氨酸钠结合超速离心法提取Hps的OMP。参考空肠弯曲杆菌OMP的提取方法[15],前期超声波裂解条件为:功率400W,超声3s,间隙5s,超声5min;降低超声波功率和相对延长循环时间进一步优化裂解条件,功率分别为:300、200、100、50W,循环时间分别为:10、20、30、40min。多次尝试后重新确定超声波破碎条件。
1.4.2 外膜蛋白浓度的测定 根据BCA蛋白浓度测定试剂盒的检测方法测定OMP浓度。方法如下:配制工作液,稀释标准品,然后分别加20μL样品到96孔板样品孔中,再于各孔加入200μL BCA工作液,37℃放置15~30min后用酶标仪测定OD570,以标准蛋白质浓度为纵坐标,OD570为横坐标建立标准曲线,根据标准曲线计算出蛋白浓度。待测样品蛋白浓度=待测样品OD值在标准曲线上对应的蛋白质浓度×外膜蛋白稀释倍数。
1.4.3 外膜蛋白SDS-PAGE电泳 按常规方法操作,观察结果并拍照。
2 结果与分析
2.1 外膜蛋白浓度测定结果 见图1和表1。

图1 蛋白浓度标准曲线
由图1可见,标准曲线的方程是:y=1.6173x-0.2372,R2=0.9814,依公式换算出4、5、12三种血清型OMP的平均浓度分别为0.163mg/mL、0.163 mg/mL、0.167mg/mL。
表1显示3种血清型(4、5、12)的OMP的蛋白浓度差异不显著(P>0.05)。可以说明,通过此方法提取这3种血清型的OMP的蛋白浓度差异不显著,这个提取方法具有参考价值。
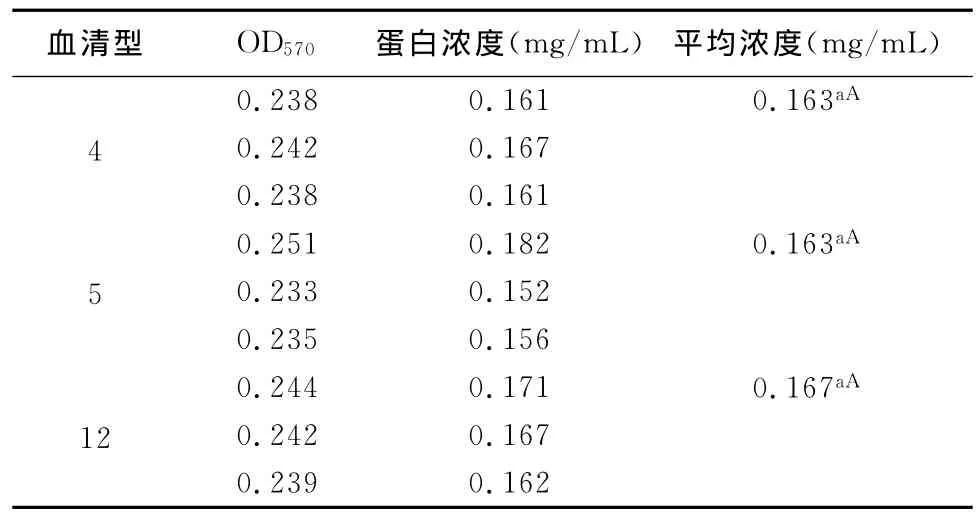
表1 待测蛋白OD570值及其对应的蛋白浓度
2.2 外膜蛋白SDS-PAGE凝胶电泳检测结果 本试验共提取了Hps的3个主要血清型(4、5、12)的OMP,前期参考空肠弯曲杆菌OMP的提取方法[15],凝胶电泳无清晰可见的蛋白条带。后多次调整,将超声波条件调整为功率96W超声破碎时间3s,间隔时间5s,循环作用30min,凝胶电泳显示蛋白条带清晰。如图3,每个血清型的OMP都有多个分子量大小不同的蛋白条带,且条带的粗细和颜色深浅不一致,说明每个血清型的OMP有多种不同的蛋白质构成,且每种蛋白质的含量都不同。不同血清型的SDS-PAGE图谱有大小相同或相近的条带,也有差距较大的条带,如4型和5型Hps的OMP条带都集中在分子质量大小60kDa~97.2 kDa之间,而12型Hps的OMP条带则集中在分子质量大小66.4kDa~200kDa之间。4型 Hps的OMP条带中,分子质量大小60kDa和62kDa为高表达蛋白;5型Hps的OMP条带中,分子质量大小60kDa、62kDa和70kDa的蛋白质为高表达蛋白;12型Hps的OMP条带中,分子质量大小70kDa、116kDa和200kDa的蛋白质为高表达蛋白。
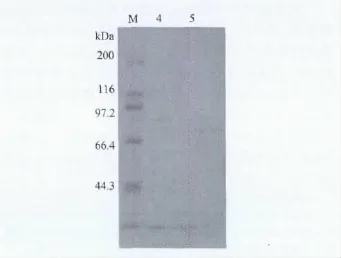
图2 探索超声波条件试验结果的SDS-PAGE分析图

图3 Hps 3种血清型(4、5、12)的外膜蛋白SDS-PAGE分析图
3 讨论
3.1 关于外膜蛋白的提取方法 常用的OMP提取方法主要有等密度梯度离心法、Sarkosyl法和碳酸钠法,这些方法耗时长,设备仪器要求高,提取步骤繁多,同时很难严格地将同属膜结构的质膜与外膜区分开来[7-9]。目前,对大肠杆菌OMP的提取一般采用超声波裂解,再用膜裂解剂十二烷基肌氨酸(Sarkosyl)提取其 OMP组分[10-11],但有研究发现使用8%的Triton X-114处理3h能有效提高OMP的提取效率[9]。沙门菌外膜蛋白的提取,成进等[12]采用尿素、EDTA作为鳌合剂,粗提品再经过丙酮沉淀和硫酸铵分级沉淀进行提纯,若需不同分子量的蛋白质组分,可在SDS-PAGE后用洗脱法制备;夏文浪等[13]在研究空肠弯曲菌67kDa OMP对淋巴细胞的多克隆激活作用时,首先将菌液超声裂解,然后用40%饱和度的(NH4)2SO4沉淀,最后再用DEAE-52离子交换层析进一步提纯。有研究显示采用甘氨酸提取、SephadexG-75纯化空肠弯曲菌28kDa~31kDa OMP系一种稳定可靠的分离层析方法[14]。本试验参考空肠弯曲杆菌OMP的提取方法[15],采用超声波裂解,再用膜裂解剂十二烷基肌氨酸提取其OMP组分。按照原来的超声波裂解条件为:功率400 W,超声3s,间隙5s,超声5min,但是结果显示,这样的超声波破碎条件所提取出来的OMP在SDS-PAGE凝胶电泳结果上没有清晰可见的蛋白条带。这可能是由于超声波功率过大的原因。所以尝试降低超声波功率并相对延长循环时间的方法重新确定超声波裂解条件为:功率96W超声破碎时间3s,间隔时间5s,循环作用30min,SDS-PAGE凝胶电泳显示蛋白条带清晰,结果显示良好。
3.2 关于外膜蛋白浓度的测定 用Bradford检测方法测定副猪嗜血杆菌3种血清型(4、5、12),OMP的平均浓度分别为0.163mg/mL、0.163mg/mL、0.167mg/mL。标准方程的决定系数是R2=0.981 4,说明此次测定结果与真实值较接近,测定结果的准确性较高。测定OMP的浓度,对于进一步分析全菌中OMP的含量有重要作用,而OMP是Hps的毒力因子之一,是分析Hps致病性的重要因素之一。因此,测定OMP的浓度,也是推测Hps致病力强弱的重要依据。
3.3 关于SDS-PAGE凝胶电泳 本次SDS-PAGE凝胶电泳采用的是传统的方法。结果显示,每个血清型的OMP并不仅仅有一种蛋白质,而是有多种不同的蛋白质,且每种蛋白质的含量都不同,不同血清型Hps的OMP有分子量大小相同的蛋白,也有分子量大小不同的蛋白,且不同血清型副猪嗜血杆菌的膜蛋白结果有相似性。但各血清型膜蛋白的具体情况和差异还有待于进一步研究。分析OMP的分子质量大小,是进一步掌握OMP结构和组成的基础,也是研究和分析OMP免疫功能的前提条件。
目前的大多数研究中,还是以全菌研究为主,也许是由于半菌的毒力不足以达到相应的毒力,进而影响到试验结果[16]。某些细菌的不同血清型间有相同的OMP免疫原性,可以产生交叉保护作用,这不仅为开发OMP亚单位疫苗提供了理论基础,而且为疾病的诊断提供了特异性抗原,今后必将成为细菌领域的研究重点之一。
[1] 陆承平.兽医微生物学[M].4版.北京:中国农业出版社,2007:144-146.
[2] 万世平,王建,葛菲菲,等.副猪嗜血杆菌主要毒力因子和致病机理的研究进展[J].畜牧与兽医,2010,42(10):101-104.
[3] Handfield M,Levesque R C.Strategies for isolation of in vivo expressed genes from bacteria[J].FEMS Microbiol.Rev,1999,23:69-91.
[4] Morozumi T ,Nicolet J.Some antigenic properties ofHaemophilusparasuisand a proposal for serological classification[J].J Clin Microbiol,1986b,23(6):1022-1025.
[5] Kielstein P,Rapp Gabrielson V J.Designation of 15serovars ofHaemophilusparasuison the basis of immunodiffusion using heat stable antigen extract s[J].J Clin Microbiol,1992,30(4):862-865.
[6] Zhang L J,Xie J Y,Wang X E.Proteomic analysis of mouse liver plasema membrance,use of differential extraction to enrich hydrophobic membrance proteins[J].Proteomics,2005,5(17):4510-4524.
[7] Neidhardt L,Gasca S,Herrmann B G,etal.Large scale screen for genes controlling mammalian embroygenesis,using high-throughput gene expression analysis in mouse embryos[J].Mech Dev,2000,98(1-2):77-94.
[8] Ruiz A,Oliveira S,Torremorell M,etal.Outer membrane protein in strains ofHaemophilusparasuisrecovered from systemic and respiratory sites[J].J Clin Microbial,2001,39:1757-1762.
[9] 夏金兰,欧阳叙东,张成桂,等.大肠杆菌外膜蛋白的分离及其双向电泳图谱的建立[J].现代生物医学进展,2009,9(2):201-215.
[10]高崧,刘秀梵,张如宽.一种快速提取禽源性大肠埃希氏菌外膜蛋白的方法[J].微生物学通报,1996,23(2):122-124.
[11]Kapur V,White D G,Richard A,etal.0uter menbrane protein patterns mark clones of Escherichia coli O2and O78 strains that cause avian septicemia[J].Infection and Immunity,1992,60(4):1687-1691.
[12]成进,李文蓉,谷文喜,等.鸡沙门氏菌外膜蛋白的免疫效果观察[J].中国预防兽医学报,2000,22(1):21-24.
[13]夏文浪,马宝骊,黄冬生,等.空肠弯曲菌67kD外膜蛋白的提取及其对淋巴细胞的多克隆激活作用[J].中国免疫学杂志,1992,8 (1):14-17
[14]冯胜军,孙万邦,姚新生,等.空肠弯曲菌28kDa-31kDa外膜蛋白的初步提取及鉴定[J].中国卫生检验杂志,2005,15(2):129-131.
[15]曹江,贾振宇.蛋白组学与人类疾病研究[J].中国实验诊断学,2001,5(5):277-279.
[16]张婧,张东霞,王玉.副猪嗜血杆菌研究进展[J].中国动物保健,2010(5):33.
