稳定转染pGM-CSF基因的哺乳动物细胞系的建立
2013-11-22陶弼菲高其双陈志华占才耀钱运国王莲芳黄海军
陶弼菲,高其双,陈志华,向 敏,占才耀,钱运国,夏 瑜,华 娟,王莲芳,任 远,黄海军
(武汉市畜牧兽医科学研究所,湖北 武汉430208)
巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)为糖基化蛋白,分子量为18~23kD,由活化的T淋巴细胞、B淋巴细胞、巨噬细胞、成纤维细胞、血管内皮细胞等多种细胞产生。GM-CSF是一种具有多项潜能的造血生长因子,可以刺激和活化巨噬细胞、嗜中性粒细胞和各种APCs的增殖、分化,常用作DNA疫苗的免疫佐剂,以克服DNA疫苗免疫原性差的缺陷[1]。目前,GM-CSF已被广泛应用于医学疫苗佐剂的研究,在细菌性和病毒性疾病、真菌及寄生虫感染和恶性肿瘤等方面具有广阔的应用前景[2-4]。
但是,将pGM-CSF作为高效疫苗佐剂广泛应用,需要寻找一种经济简捷、便于大量表达的系统。目前国内外关于pGM-CSF的表达研究相对较少,且尚未建立稳定表达pGM-CSF的哺乳动物转基因细胞系。本试验建立稳定转染且高效表达pGMCSF的BHK-21转基因细胞株,为下一步从细胞培养物中提取目的蛋白并最终开发出一种用于提高动物疫苗免疫效力的新型生物制剂奠定基础。
1 材料与方法
1.1 主要试剂 转染试剂Lipofectamine 2 000和筛选试剂G418,均由Invitrogen公司生产;DMEM高糖培养基、新生牛血清、胰蛋白酶、PBS,由Gibco公司生产;限制性内切酶EcoRⅠ、XhoⅠ、T4DNA连接酶、TaqDNA 聚合酶、DNA Marker、DNA Gel Extraction Kit,由华美生物工程公司生产;RNeasy Mini RNA提取试剂盒,由Qiagen(德国)公司生产;蛋白胨和酵母浸提液,由Oxoid公司生产;猪粒细胞巨噬细胞集落刺激因子(pGM-CSF)ELISA检测试剂盒,由US Biological公司生产;引物由上海生工生物工程技术服务有限公司合成。
1.2 菌种、质粒和细胞 大肠杆菌DH5α为本室保存;质粒pMD18-T,由TaKaRa公司提供。质粒载体pIRES2-EGFP- pGM-CSF,由本实验室构建[5]。BHK-21细胞,购自武汉中博生物股份有限公司,在本实验室传代保存。
1.3 建立稳定转染猪PGM-CSF的BHK-21细胞系 将复苏后传代3次的BHK-21细胞消化,用含10%新生牛血清的高糖DMEM培养基调成1×105个/mL的密度,接种于若干个直径为35mm的培养皿中,于37℃、5%CO2细胞培养箱中培养24h,每种类型细胞挑选细胞融合至70%~80%、生长状态较好的组,按照Lipofeetamine 2 000操作说明书进行细胞转染操作,脂质体、质粒每孔添加量均为6 μL,对照组不加脂质体。6h后更换有血清无双抗的DMEM培养基。转染48h后,开始用G418筛选,前5天200μg/mL,接着用1 000μg/mL的浓度继续筛选,直至绝大部分细胞死亡,并且长出新的细胞集落。将G418浓度改为2 000μg/mL维持筛选4周。
1.4 单个细胞筛选法建立高效转基因细胞株 将获得的转pGM-CSF的BHK-21细胞采用极限稀释法传至96孔细胞培养板,每孔大约1个细胞,使用G418(1 000μg/mL)培养基至其长出单个克隆集落,在荧光显微镜下挑选出最优的细胞克隆集落继续扩繁培养。
1.5 PCR方法检测转基因细胞中目的基因的表达应用TRIZOL Reagent试剂盒并按其说明书分别提取转pGM-CSF的BHK-21细胞和正常未转染的BHK-21细胞总RNA。反转录的cDNA产物用DNaseⅠ37℃处理20min以去除基因组DNA污染。所用引物:P1:5′-CTCAGAAGGATGTGGC-3′,P2:5′-TTACTTTTTGACTGGC-3′。PCR 反应体系为25μL。反应条件:94℃预变性4min,94℃变性30s,59℃退火40s,72℃延伸45s,共35个循环。最后一轮72℃延伸10min。反应结束后取3μL产物做1%琼脂糖凝胶电泳,在凝胶成像分析系统中观察结果。
1.6 ELISA方法测定转基因细胞培养上清中目的蛋白表达水平 按照猪粒细胞巨噬细胞集落刺激因子(pGM-CSF)ELISA检测试剂盒的说明书检测上述转基因细胞株培养上清中pGM-CSF蛋白的表达水平。
2 结果与分析
2.1 单个细胞筛选法建立高效转基因细胞株 通过单个细胞筛选法建立了高效转pGM-CSF基因的BHK-21细胞株9个。其建立过程见图1。
2.2 PCR方法检测转基因细胞中目的基因的转录情况 通过PCR方法,在转基因细胞中检测到目的基因pGM-CSF基因的转录(图2)。
2.3 Elisa方法测定转基因细胞培养上清中目的蛋白表达水平 用“Curve Exert 1.3”软件绘制ELISA标准曲线(图3)。结果为 Y=1.4177889+371.67168X+69.318336X2(其中X为OD值,Y为对应的样品浓度),将该结果Y乘以相应的稀释倍数即为细胞培养上清中外源蛋白pGM-CSF的真实浓度。ELISA检测结果显示,转基因细胞培养上清中pGM-CSF表达水平达到329.37±13.76ng/mL(表1)。
3 讨论
医学研究表明,GM-CSF基因是目前激活免疫系统的最有效基因[6]。在生物技术制药领域,重组人GM-CSF已在大肠杆菌、植物细胞如烟草、昆虫细胞、家蚕细胞等以及小鼠和大鼠体内获得表达,各种体系所表达的重组GM-CSF与天然GM-CSF多少有些差异,或者活性较低,或者存在完全性隐患。据报道,哺乳动物体系如COS细胞表达的人GMCSF与天然的人GM-CSF有相同的生物学活性,但表达水平较低,在0.05μg/mL~0.07μg/mL[7]。如何建立完善的哺乳动物细胞表达体系,仍然有许多环节需要系统深入的研究。
在生物制药中广泛使用的哺乳动物细胞,主要有中国仓鼠卵巢细胞系(Chinese hamster ovary cell line,CHO)和仓鼠幼肾细胞系(Baby hamster kidney,BHK)等细胞。由BHK-21细胞构建的转基因细胞或称工程细胞,已广泛用于预防和治疗性生物技术药物的生产,如基因工程乙型肝炎(乙肝)疫苗、促红细胞生成素、纤溶蛋白激活剂等,并取得了巨大社会效益和经济效益。

图1 转pGM-CSF基因的BHK-21细胞株建立过程

图2 转基因细胞中目的基因pGM-CSF的转录
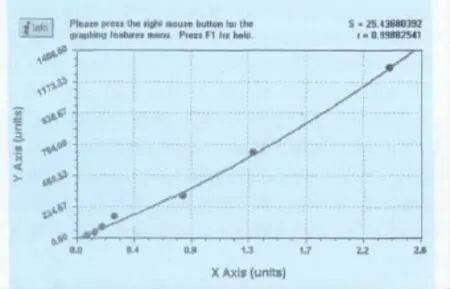
图3 pGM-CSF标准曲线的绘制

表1 细胞培养上清中外源蛋白pGM-CSF的含量
猪GM-CSF的表达研究在国内还处于起步阶段,在国外也并不完善,尚无建立稳定表达猪GMCSF的哺乳动物细胞系的报道[8-10]。本试验采用单个细胞克隆筛选法建立了高效转pGM-CSF基因的BHK-21细胞株9个,一方面证实该技术具有较好的普遍实用性且成本低廉,对细胞损伤影响也不大。另一方面为下一步研究pGM-CSF蛋白的表达、纯化及作为高效疫苗佐剂的制备奠定了基础。
[1] Metcalf D.The molecular biology and functions of the granulocyte-macrophage colony-stimulating factors[J].Blood,1986,67:257-267.
[2] Barouch D,Santra S,Tenner-Racz K,etal.Potent CD4+ T cell responses elicited by a bicistronic HIV-1DNA vaccine expressing gp120and GM -CSF[J].The Journal of Immunology ,2002 ,168:562-568.
[3] Cho J,Lee S,Sung Y.Enhanced cellular immunity to hepatitis C virus nonstructural proteins by codelivery of granulocyte m acrophage-colony stimulating factor gene in intramuscular DNA immunization[J].Vaccine,1999,17:1136-1144.
[4] Pu O,Hwang L,Tao M,etal.Codelivery of GM-CSF gene enhances the immune responses of hepatitis C viral core protein-expressing DNA vaccine:role of dendritic cells[J].Journal of Medical Virology,2002,66:320-328.
[5] 黄海军,高其双,钱运国,等.猪GM-CSF基因的克隆及其真核表达载体的构建[J].生物技术通报,2012,4:112-116.
[6] Jaffee E,Hruban R,Biedrzycki B,etal.Novel allogeneic granulocyte-macrophage colony-stimulating factor-secreting tumor vaccine for pancreatic cancer:aphase I trial of safety and immune activation[J].J Clin Oncol,2001,1;19(1):145-156.
[7] Wong G,Witek J,Temple P,etal.Human GM-CSF:Molecular cloning of the complementary DNA and purification of the natural and recombinant proteins[J].Scinece,1985,228:810-815.
[8] Loudon P,Yager E,Lynch D,etal.GM-CSF increases mucosal and systemic immunogenicity of an H1N1influenza DNA vaccine administered into the epidermis of non-human primates[J].PLoS One,2010,8;5(6):e11021.
[9] Jeong H,Song Y,Lee S,etal.Comparative measurement of cell-mediated immune responses of swine to the M and N proteins of porcine reproductive and respiratory syndrome virus[J].Clin Vaccine Immunol,2010,17(4):503-512.
[10]Melkebeek V,Van den Broeck W,Verdonck F,etal.Effect of plasmid DNA encoding the porcine granulocyte-macrophage colony-stimulating factor on antigen-presenting cells in pigs[J].Vet Immunol Immunopathol,2008,15;125(3-4):354-360.
