外周血内皮祖细胞与极低出生体重早产儿并发症发生相关性
2013-11-21祁媛媛钱莉玲
祁媛媛 姜 茜 陈 超 曹 云 钱莉玲
内皮祖细胞(EPCs)是一类具有自我更新和高度增殖能力的血管前体细胞,可以在某些病理因素的刺激下由骨髓动员至外周血循环中,参与血管重建和新生[1]。同时,EPCs还可以释放相关因子包括血管内皮生长因子(VEGF)、基质细胞衍生因子(SDF-1)等,从而促进血管生成、减少凋亡,一些生长因子如VEGF等可以促进EPCs的动员。成人的研究显示,骨髓来源的EPCs可促进缺血及血管损伤组织的血管修复,在急性肺损伤/急性呼吸窘迫综合征、心血管疾病等中均起重要作用[2,3]。有文献报道严重视网膜黄斑退化的患者外周血CD34+细胞的数量减少,内皮集落形成能力减弱[4]。近来年,EPCs在早产儿血管异常中的作用也越来越受到关注[5~7]。
Balasubramaniam等[8]发现高氧使新生小鼠 EPCs降低,从而使肺血管生长受损,肺泡生长障碍。晚近的临床研究显示发生BPD的早产儿出生时的脐血EPCs集落数减少[9,10],提示出生时 EPCs减少可能参与了 BPD的发生。然而,另一项研究未发现出生时外周血EPCs与BPD发生的相关性[11]。这些结果的差异提示脐血并不能代表外周血EPCs的水平,因为生后外周血EPCs水平受氧、炎症损伤等多种因素的影响。而目前仍无研究系统地评估EPCs在早产儿并发症中的作用。那么,EPCs在早产儿相关并发症中的作用究竟如何?本研究分析生后不同时点EPCs的动态变化,及其与不同早产并发症的相关性。
1 方法
1.1 纳入和排除标准 ①2011年7月至2012年4月复旦大学附属儿科医院(我院)NICU住院的、胎龄<32周的、出生体重<1 500 g的和生后6h内入我院的新生儿,并排除未取得知情同意的、病情不稳定的和存在明显先天畸形者。1.2 数据剔除标准 观察结束后数据分析时,剔除染色体畸形、青紫型先天性心脏病、慢性宫内缺氧、换血治疗、败血症、放弃治疗出院或死亡等病例的数据。
1.3 诊断、分组和伦理BPD组:纠正胎龄36周仍需氧疗维持正常氧合,X线胸片显示双肺不同程度的肺纹理增多模糊或毛玻璃影、囊泡形成、线状及网格状影;ROP组:参照ROP国际标准(ICROP)诊断[12];IVH组:通过头颅B超或头颅影像学检查诊断;对照组:未发现BPD、ROP和IVH的住院早产儿。本研究方案获得我院伦理委员会审核批准。
1.4 标本收集及处理
1.4.1 标本采集 于出生时,生后7、14、21和28d及纠正胎龄36周时,取临床必要的抽血检查的剩余动脉抗凝血标本。1.4.2 外周血EPCs检测 用流式细胞分析仪检测外周血EPCs水平。取外周血100μL,分别加入10μL CD34-FITC抗体(美国 BD 公司)、10μL KDR-PE 抗体(R&D 公司)和CD133-APC(Meltenyi公司)抗体,同时对照管加入100μL标本,分别加入CD34、CD133和KDR同型对照抗体,室温避光孵育20 min。加入1mL溶血素溶解红细胞,离心后加入去离子水待检测。采用不同的表面分子组合CD34+KDR+、KDR+CD133+、CD34+KDR+CD133+细胞代表EPCs水平,CD34+、CD133+细胞代表骨髓来源的干/祖细胞水平。
1.4.3 血浆SDF-1、VEGF和GM-CSF检测 参照SDF-1、VEGF和GM-CSF因子ELISA试剂盒(R&D公司)说明书操作。
1.5 统计学方法 采用SPSS 17.0统计软件进行分析。连续变量采用±s表示,组间比较采用t检验,非连续变量用计数或率表示,率的比较采用χ2检验或Fisher's精确检验。(P<0.05)为差异有统计学意义。
2 结果
2.1 一般情况 研究期间101例极低出生体重儿符合纳入排除标准,经数据剔除标准检验后,最终68例极低出生体重早产儿进入本文分析(图1)。
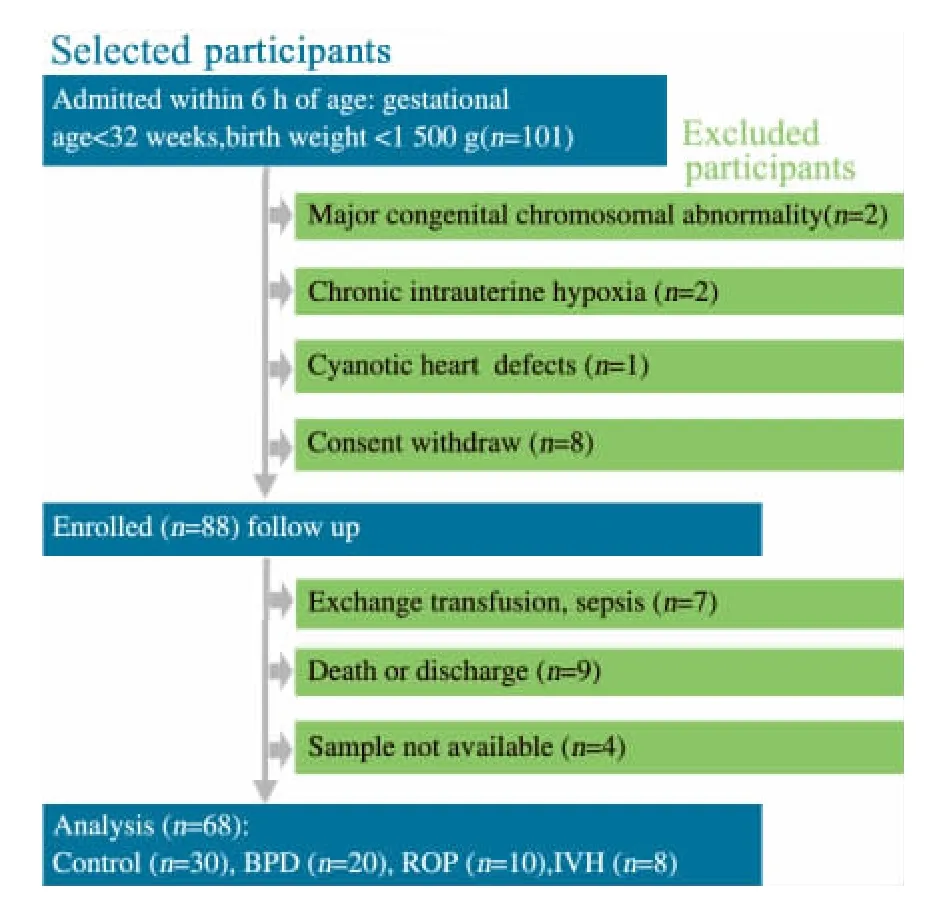
图1 研究对象纳入和排除流程图Fig 1 Flow chart of including and excluding procedure of study subjects
平均胎龄(29.3±1.6)周,平均出生体重(1 246±228)g。BPD组20例,ROP组10例,IVH组8例,对照组30例。BPD组、ROP组和IVH组的胎龄、出生体重差异无统计学意义,但BPD组、ROP组的胎龄均低于对照组,差异有统计学意义(表1)。
表1 4 组患儿的基线资料[±s,M(range),n(%)]Tab 1 Baseline characteristics of infants in four groups[ ± s,M(range),n(%)]
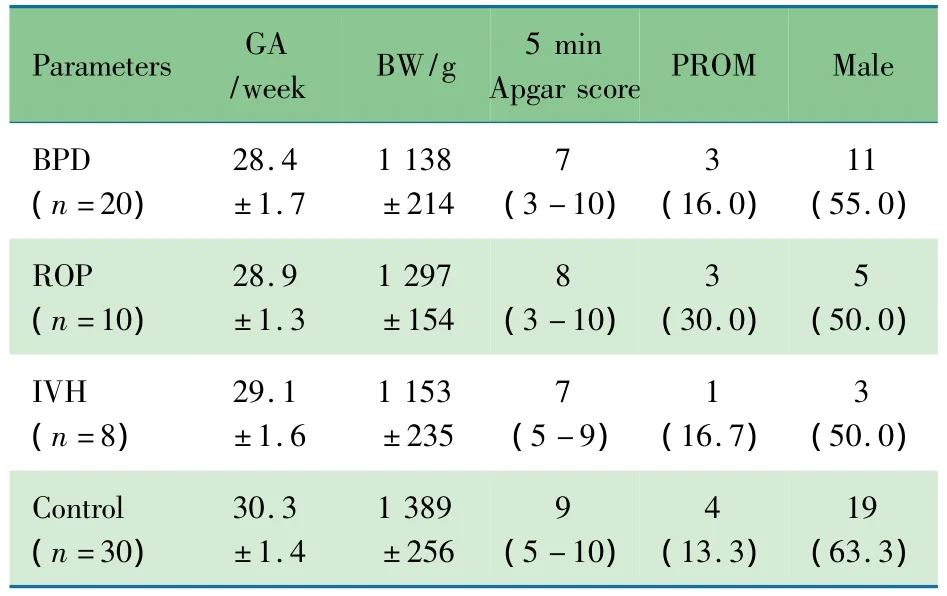
表1 4 组患儿的基线资料[±s,M(range),n(%)]Tab 1 Baseline characteristics of infants in four groups[ ± s,M(range),n(%)]
Notes GA:gestational age;BW:birth weight;PROM:premature rupture of membranes;BPD:bronchopulmonary dysplasia;ROP:retinopathy of prematurity;IVH:intraventricular hemorrhage.BPD vs control(GA,P=0.000,BW,P=0.000,Apgar score,P=0.005);ROP vs control(GA,P=0.016);IVH vs control(BW,P=0.023).Other variables had no siginificant difference between ROP,BPD,IVH and control groups
Parameters GA/week BW/g 5 min Apgar scorePROM Male BPD(n=20)28.4±1.7 1 138±214 7(3-10)3(16.0)11(55.0)ROP(n=10)28.9±1.3 1 297±154 8(3-10)3(30.0)5(50.0)IVH(n=8)29.1±1.6 1 153±235 7(5-9)1(16.7)3(50.0)Control(n=30)30.3±1.4 1 389±256 9(5-10)4(13.3)19(63.3)
2.2 BPD组和对照组外周血EPCs水平比较 图1显示,BPD组和对照组出生时点CD34+细胞水平均最高,7d时点明显下降。与7d时点相比,CD34+细胞水平在随后的不同时点中有轻微的下降趋势,但差异无统计学意义。出生时点BPD组和对照组WBC计数差异无统计学意义,(12.7±8.1)×109·L-1vs(9.3±6.5)×109·L-1,P=0.153。BPD组与对照组出生时点EPCs水平差异无统计学意义。生后 7d时点 CD34+KDR+、KDR+CD133+及CD34+KDR+CD133+EPCs水平BPD组均较对照组明显降低,CD34+KDR+:(0.019 ±0.009)% vs(0.026±0.012)%,KDR+CD133+:(0.004±0.002)%vs(0.008±0.004)%,CD34+KDR+CD133+:(0.005±0.002)%vs(0.008±0.004)%;P均<0.05。生后14d时点EPCs水平BPD组较对照组有下降趋势,但差异无统计学意义。生后21d时点的CD34+KDR+细胞水平BPD组也较对照组下降,(0.016±0.010)%vs(0.023±0.012)%,(P<0.05)。在生后28d和纠正胎龄36周时点两组EPCs水平差异无统计学意义。

图2 BPD、ROP、IVH与对照组患儿生后不同时点外周血EPCs比较Fig 2 Comparisons of circulating EPCs among control,BPD,ROP and IVH infants atdifferent time points
表2显示,从出生至生后21d时点,VEGF水平BPD组均较对照组显著降低,差异有统计学意义。各观察时点SDF-1和GM-CSF水平BPD组与对照组差异均无统计学差异。
2.3 ROP组和对照组外周血EPCs比较 图1显示,出生时CD34+、CD133+细胞水平ROP组较对照组显著升高,CD34+:(0.970±0.551)%vs(0.667±0.323)%,CD133+:(1.466±0.693)%vs(0.207±0.306)%;P均<0.05。出生时 CD34+KDR+、KDR+CD133+和 CD34+KDR+CD133+EPCs细胞水平在两组间差异无统计学意义。生后7d时点,CD34+和CD133+细胞及EPCs水平两组差异均无统计学意义。生后14、21和28d时点ROP组与对照组外周血EPCs水平差异无统计学意义。在纠正胎龄36周时,外周血KDR+CD133+EPCs和CD34+KDR+CD133+EPCs水平ROP组较对照组有升高的趋势,KDR+CD133+:(0.010±0.003)%vs(0.007±0.003)%,P=0.053;CD34+KDR+CD133+:(0.009±0.005)% vs(0.006± 0.003)%,P=0.061。
2.4 IVH组和对照组外周血EPCs比较 图1显示,出生时CD34+细胞水平和EPCs细胞水平IVH组与对照组差异无统计学意义。在生后7d时点,ICD34+、CD133+和CD34+CD133+细胞水平IVH组较对照组明显升高,CD34+:(0.642±0.323)% vs(0.370±0.137)%,CD133+:(0.516±0.289)%vs(0.277± 0.103)%,CD34+CD133+:(0.499±0.283)%vs(0.235±0.113)%;P均<0.05;而EPCs水平差异无统计学意义。在随后的各观察时点两组的EPCs水平差异无统计学意义。
表2 细胞因子在BPD组与对照组不同时点比较±s)Tab 2VEGF,SDF-1,and GM-CSFplasma concentrations in control and BPD infants±s)

表2 细胞因子在BPD组与对照组不同时点比较±s)Tab 2VEGF,SDF-1,and GM-CSFplasma concentrations in control and BPD infants±s)
Notes BPD:bronchopulmonarydysplasia;VEGF:vascular endothelial growth factor;SDF-1:stromal cell-derived factor-1;GM-CSF;granulocytemacrophage colony-stimulating factor
Group 0d 7d 14d 21d 28d VEGF/pg·mL-1 BPD 198.2±156.4 394.3±127.9 400.8±78.9 287.4±163.9502.8±202.8 Control 768.6±445.2 741.1±434.5 602.0±240.1 648.5±412.5 534.8±307.4 P 0.040 0.028 0.031 0.043 0.895 SDF-1/ng·mL-1 BPD 2.0±1.2 2.3±0.8 2.7±0.9 2.9±0.8 2.6±0.6 Control 3.1±0.7 3.3±0.4 3.3±0.7 3.6±0.8 2.9±0.7 P 0.180 0.191 0.236 0.168 0.268 GM-CSF/ng·mL-1 BPD 1.6±1.5 2.6±1.8 2.2±0.8 2.5±1.3 1.9±1.1 Control 2.9±0.5 4.5±1.5 2.8±1.5 4.0±2.4 3.2±2.8 P 0.157 0.138 0.415 0.1360.094
3 讨论
EPCs在血管的生成、维持和修复中均起重要的作用,多项研究显示EPCs参与了血管性疾病的发生。本文采用流式细胞仪检测外周血EPCs的水平。值得注意的是,目前国际上对EPCs的定义及检测方法仍未形成统一标准。通常采用的方法包括细胞培养集落计数和流式细胞仪检测。这两种方法的检测结果可能不一致[13]。细胞培养需要在外界环境中培养一定的时间,且不能完全反映体内的生物学特性;而流式细胞仪通过检测细胞的表面抗原快速评价EPCs水平,更适于临床应用。目前常用的检测EPCs的表面标记包括CD34、KDR和CD133,每种标记可能代表了EPCs分化的不同阶段[14,15]。本研究采用了3种标记的组合 CD34+KDR+、KDR+CD133+和 CD34+KDR+CD133+代表EPCs水平。
EPCs与BPD发生的相关性近年来的研究显示了不同的结果。Borghesi等[9]发现出生时脐血EPCs集落和外周血EPCs水平低的患儿发生BPD的风险增加。而Paviotti等[11]研究显示出生时流式细胞仪检测的EPCs水平与BPD的发生不相关。与以上结果不同,一项晚近的研究发现出生时EPCs水平高的患儿易发生BPD,但该研究未排除胎龄的影响[16]。本研究未发现出生时EPCs水平与BPD发生的关系,但BPD组胎龄显著低于对照组。目前已证实胎龄与生后尤其是48h内的祖细胞水平呈负相关[17],这可能是两组EPCs未发现差异的原因。本研究发现BPD组生后7d时点的EPCs水平较对照组明显下降,这在既往文献中未见报道。提示生后早期EPCs水平降低可能参与了早产儿BPD的发生。
VEGF信号通路在生后早期血管和肺泡发育中起重要的作用[18,19]。动物研究显示新生儿期阻断VEGF受体会造成肺结构破坏,产生与 BPD病理相同的表现[20,21]。同时,VEGF还是重要的EPCs动员调节因子[22]。本研究发现与对照组相比,BPD组血浆VEGF水平从出生到生后21d均明显降低。由此推测VEGF的降低是导致EPCs降低及肺血管发育异常的原因。然而,VEGF降低的机制及与EPCs降低的因果关系仍需进一步研究。
ROP的发生与视网膜毛细血管的发育异常密切相关。在本研究中,ROP组出生时骨髓来源的循环干/祖细胞较对照组明显升高,与以往的研究结果一致[9]。然而,ROP组胎龄明显低于对照组,可能是循环CD34+细胞增高的原因。有研究显示,发生ROP的早产儿生后10周外周血EPCs水平显著高于未发生ROP的患儿[23]。本研究中出生时、生后7~28d均未发现ROP组和对照组患儿EPCs水平的差异,但在纠正胎龄36周时ROP组外周血EPCs有高于对照组患儿的趋势,与以往研究结果相似。但EPCs的动态变化在ROP发生中的作用及机制仍需深入研究。另外,本研究发现生后7d时点IVH组CD34+细胞水平升高,这可能与出血、血管损伤促进骨髓干/祖细胞动员有关。EPCs在IVH的作用仍不确定,需进一步的研究。
[1]Iwami Y,Masuda H,Asahara T.Endothelial progenitor cells:past,state of the art,and future.J Cell Mol Med, 2004,8(4):488-497
[2]Kubo H.Is cell therapy in acute lung injury a realistic dream?Am J Respir Crit Care Med,2005, 172(7):794-795
[3]Urbich C, Dimmeler S.Endothelial progenitor cells:characterization and role in vascular biology.Circ Res, 2004,95(4):343-353
[4]Yodoi Y, Sasahara M, Kameda T, et al.Circulating hematopoietic stem cells in patients with neovascular agerelated macular degeneration.Invest Ophthalmol Vis Sci,2007,48(12):5464-5472
[5]Strauss T, Metsuyanim S, Pessach I, et al.Analysis of circulating hem-endothelial marker RNA levels in preterm infants.BMC Pediatr, 2009, 9:42
[6]Abman SH.Bronchopulmonary dysplasia:"a vascular hypothesis".Am J Respir Crit Care Med,2001,164(10 Pt 1):1755-1756
[7]Stenmark KR, Abman SH.Lung vascular development:implications for the pathogenesis of bronchopulmonary dysplasia.Annu Rev Physiol, 2005, 67:623-661
[8]Balasubramaniam V, Mervis CF, Maxey AM, et al.Hyperoxia reduces bone marrow, circulating, and lung endothelial progenitor cells in the developing lung:implications for the pathogenesis of bronchopulmonary dysplasia.Am J Physiol Lung Cell Mol Physiol, 2007, 292(5):L1073-1084
[9]Borghesi A, Massa M, Campanelli R, et al.Circulating endothelial progenitor cells in preterm infants with bronchopulmonary dysplasia.Am J Respir Crit Care Med,2009,180(6):540-546
[10]Baker CD, Balasubramaniam V, Mourani PM,et al.Cord blood angiogenic progenitor cells are decreased in bronchopulmonary dysplasia.Eur Respir J, 2012, 40(6):1516-1522
[11]Paviotti G, Fadini GP, Boscaro E, et al. Endothelial progenitor cells, bronchopulmonary dysplasia and other shortterm outcomes of extremely preterm birth. Early Hum Dev,2011, 87( 7) : 461-465
[12]International Committee for the Classifi cation of Retinopathy of Prematurity.The International Classifi cation of Retinopathy of Prematurity revisited.Arch Ophthalmol,2005,123:991-999
[13]Case J, Mead LE, Bessler WK, et al.Human CD34+AC133+VEGFR-2+cells are not endothelial progenitor cells but distinct, primitive hematopoietic progenitors.Exp Hematol,2007,35(7):1109-1118
[14]Yamada M,Kubo H,Ishizawa K,et al.Increased circulating endothelial progenitor cells in patients with bacterial pneumonia:evidence that bone marrow derived cells contribute to lung repair.Thorax, 2005,60(5):410-413
[15]Fadini GP, Sartore S, Albiero M, et al.Number and function of endothelial progenitor cells as a marker of severity for diabetic vasculopathy.Arterioscler Thromb Vasc Biol, 2006,26(9):2140-2146
[16]Safranow K, Kotowski M, Lewandowska J, et al.Circulating endothelial progenitor cells in premature infants:is there an association with premature birth complications?J Perinat Med,2012,40(4):455-462
[17]Bizzarro MJ, Bhandari V, Krause DS, et al.Circulating stem cells in extremely preterm neonates.Acta Paediatr, 2007, 96(4):521-525
[18]Gerber HP, Hillan KJ, Ryan AM, et al.VEGF is required for growth and survival in neonatal mice.Development, 1999,126(6):1149-1159
[19]Acarregui MJ, Penisten ST, Goss KL, et al.Vascular endothelial growth factor gene expression in human fetal lung in vitro.Am J Respir Cell Mol Biol, 1999, 20(1):14-23
[20]Jakkula M, Le Cras TD, Gebb S, et al.Inhibition of angiogenesis decreases alveolarization in the developing rat lung.Am J Physiol Lung Cell Mol Physiol, 2000, 279(3):L600-L607
[21]Le Cras TD, Markham NE, Tuder RM, et al.Treatment of newborn rats with a VEGF receptor inhibitor causes pulmonary hypertension and abnormal lung structure.Am J Physiol Lung Cell Mol Physiol, 2002, 283(3):L555-L562
[22]Aicher A, Zeiher AM, Dimmeler S.Mobilizing endothelial progenitor cells.Hypertension,2005,45(3):321-325
[23]Machalinska A,Modrzejewska M,Kotowski M,et al.Circulating stem cell populations in preterm infants:implications for the development of retinopathy of prematurity.Arch Ophthalmol,2010,128(10):1311-1319
