血清神经元特异性烯醇化酶水平与足月儿缺氧缺血性脑病颅内结构改变相关性研究
2013-11-21李佩青杨思达卢嘉铭彭秋琰
李佩青 周 伟 杨思达 卢嘉铭 彭秋琰 沈 君 吕 回
神经元特异性烯醇化酶(NSE)由人类ENO2基因编码,具有糖酵解同工酶作用[1,2],免疫化学研究显示NSE的神经源性可作为神经元标记物[3]。NSE的含量也可作为神经元轴突损伤、靶向再生及神经再支配的可靠分子标记物[4,5],并可通过外周体液生物代谢分析被检出[6,7]。围生期窒息造成的缺氧缺血性脑病(HIE)病死率高,幸存HIE患儿或可遗留不同程度的后遗症[8,9]。目前,新生儿缺氧后颅内结构损伤程度相关生化指标的研究不多。本研究观察血清NSE水平在足月儿HIE的动态变化特点,并收集其头颅CT资料,探讨血清NSE水平与足月儿HIE不同时期颅内结构改变的关系,试图为临床求证一种检测便捷,同时与足月儿HIE中枢神经结构修复及预后评估相关性良好的血清标志物。
1 方法
1.1 研究假设和伦理 足月儿HIE相关研究显示,脑脊液中NSE水平与病情严重程度和12月龄时的神经发育结局呈正相关[10],但采集脑脊液的依从性差,临床不宜实施,为此本研究设计采集足月儿HIE急性期多时点的血清NSE水平,分析其变化趋势及与近期和远期CT影像学的相关性,试图给临床提供较好的判断预后的血清标志物。考虑到新生儿采血为有创性操作,为减少对新生儿的采血刺激,尽量利用临床必需的实验室检查血样,必要时才考虑单独采血测定NSE水平。
1.2 分组考虑 本研究拟观察NSE水平在足月儿HIE的动态变化,因此设HIE组和对照组;同时也考虑到HIE严重程度不同对NSE水平的可能影响,故在HIE组下分为轻度、中度和重度HIE亚组。
1.3 HIE组纳入和排标准 ①广州市妇女儿童医疗中心(我院)新生儿病区确诊的HIE[11];②出生后24h内入我院;③出生史资料齐全;④孕37~42周出生;⑤出生体重2.5~4.0 kg。
1.4 HIE组排除标准 ①入我院7d内出现对NSE检测存在干扰的疾病,如新生儿病理性黄疸、新生儿溶血病、新生儿颅内感染、新生儿肿瘤(纵隔占位等)、新生儿低钙性抽搐、先天性神经系统疾病(巨脑回等);②新生儿贫血;③代谢性酸中毒及高乳酸血症持续3d以上;④不能除外遗传代谢病者(持续高氨血症、难以纠正的水电解质紊乱)。1.5 对照组入选标准及原则 我院新生儿病区出生后24h内入院,估计住院时间>1周,临床无缺氧表现,血气分析及血乳酸结果正常的湿肺、肺炎和肠道疾病新生儿。本研究预设对照组30例,从研究开始时纳入,直至满足预设样本量要求。
1.6 治疗策略 入院后HIE组均给予“三支持”和“三对症”处理[12],并使用脑活素神经营养制剂 ;对照组不使用特殊神经保护剂。
1.7 观察指标
1.7.1 一般情况 性别、出生体重、孕周等围生期情况等。1.7.2 血清NSE水平 于生后第1、2、3、5和7天采集静脉血1mL提取血清,采用全自动化Elecsys(美国罗氏诊断公司)设备及配套试剂盒检测。NSE正常参考值为<16.3 ng·mL-1。
1.7.3 影像学指标 调阅纳入分析足月儿HIE病史资料,截取入我院4~10d和出院随访的CT检查报告,截取报告中的影像学描述。HIE急性期头颅 CT分度[13,14]:轻度异常为脑实质散在低密度影(CT值<18),累计脑叶≤2处;中度异常为2处以上脑叶出现低密度病灶;重度异常为脑实质弥漫性低密度改变,脑灰质、白质交界消失,脑室受压变窄脑沟变浅,部分伴有颅内出血。
2 结果
2.1 一般情况2006年6月至2009年6月共诊断838例HIE,107例符合纳入和排除标准进入分析,其中轻度HIE亚组34例,中度HIE亚组41例,重度HIE亚组32例(图1);对照组纳入30例。

图1 HIE组的纳入和排除流程Fig 1 Flow chart of HIEpatients selection process
表1显示,轻度、中度、重度HIE亚组和对照组在性别构成比、出生体重、入我院时龄等方面差异均无统计学意义(P均>0.05);1 min Apgar评分轻度和中度HIE亚组显著高于重度HIE亚组((P<0.001))。HIE组孕前病因中初孕妇61例(57.0%),胰岛素依赖型糖尿病(IDDM)13例(12.1%);分娩前病因中宫内发育迟缓9例(8.4%),产时剖宫产25例(23.4%),胎粪吸入16例(15.0%),胎盘早剥6例,各因素中,IDDM、胎盘早剥和胎粪吸入在HIE和对照组差异有统计学意义(P均<0.05),胎粪吸入发生率中度和重度HIE亚组显著高于对照组(χ2=4.61,(P<0.05))。
表1两组患儿的基线资料[±s,n(%)]Tab 1 Baseline characteristics of the HIE and control groups[ ± s,n(%)]

表1两组患儿的基线资料[±s,n(%)]Tab 1 Baseline characteristics of the HIE and control groups[ ± s,n(%)]
Notes GA:gestational age;BW:birth weight
Characteristics HIE Group(n=107)Mild(n=34)Moderate(n=41)Severe(n=32)Control(n=30)P Age/hour 8.3±5.8 9.5±6.0 13.3±6.0 12.8±7.2 0.057 Male 24(71.3)31(75.6)24(75.0)21(70.0)0.770 GA/weeks 38.8±1.3 39.0±1.3 38.9±1.4 38.7±1.2 0.255 BW/kg 3.0±0.4 3.1±0.4 3.0±0.4 3.1±0.4 0.451 Apgar 1 min 2.4±0.7 2.5±0.7 1.6±1.0 9.0±1.4 0.000 Nulliparity 17(50.0)24(58.5)18(56.2)18(60.0)0.701 IDDM 4(11.8)5(12.2)4(12.5)0 0.000 IUGR 2(5.9)4(9.8)3(9.4)1(3.3)0.898 Placental abruption 2(5.9)2(4.9)2(6.2)0 0.000 Caesarean 8(23.5)10(24.4)7(21.9)7(23.3)0.999 Meconium aspiration 3(8.8)7(17.1)6(18.8)00.000
HIE组存活99例(轻度、中度和重度亚组分别为34、41和24例),其中89例(89.9%)出院后36个月内来院随访,44/89例(49.4%)有不同程度后遗症,轻度、中度和重度HIE亚组后遗症发生率分别为6/31例(19.4%)、21/36例(58.3%)和17/22例(77.3%),中度、重度HIE亚组后遗症发生率显著高于轻度HIE亚组(χ2=10.52,P=0.001;χ2=17.57,P=0.000)。
2.2 两组血清NSE水平变化趋势 如表2显示,HIE组和对照组生后第1~7天血清NSE水平均呈单峰分泌趋势,第2天最高,之后呈下降趋势(图2)。各时点血清NSE水平中度和重度HIE亚组均显著高于轻度HIE亚组和对照组(P均<0.05);至第7天,轻度HIE亚组和对照组NSE水平接近正常参考值上限(16.3 ng·mL-1)。重复度量方差分析结果显示,中、重度HIE亚组NSE曲线的急升陡降趋势与对照组、HIE轻度亚组的相对平缓趋势间存在显著性差异,F=12.15及7.74,P均为0.000。

图2 各组不同时点NSE水平Fig 2 Serum NSElevels atdifferent time points indifferent groups
表2 HIE组和对照组各时点血清NSE水平(ng·mL-1)比较±s)Tab 2Comparison of serum NSElevels(ng·mL-1)at different time points between the HIEand control groups(±s)

表2 HIE组和对照组各时点血清NSE水平(ng·mL-1)比较±s)Tab 2Comparison of serum NSElevels(ng·mL-1)at different time points between the HIEand control groups(±s)
Notes P1:control group vs mild HIE group;P2:control group vs moderately HIE group;P3:control group vs severe HIE group
Groupsday 1 n levelday 2 n levelday 3 n levelday 5 n levelday 7 n level Control 30 21.9±6.8 30 21.8±7.4 30 21.1±9.2 30 18.6±6.9 30 16.6±5.0 Mild HIE 34 24.1±15.1 34 27.3±17.2 33 26.1±15.7 32 21.2±10.9 31 18.9±18.9 Moderate HIE 41 32.8±17.2 41 41.3±21.3 38 38.2±20.3 35 32.5±15.9 32 26.7±14.2 Severe HIE 32 46.9±22.8 29 56.9±18.5 28 50.4±17.6 23 41.6±16.5 22 34.6±11.6 P1 0.600 0.179 0.185 0.439 0.388 P2 0.007 <0.001 <0.001 <0.001 <0.001 P3 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 血清NSE水平与急性期颅内结构改变的相关性
HIE组入我院4~10d内101例完成头颅CT检查,CT检查未见异常31例(30.7%),异常70例(69.3%),其中轻度异常21例、中度异常20例、重度异常29例。CT未见异常与轻度异常患儿NSE水平差异无统计学意义(P=0.936),故将CT未见异常与轻度异常患儿合并进行后续分析。表3显示,CT重度异常患儿生后1~5d的NSE水平显著高于CT未见异常+轻度异常患儿,P均<0.01;CT重度异常患儿生后第1和2天NSE水平显著高于CT中度异常患儿,P均 <0.05。
不同颅内结构异常NSE平均水平,2个脑叶以上低密度影35例,NSE(37.2±18.9)ng·mL-1;蛛网膜下腔出血18例,NSE(40.1±16.4)ng·mL-1;脑实质出血8例,NSE(46.6±18.1)ng·mL-1,与CT未见异常+轻度异常患儿差异无统计学意义;弥漫性脑水肿13例,NSE(50.3±14.0)ng·mL-1;脑室内出血7例,NSE(52.7±16.8)ng·mL-1,显著高于CT未见异常+轻度异常患儿(P分别为0.002和0.000)。
表3 急性期和急性期后CT未见异常患儿和异常患儿各时点血清NSE水平(ng·mL-1)比较±s)Tab 3 Comparison of serum NSElevels(ng·mL-1)between patients with normal or abnormal coronal CT at different time points during and after acute period±s)
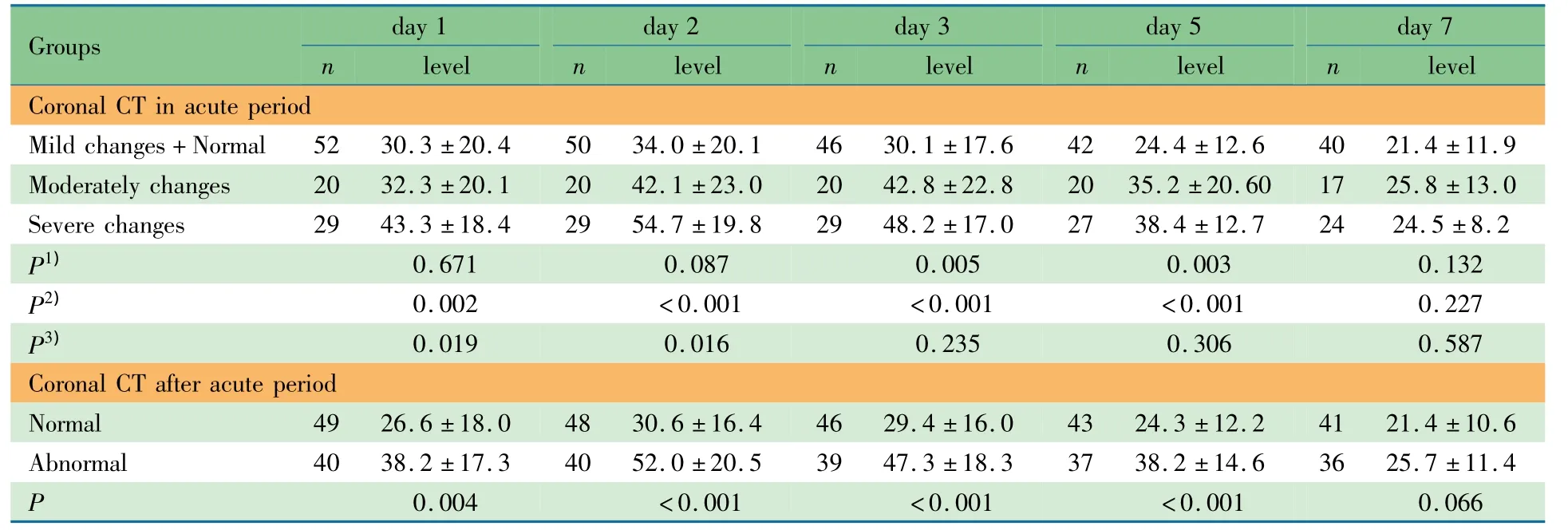
表3 急性期和急性期后CT未见异常患儿和异常患儿各时点血清NSE水平(ng·mL-1)比较±s)Tab 3 Comparison of serum NSElevels(ng·mL-1)between patients with normal or abnormal coronal CT at different time points during and after acute period±s)
Notes 1)control+mild changes group vs moderately changes group;2)control+mild changes group vs severe changes group;3 moderately changes group vs severe changes group
Groupsday 1 n levelday 2 n levelday 3 n levelday 5 n levelday 7 n level Coronal CT in acute period Mild changes+Normal 52 30.3±20.4 50 34.0±20.1 46 30.1±17.6 42 24.4±12.6 40 21.4±11.9 Moderately changes 20 32.3±20.1 20 42.1±23.0 20 42.8±22.8 20 35.2±20.60 17 25.8±13.0 Severe changes 29 43.3±18.4 29 54.7±19.8 29 48.2±17.0 27 38.4±12.7 24 24.5±8.2 P1) 0.671 0.087 0.005 0.003 0.132 P2) 0.002 <0.001 <0.001 <0.001 0.227 P3) 0.019 0.016 0.235 0.306 0.587 Coronal CT after acute period Normal 49 26.6±18.0 48 30.6±16.4 46 29.4±16.0 43 24.3±12.2 41 21.4±10.6 Abnormal 40 38.2±17.3 40 52.0±20.5 39 47.3±18.3 37 38.2±14.6 36 25.7±11.4 P 0.004 <0.001 <0.001 <0.001 0.066
ROC曲线分析显示,以生后第2天血清NSE水平49.8 ng·mL-1预测HIE组急性期出现重度头颅CT影像改变的敏感度为62.5%,特异度为86.0%;NSE水平89.4 ng·mL-1时的特异度为100%、敏感度为4.2%(表4)。2.4 血清NSE水平与急性期后颅内结构改变的相关性HIE组89例出院后至36月龄随访头颅CT,CT异常40例(40.9%),其中脑沟加深12例,脑萎缩9例,脑软化10例,脑室增宽9例,脑水肿8例,脑发育不良3例,部分病例可见1种以上异常影像,急性期后CT异常患儿出生后第1~5天血清NSE水平均显著高于急性期后头颅CT未见异常患儿((P<0.01)),两组间NSE分泌趋势存在显著性差异,F=21.18,P=0.000。遗留脑萎缩与脑软化患儿急性期平均NSE 水平为(48.1±15.1)和(43.8±17.1)ng·mL-1,显著高于急性期后CT未见异常患儿(P分别为0.006和0.032)。
ROC曲线分析显示,以生后第2天NSE水平45.7 ng·mL-1预测急性期后36月龄内颅内结构改变的价值最大,敏感度为71.4%,特异度为89.3%,AUC=0.834,95%CI:0.753~0.923。生后第3天NSE水平29.0 ng·mL-1为界值预测的敏感度最大,为95.8%(表4)。
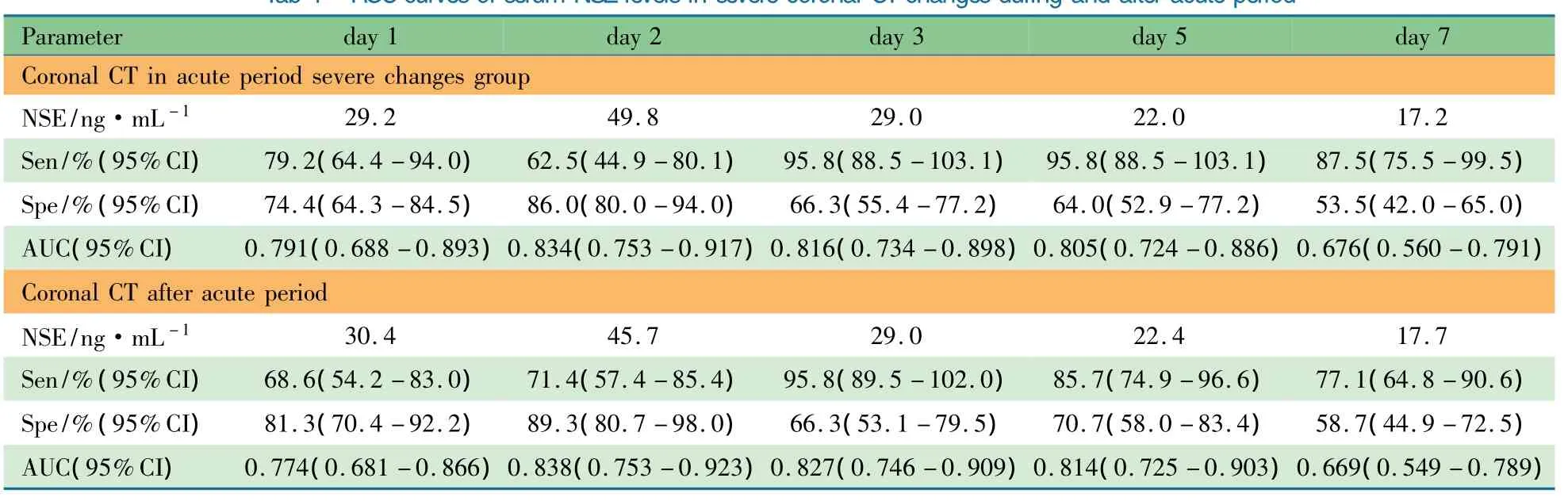
表4 血清NSE预测急性期和急性期后CT严重异常的ROC曲线分析Tab 4 ROCcurves of serum NSElevels in severe coronal CTchangesduring and after acute period
3 讨论
3.1 血清NSE水平与足月儿HIE急性期临床严重程度的相关性 本文资料显示对照组血清NSE水平略高于正常参考值上限,可能与围生期新生儿神经发育高代谢特点相关[15]。文献[16]报道急性期重度HIE给予外源性神经营养药物可减缓病程3~10d血清NSE的升高,本文HIE组给予脑活素常规治疗,中度和重度HIE亚组各时点NSE水平仍显著高于对照组,提示血清NSE水平与中枢神经缺氧损伤的相关性较好[17,18]。同时,HIE组3个亚组分泌高峰均在生后第2天,之后呈下降趋势,其中的中度和重度亚组呈急升陡降的趋势,与对照组、HIE轻度亚组相对平缓的趋势差异有统计学意义;提示NSE的时间分泌特征可提示缺氧后中枢神经系统损伤程度。
3.2 足月儿HIE急性期血清NSE水平与颅内结构改变的相关性 本研究显示,足月儿HIE急性期头颅CT异常改变与血清NSE水平升高相关,出现弥漫性脑水肿与脑室内出血时血清NSE升高更显著,推测与缺氧后大面积神经元受累、胞膜完整性严重破坏、血脑屏障破坏和NSE外漏等有关。同时,NSE胞外浓度的适量增加(<100 ng·mL-1),有利于损伤神经元的存活与修复[14]。本研究ROC曲线分析显示,生后第2天血清NSE 49.8 ng·mL-1,预测急性期出现头颅CT严重异常的价值最高,与Celtik等[19]报道的45.4 ng·mL(特异度为84%,敏感度为70%)相近;进一步分析特异度为100%时的NSE界值为89.4 ng·mL-1,与Sohur等[20]对心跳骤停复苏后预后不良血清NSE界值(97 ng·mL-1)较为接近。对NSE水平预测急性期后颅内结构异常的分析显示,各时点NSE的界值与急性期的界值均较为接近,而且敏感度和特异度也与急性期预测的相关结果相差不大,提示急性期NSE水平可作为评估近期和远期预后较为敏感的指标。
本文结果还显示,缺氧急性期后遗留的颅内影像结构异常与急性期血清NSE的高水平分泌及之后的陡峭回落有关,如遗留脑萎缩与脑软化病例在急性期NSE水平较高,提示病程初期缺氧损伤严重,随着缺氧损伤进一步加重,神经内分泌细胞数量减少,致使NSE的合成分泌不足、渗漏的NSE被机体分解代谢、损伤神经的修复增加NSE的消耗,共同影响血清NSE水平急性升高后短时间内迅速回落。NSE含量不足使神经元细胞修复不完全,以及受累区域非神经源性烯醇化酶优势表达[21]促进神经胶质重塑,导致颅内结构的异常。而轻度HIE亚组NSE曲线相对平缓的趋势似乎能较好地获得中枢神经系统影像学结构的维持与修复。
[1] Oliva D, Calì L, Feo S, et.al, Complete structure of the human gene encoding neuron-specific enolase.Genomics.1991,10(1):157-165
[2]Craig SP, Day IN, Thompson RJ, et.al.Localisation of neurone-specific enolase(ENO2)to 12p13.Cytogenet.Cell Genet,1991,54(1-2):71-73
[3]Hergenroeder GW,Redell JB,Moore AN,et.al.Biomarkers in the clinical diagnosis and management of traumatic brain injury.Mol Diagn Ther,2008;12(6):345-358
[4]Angelov DN, Neiss WF, Gunkel A, et.al.Axotomy induces intranuclear immunolocalization of neuron-specific enolase in facial and hypoglossal neurons of the rat.J Neurocytol,1994,23(4):218-233
[5]Wijnberger LD, Nikkels PG, van Dongen AJ, et.al.Expression in the placenta of neuronal markers for perinatal brain damage.Pediatr Res, 2002, 51(4):492-496
[6]Karrenbauer VD, Leoni V, Lim ET, et.al.Plasma cerebrosterol and magnetic resonance imaging measures in multiple sclerosis.Clin Neurol Neurosurg,2006,108(5):456-460
[7]Griffin JL, Salek RM,Metabolomic applications to neuroscience:More Challenges Than Chances?Expert Rev Proteomics, 2007,4(4):435-437
[8]Bryce J, Boschi-Pinto C, Shibuya K, et al.WHO estimates of the causes of death in children.Lancet, 2005,365(9465):1147-1152
[9]Lawn J, Shibuya K, Stein C.No cry at birth:global estimates of intrapartum stillbirths and intrapartum-related neonatal deaths.Bull World Health Organ,2005,83(6):409-417
[10]Vasiljevic B, Maglajlic-Djukic S, Gojnic M, etc al.New insights into the pathogenesis of perinatal hypoxic-ischemic brain injury.Pediatr Int, 2011, 53(4):454-462
[11]The Group of Neonatology, Chinese Pediatric Society, Chinese Medical Association(中华医学会儿科学分会新生儿学组).Diagnostic criteria for neonatal hypoxic-ischemic encephalopathy.Chin J Pediatr(中华儿科杂志),2005,43(8):584-
[12]Key Laboratory of Neonatal Diseases,Ministry of Health(卫生部新生儿疾病重点实验室),Children's Hospital of Fudan University,Editorial Board of Chinese Journal of Evidencebased Pediatrics.Guideline of evidence-based treatment for hypoxic-ischemic encephalopathy in full-term infants(standard version,2011).Chin J Evid Based Pediatr(中国循证儿科杂志),2011,6(5):327-335
[13]Min H(闵红), Zhang YP,Zhou XL. 新生儿缺氧缺血性脑病临床分度头颅CT与神经行为测定一致性分析.Anhui Medical Journal(安徽医学),2009, 30(3):238-239
[14]Xu WB(徐文彪),Liu LW,Zhou SY,et al.CT feature of hypoxic-ischemic encephalopathy in full-term neonates:its value in early predicting prognosis.Journal of Clinical Radiology(临床放射学杂志),2003;22(6):504-507
[15]Qiu QY(邱全曜), Miao YM.The neuron specific enolase.Chemistry of lift(生命的化学),2008, 28(4):439-442
[16]Li W(李薇),Wang DS,Chen CF,et al.外源性磷酸肌酸对重度窒息新生儿血清与水平的影响.Mordern Hospital(现代医院),2006,6(4):13-14
[17]Hay E,Royds JA,Davies-Jones GA,et al.Cerebrospinal fluid enolase in stroke.J Neurol Neurosurg Psychiatry, 1984,47:724-729
[18]Studahl M, Rosengren L, Gunther G, et al.Difference in pathogenesis between herpes simplex virus type 1encephalitis and tick-borne encephalitis demonstrated by means of cerebrospinal fluid markers of glial and neuronal destruction.J Neurol,2000, 247(8):636-642
[19]Celtik C, Acunas B, Oner N, etc.al.Neuron-specific enolase as a marker of the severity and outcome of hypoxic ischemic encephalopathy.Brain Dev,2004,26(6):398-402
[20]Sohur US, Arlotta P, Macklis JD.Developmental Controls are Re-Expressed during Induction of Neurogenesis in the Neocortex of Young Adult Mice.Front Neurosci, 2012, 6:12
[21]McAleese SM,Dunbar B,Fothergill JE,et al.Complete amino acid sequence of the neurone-specific gamma isozyme of enolase(NSE)from human brain and comparison with the nonneuronal alpha form(NNE).Eur J Biochem,1989, 178(2):413-417
