茯神化学成分及其复方药效学研究*
2013-11-21崔业波包海鹰
林 琳,崔业波,包海鹰
(吉林农业大学中药材学院,吉林 长春 130118)
茯神 (Poria cum Radix Pini)为多孔菌科 (Polyporaceae)、真菌茯苓Wolfiporia cocos(Schwein.)Ryvarden&Gilb的干燥菌核抱附着松根的部分[1]。茯神作为一种传统菌物药材,现代应用研究较少,还局限在古方的应用创新、真伪鉴定[2]方面,还未发现从茯神中分离纯化得到相应活性成分及单体化合物。鉴于现状,旨在弥补其化学成分方面的研究不足,研制茯神与灵芝配伍的复方苓灵神蜜膏,并对其进行药效学实验,为茯神应用及功能性食品的开发奠定了基础。
1 茯神化学成分的研究
1.1 材料与方法
1.1.1 实验材料
茯神购自长春市吉林大药房,由吉林农业大学包海鹰教授鉴定。
1.1.2 主要仪器
Finnigan-MAT.LCQ电喷雾质谱仪、Bruker AM-600 MHz型核磁共振波谱仪、德国Bruker WERTREX型红外检测仪、日本岛津BU-7500型紫外检测仪、YLS-6B智能热板仪 (淮北正华生物仪器设备有限公司)、小鼠饲养箱。
1.1.3 提取分离
茯神 (6 kg)置烘箱中40℃烘干,粉碎后过20目筛。分别采用石油醚30℃、氯仿50℃、丙酮65℃、甲醇70℃梯度提取3次;分别合并提取液,浓缩分别得到3.0 g、19.5 g、14.1 g、36.0 g提取物。
经反复柱层析分离,从丙酮层得到化合物1、化合物2、化合物3;氯仿层得到化合物4、化合物5;石油醚层得到化合物4。
2 茯神复方产品苓灵神蜜膏的药效学研究
将茯神与灵芝等药材配伍,开发茯神复方产品苓灵神蜜膏,针对其镇痛作用做以下药效学实验。
2.1 热板法
2.1.1 药物配置
阳性药:去痛片0.56 g·kg-1;阴性组:生理盐水 (0.2 mL/10 g);给药组。
复方水煎液的配制:分别取茯神与灵芝粉末5 g混匀,沸水煎煮3次,合并浓缩到浸膏状态,得到水提取物为1.275 g,得率为12.75%,给药剂量分别为1 g·kg-1、0.44 g·kg-1。
水溶性三萜成分的配置:分别取茯神、灵芝20 g配伍,用纱布包裹水煎煮3次,浓缩 (得率为12.5%),然后用85%乙醇沉淀12 h,3次,高速离心乙醇层低压浓缩后 (得率为 45.33%),给药剂量分别为 0.49 g·kg-1、0.2 g·kg-1。
粗多糖的配置:同样分别取茯神、灵芝20 g配伍,用纱布包裹水煎煮3次,合并浓缩 (12.7%),用85%乙醇沉淀12 h,3次,高速离心倾去乙醇液,合并沉淀,然后将沉淀反复用甲醇、丙酮洗涤,再用Savage试剂纯化去掉蛋白成分(得率为 25.1%),给药剂量分别为 0.5 g·kg-1、0.2 g·kg-1。
苓灵神蜜膏剂量配置:取苓灵神蜜膏26.25 g,溶于50 mL蒸馏水中,制成0.525 g·mL-1溶液,小鼠给药量为0.2 mL/10g。取苓灵神蜜膏10.5 g,溶于50 mL蒸馏水中,制成0.21 g·mL-1溶液,小鼠给药剂量为 0.2 mL/10g。
2.1.2 动物处理
取100只雄性小鼠,随机分为阴性组、安定组、给药组。饲养于正规的动物实验室,自然光照射,室温为25℃,正常饲养适应环境2 d,第3天给药组开始按体重给药,0.2 mL/10g。连续给药7 d,并观察小鼠的活动情况。实验整个过程严格按照实验动物法则规程操作,实验完毕,对小鼠进行脱臼处死,减少小鼠死亡时的痛苦。
2.1.3 实验步骤
实验前进行小鼠筛选,取体重为 (18±2)g雌性小鼠,将YLS-6B智能热板仪调节到 (50±0.5)℃,预热10 min,取雌性KM小鼠数只,将小鼠放置热板上,记录小鼠自投入热板后到小鼠出现舔后足 (或跳跃反应)的时间,即为该鼠的疼痛阈值。将反应潜伏期小于5 s或大于30 s的小鼠剔除,剩下的小鼠为合格小鼠。
取48只合格的雌性小鼠,随机分为阴性组、阳性组、给药组。正常饲养适应环境2 d,第3天对阴性组、阳性组和给药组的小鼠进行痛阈给药前的测定并记录,然后给药组开始按体重给药,0.2 mL/10g,连续给药7 d,第8天,实验小鼠禁食不禁水8 h,给药组按体重给药,同时阴性组给同体积的生理盐水,阳性组给去痛片0.56 g·kg-1,分别给药30 min、60 min后,再依次测定小鼠的痛阈。镇痛作用通过比较给药组与阴性组小鼠反应潜伏期表现出来。
2.1.4 实验结果与统计分析
提高痛阈百分比 (P)公式为:
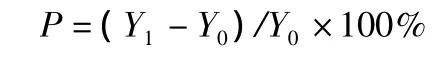
式中:Y1表示给药后的痛阈;Y0表示给药前的痛阈。
阴性组的提高痛阈百分比为0%;小鼠疼痛潜伏期采用mean±SD表示,分别通过T-test比较给药后30 min、60 min后的给药组和阴性组间的显著性,当p<0.05说明在统计学上差异显著,p<0.01说明在统计学上差异非常显著。镇痛作用采用提高痛阈百分比表示[3-7]。
2.2 扭体法
2.2.1 药物配置
阳性药:安定给药量为4 mg·kg-1,安定购于吉林农业大学医院。
阴性组:生理盐水 (0.2 mL/10g)。
给药组:水溶性三萜成分的配置同2.1.1项下方法;粗多糖的配置同2.1.1项下方法;苓灵神蜜膏剂量配置同2.1.1项下方法。
2.2.2 动物处理
同2.1.2项下的方法。
2.2.3 实验步骤
给药组连续按体重给药7 d,第8天实验小鼠禁食不禁水8 h,给药组按体重给药,同时阴性组给同体积的生理盐水,阳性组给4 mg·kg-1安定,给药50 min后,每只小鼠腹腔注射0.2 mL 0.5%冰醋酸溶液,然后测定15 min内出现扭体反应的动物数和扭体次数。受试药的镇痛作用通过比较给药组和阴性组出现扭体反应的动物数和扭体次数表现出来。
2.2.4 实验结果与统计分析
镇痛百分率 (M)公式为:
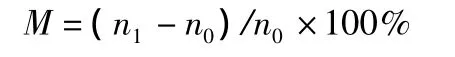
式中:n1表示空白组平均扭体次数;n0表示给药组平均扭体次数。
小鼠扭体次数采用mean±SD表示,通过T-test比较给药组和阴性组间的显著性,当p<0.05说明在统计学上差异显著,p<0.01说明在统计学上差异非常显著[8,9]。
3 实验结果
3.1 茯神的结构鉴定
化合物1:白色的针状结晶 (氯仿),mp.167℃~178℃,可溶于氯仿、石油醚、乙酸乙酯等有机试剂不溶于甲醇、乙醇等极性大的溶剂。13C-NMR(CDCl13,100 MHz)δ:34.70(C-1),30.13(C-2),66.47(C-3),36.94(C-4),82.14(C-5),135.41(C-6),130.15(C-7),79.41(C-8),51.10(C-9),36.99(C-10),20.63(C-11),39.35(C-12),44.56(C-13),51.69(C-14),23.40(C-15),28.63(C-16),56.21(C-17),12.87(C-18),18.12(C-19),39.71(C-20),20.88(C -21),135.20(C-22),132.31(C-23),42.77(C-24),33.06(C-25),19.63(C-26),19.94(C-27),17.55(C-28)。以上数据与姜北[10]等报道的麦角甾醇过氧化物的信息完全相符,由此判定化合物1为麦角甾醇过氧化物。
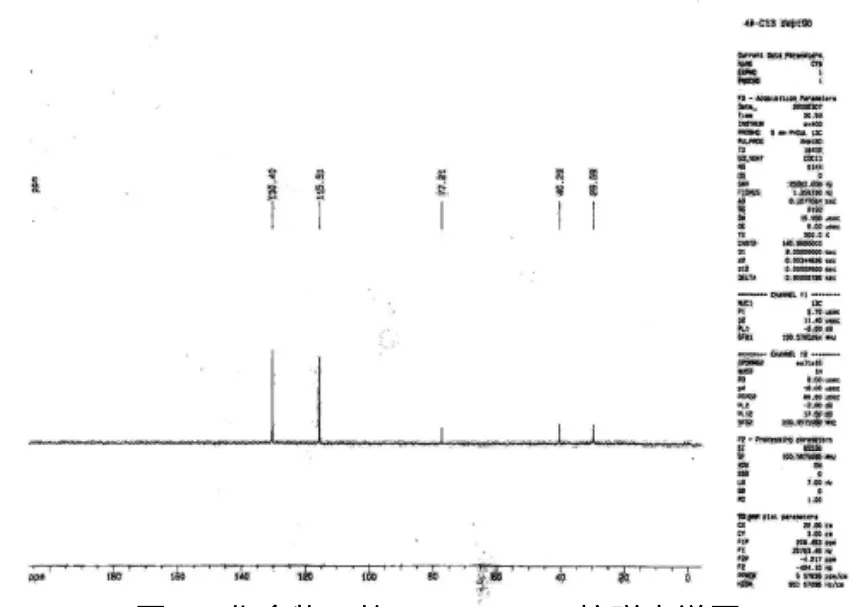
图1 化合物3的DEPT-135核磁光谱图
化合物2:系白色绢丝状结晶 (氯仿),溶于氯仿、乙酸乙酯、甲醇等有机试剂。分子量为528,EI-MS给出特征碎片峰510,453,435。13C -NMR(CDCl13,100 MHz)δ:35.40(C -1),24.20(C-2),80.77(C-3),37.89(C -4),50.62(C -5),18.10(C-6),26.51(C-7),134.30(C-8),134.54(C-9),37.05(C-10),20.57(C -11),29.70(C-12),46.18(C -13),46.41(C-14),42.78(C -15),76.77(C -16),56.95(C-17),16.52(C -18),19.16(C -19),48.30(C -20),179.79(C-21),30.62(C-22),32.22(C-23),155.08(C-24),33.87(C-25),21.89(C -26),21.78(C -27),29.06(C-28),17.40(C -29),25.25(C -30),107.10(C -31)。以上数据与仲佻金[11]报道的数据一致,鉴定化合物2为茯苓酸。
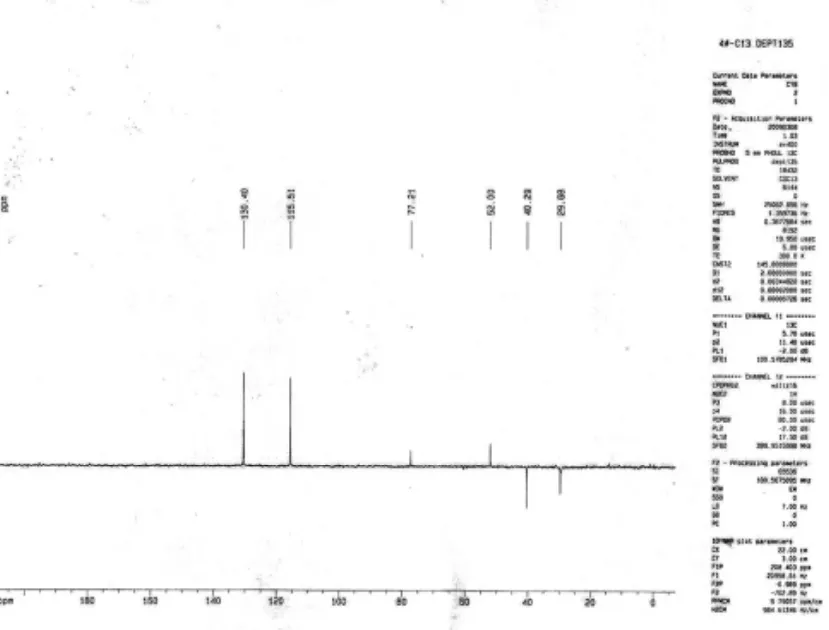
图2 化合物3的DEPT-90核磁光谱图
化合物3:系粉红色油状,溶于石油醚、氯仿等有机溶剂,微溶于甲醇、乙醇等极性较大的溶剂。分子量为179.03,分子式为 C10H10O3。13C -NMR(CHCl3)δppm 115.51、125.73、130.39 和155.11为苯环结构,δppm 29.68、40.28为 CH2基团,δppm 172.55为-CO-结构。以氯仿为溶解的dept-135和dept-90的核磁共振光谱图中可以得出,δppm 155.11为季碳;有5和CH基团,2个CH2基团。根据光谱数据和理化特征,鉴定化合物3为5-(4-羟苯基)二氢呋喃-2(3H)-酮[12]。
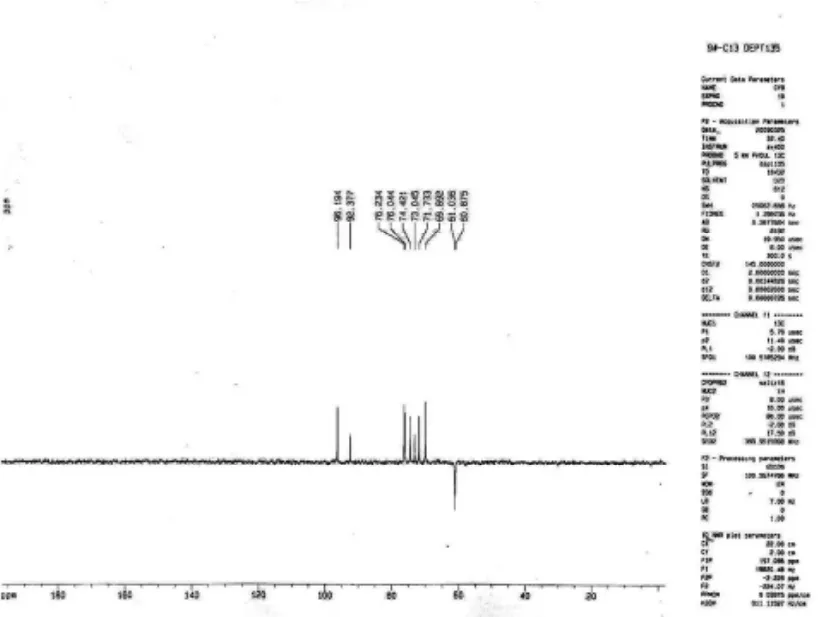
图3 化合物4的DEPT-135核磁谱图
化合物4:系质地坚实的白色粉末,并且有甜味,极易溶于水,可以溶于热的甲醇。分子量为360,EI-MS给出特征碎片峰178.8、214.8、216.8、138.6碎片。从红外谱图中可以得出,1 024.20 cm-1、1 002.90 cm-1、1 080.14 cm-1、1 111.00 cm-1、1 148.57 cm-1、1 274.09 cm-1处有强吸收峰,表明有明显的C-O伸缩振动。在1 342.48 cm-1、1 371.38 cm-1、1 411.89 cm-1、1 425.40 cm-1、1 450.47 cm-1处有中强吸收峰,表明有C-H面内弯曲振动;判断为双糖。从dept-135和dept-90中可以得出,本化合物具8个CH基团,没有甲基基团,并且只有2个CH2基团。因此鉴定化合物4是由2个葡萄糖组成的二糖化合物,连接方式为β-DGlu(3-1)α-D-Glu。
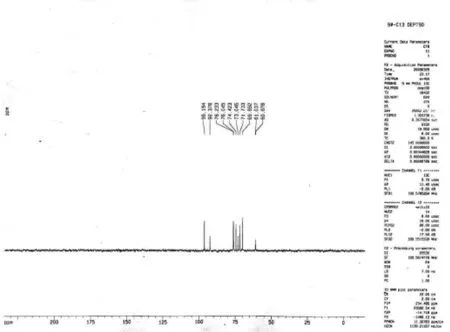
图4 化合物4的DEPT-90核磁谱图
化合物5:系蓝绿色油状液体,溶于石油醚、氯仿等有机溶剂,微溶于甲醇、乙醇等极性较大的溶剂。分子量为278。13C-NMR(CDCl13,100 MHz)δ:179.79(C-1),134.54(C-2),24.17(C-3),28.93(C-4),29.05(C-5),29.70(C -6),29.35(C -7),26.48(C -8),133.98(C-9),127.16(C-10),25.56(C-11),128.22(C-12),128.11(C-13),25.65(C-14),127.80(C-15),130.14(C-16),20.56(C-17),14.26(C-18)。本文数据与杨倩等[13]报道的α-亚麻酸数据基本一致,鉴定化合物5为α-亚麻酸,分子式为C18H30O2。
3.2 苓灵神蜜膏镇痛作用的药效学作用
3.2.1 热板法实验结果
实验结果见表1。
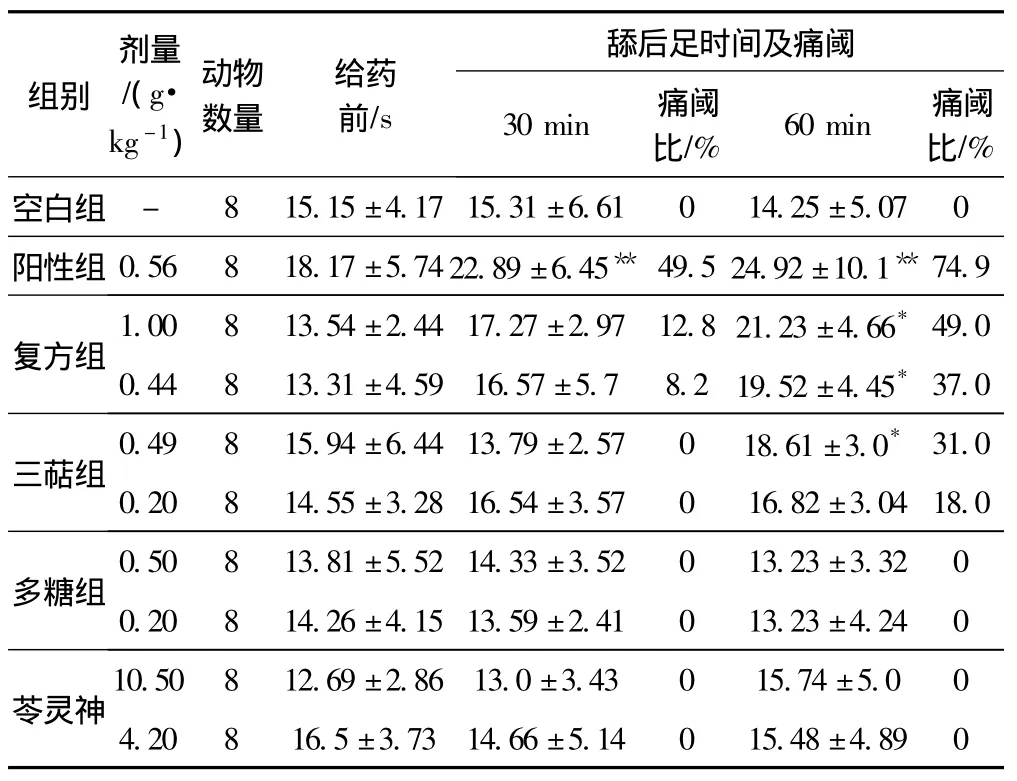
表1 热板法实验结果
从表1中可以得出,茯神与灵芝配伍的水提取物在1.0 g·kg-1(p<0.05)、0.44 g·kg-1(p < 0.05)剂量下,在给药60 min后,明显的提高了小鼠的疼痛潜伏期,分别的痛阈百分比为49%和37%;水溶性三萜成分剂量为0.49 g·kg-1,给药60 min后,提高了小鼠痛阈31%,其它组均没有表现出相关的作用。
3.2.2 扭体法实验结果
扭体实验结果见表2。
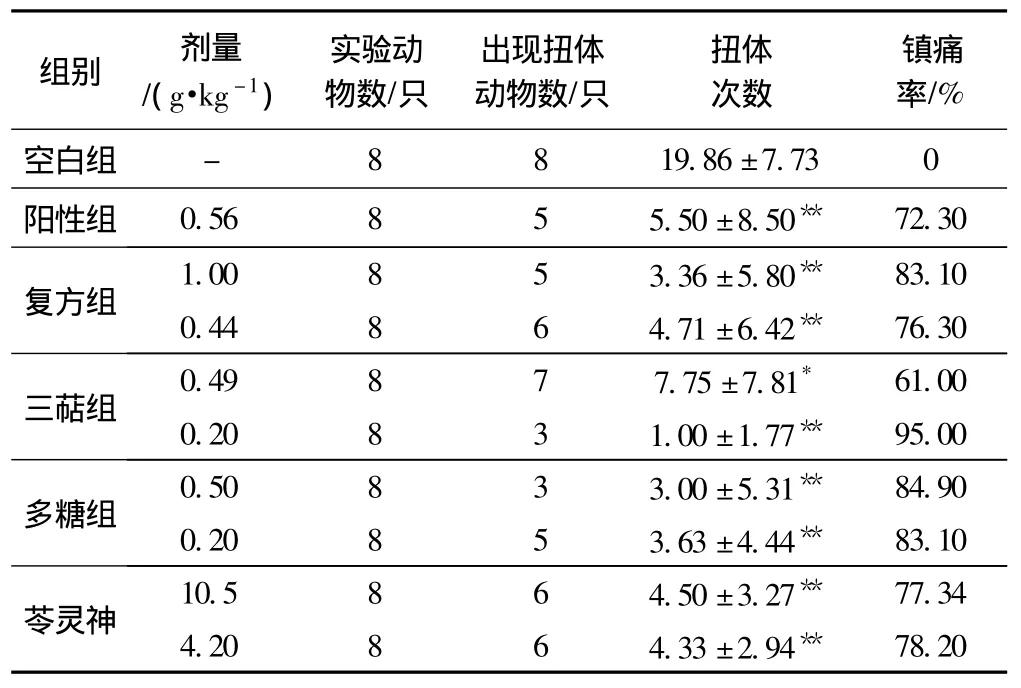
表2 扭体实验结果
茯神与灵芝配伍的水提取物在1.0 g·kg-1(p<0.01)、0.44 g·kg-1(p<0.01)剂量下,可以明显地抑制小鼠由冰醋酸诱导的局部疼痛,与阴性对照组比较,镇痛比率分别为83.1%和76.3%,没有呈现明显的剂量依赖性;水溶性三萜成分剂量为0.2 g·kg-1(p<0.01)时,反而比 0.49 g·kg-1(p<0.05)时更好地抑制了因冰醋酸诱导的局部疼痛;粗多糖可以明显地抑制小鼠由冰醋酸诱导的局部疼痛,剂量为0.2 g·kg-1和 0.5 g·kg-1时,镇痛率分别为 83.1% 和 84.9%,并与对照组比较p<0.01,但是没有出现很好的量效关系。
苓灵神蜜膏在剂量为 10.5 g·kg-1(p<0.01)、4.2 g·kg-1(p<0.01)条件下,与阴性对照组比较,可以明显的减少小鼠的扭体次数,抑制因冰醋酸诱导的局部疼痛。镇痛比率分别为77.34%、78.2%。并没有明显的剂量依赖性。
4 讨论
通过薄层层析和硅胶柱层析方法,对茯神的化学成分进行了系统分离,并结合重结晶等方法进行纯化,其中麦角甾醇过氧化物是一类广泛的存在于真菌中的甾醇类化合物,由于其特有的生物学性质,具有很好的活性。Nakanishi T等[14]指出麦角甾醇过氧化物具有抗HIV-1病毒的活性。Kwon HC等[15]指出麦角甾醇过氧化物具有细胞毒性,药物浓度在3.42 μg·mL-1~11.37 μg·mL-1时,对 A -549、SK-MEL -2、XF-498和HCT-15细胞有明显的细胞增殖抑制性。茯苓酸为茯苓素中主要的化合物,有报道茯苓素具有免疫调节和抗癌活性,在体内还具有拮抗醛固酮活性。对人白血病细胞系HL-60有诱导分化作用[16]。5-(4-羟苯基)二氢呋喃 -2(3H)-酮,为首次在天然产物中分离得到的化合物。Signe Hφg和Petrine等[12]报道,通过合成的方法,得到5-(4-羟苯基)二氢呋喃-2(3H) -酮,以此为基础,再合成GHB,GHB为GABA的代谢产物,临床上多治疗白天睡眠过多及昏睡性猝倒等疾病,本文则是首次在天然产物中发现该化合物,并为将来解释茯神镇静安神作用的机理提供了重要的研究基础,同样也为GHB的研制增添了新的研究内容。β-D-Glu(3-1)α-D-Glu也是首次从茯神中分离得到二糖,现在对其的研究很少,还不明确其药效。α-亚麻酸为也是首次在茯神分离得到,为人体必需脂肪酸,其在体内不能自身合成,必须从体外摄取,具有广泛的活性,被称为“21世纪功能性食品主角”[13]。综上所述,从茯神分离鉴定出的5个化合物,其中的麦角甾醇过氧化物、茯苓酸为茯神与茯苓共有的成分,但是其它3个化合物,由于文献量不足,有待进一步核对。
在镇痛实验中,茯神复方的主要活性成分为水溶性三萜成分,通过实验组间的比较,可以得出,水溶性三萜成分的镇静安神及抗焦虑作用的机理可能与中枢神经抑制作用有关;粗多糖对热诱导的疼痛没有提高小鼠的痛阈,而对冰醋酸诱导的疼痛具有明显的活性,表明其粗多糖的作用机理同样与中枢神经抑制无关,可能与改善小鼠微循环有关,就其机理的研讨有待进一步研究。
[1]杨树东,包海鹰.茯苓中三萜类和多糖成分的研究进展 [J].菌物研究,2005,16(3):64-70.
[2]刘海宝,高阿辉.茯神与伪品茯神的鉴别 [J].实用中医药杂志,2009,25(11):777.
[3]Jeon HJ,Kang HJ,Jung HJ,et al.Anti-inflammatory activity of Taraxacum officinale [J].JournalofEthnopharmacology,2008(115):82-88.
[4]Wibool R,Chutha S,Wantana R,et al.Antinociceptive activity of the methanolic extract of Kaempferia galangal Linn.in experimental animals[J].Journal of Ethnopharmacology,2008(118):225-230.
[5]Tornos MP,Sa'enz MT,Garcl'a MD,et al.Antinociceptive effects of the tubercles of Anredera leptostachys [J].Journal of Ethnopharmacology,1999(68):229-234.
[6]Katalin S,Zsuzsanna H,Klára G,et al.Static magnetic field-induced anti-nociceptive effect and the involvement of capsaicin-sensitive sensory nerves in this mechanism [J].Life Sciences,2007(81):97-102.
[7]Kim IT,Park YM,Shin KM,et al.Anti-inflammatory and anti-nociceptive effects of the extract from Kalopanax pictus,Pueraria thunbergiana and Rhus verniciflua [J].Journal of Ethno Pharmacology,2004(94):165-173.
[8]Weso owska A,Nikiforuk A,Michalska K,et al.Analgesic and sedative activities of lactucin and some lactucin-like guaianolides in mice[J].Journal of Ethnopharmacology,2006(107):140-145.
[9]Francisco Palacios-Espinosa,Myrna Deciga-Campos,Rachel Mata.Antinociceptive,hypoglycemic and spasmolytic effects of Brickellia veronicifolia [J].Journal of Ethnopharm-acology,2008(118):448-454.
[10]姜北,赵勤实,彭丽艳,等.雪茶化学成分研究[J].云南植物研究,2004,24(4):525-530.
[11]仲兆金,刘浚.茯苓有效成分三萜的研究进展 [J].中成药,2001,23(1):58-62.
[12]Signe HG,Petrine W,Birgitte N,et al.Novel high-affinity and selective biaromatic 4-substituted γ-hydroxybutyric acid(GHB)analogues as GHB ligands:design,synthesis,and binding studies[J].Journal of Medicinal Chemistry,2008(51):8088-8095.
[13]杨倩,王四旺,王剑波,等.椒目中α-亚麻酸的提取与鉴定[J].中国新药杂志,2008,17(4):318-320.
[14]Nakanishi T,Murata H,Inatomi Y,et al.Screening of anti-HIV-1 activity of North American plants.Anti-HIV-1 activities of plant extracts,and active components of Lethalia vulpine[J].Hue.Nat.Med.(Tokyo),1998,52(6):521-526.
[15]Kwon HC,Jung IY,Kim SY,et al.Cytotoxic constituents of Bombycis corpus [J].Yakhak Hoechi,1999,43(2):169-172.
[16]张敏,高晓红,孙晓萌,等.茯苓的药理作用及研究进展[J].北华大学学报,2008,9(1):46-56.
