新型核苷类似物FNC对Raji细胞增殖、凋亡和Bcl-6、PRDM1、C-myc表达的影响*
2013-11-21程旭芳董静静王陈萍江金花王庆端常俊标
张 艳,程旭芳,黄 刚,董静静,王陈萍,江金花,王庆端#,常俊标#
1)郑州大学医药科学研究院 郑州 450052 2)郑州大学药学院 郑州450001 3)郑州大学化学与分子工程学院 郑州 450001
恶性淋巴瘤是一种起源于淋巴造血组织的实体瘤,临床表现变化多端,特别是非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),易侵犯结外组织,给临床诊断和治疗带来很大困难。化学治疗在侵袭性NHL的综合治疗中占主导地位,但传统化疗方案的治愈率较低[1]。目前,核苷类似物作为一类重要的抗肿瘤药物,占据抗癌药物市场近五分之一的份额[2]。核苷类药物的化学结构与体内正常代谢物相似,可掺入到细胞的DNA与RNA中,抑制核酸的生成,干扰细胞的正常代谢。2’-脱氧-2’-氟-4’-叠氮-核苷类似物(FNC)由郑州大学化学与分子工程学院合成,前期的研究[3]发现FNC可能对NHL有较好的治疗作用。作者选用高侵袭性人Burkitt淋巴瘤Raji细胞作为研究对象,探讨FNC对Raji细胞增殖的影响及其作用机制。
1 材料与方法
1.1主要试剂和仪器RPMI 1640培养液、DMSO和四甲基偶氮唑蓝(MTT)购自美国Solarbio公司;胎牛血清购自杭州四季青公司;Annexin-Ⅴ-FITC/PI凋亡检测试剂盒购自美国BD公司;Trizol购于英俊公司;RT-PCR试剂盒购于宝生物公司;PCR引物由宝生物公司合成; Bcl-6、C-myc、β-actin抗体和山羊抗兔IgG均购于博奥森公司;PRDM1抗体购自Santa Cruz公司。Raji细胞购自中国科学院上海细胞库,使用含有体积分数10%胎牛血清的RPMI 1640培养基,在饱和湿度、37 ℃、体积分数5%CO2培养箱中常规培养。PCR扩增仪(Biometra公司);凝胶成像分析系统和核酸蛋白分析仪(Eppendorf 公司);DYY-6C型稳压稳流电泳仪(北京六一仪器厂);酶联免疫检测仪、垂直电泳系统和电转系统(Bio-Rad公司);流式细胞仪(Beckman Coulter公司);紫外透射分析仪(柯达公司)。
1.2细胞增殖情况的检测采用MTT法。取对数生长期的细胞,调整细胞密度为9×107L-1,接种于96孔培养板中,100 μL/孔,实验组分别加 0.035、0.350、3.500、35.000、350.000 μmol/L FNC,每个浓度均设5个复孔。同时设空白组(只加培养液)、阴性对照组(不加药)。培养24、48和72 h后,每孔加入5 g/L MTT溶液20 μL,继续培养4 h。离心25 min,吸弃上清液,加入 DMSO 150 μL/孔,振荡混匀后,用酶联免疫检测仪测570 nm波长下各孔的吸光度(A)值。实验重复3次。细胞增殖抑制率=(1-实验组平均A值/阴性对照组平均A值)×100%。
1.3细胞周期的检测取对数生长期细胞,以1.5×109L-1的密度接种于6孔板中,分组处理,分别加入不同浓度的FNC或等体积培养液,使终浓度为0(对照)、0.035、0.175、0.875、4.375 μmol/L,培养48 h后收集细胞。用预冷的PBS洗涤细胞2次,离心5 min,弃上清液。加入预冷的乙醇溶液固定,于4 ℃下过夜。用流式细胞仪分析,按Cell Quest软件检测并分析细胞周期分布。实验重复3次。
1.4细胞凋亡的检测实验分组同1.3,培养48 h后收集细胞,用预冷的PBS洗涤并离心,按 AnnexinⅤ-FITC/PI 凋亡检测试剂盒说明书操作,于1 h内上流式细胞仪,用Cell Quest软件检测并分析细胞凋亡和死亡的情况。结果判断:FITC-/PI-为活细胞,FITC-/PI+为坏死细胞,FITC+/PI-为凋亡细胞, FITC+/PI+为凋亡后继发死亡的细胞。实验重复3次。细胞凋亡率=(凋亡细胞数+继发死亡细胞数)/全部细胞数×100%。
1.5细胞中Bcl-6、PRDM1、C-mycmRNA的检测
采用RT-PCR 法。实验分组同1.3,培养48 h后收集细胞,用预冷的PBS洗涤2次,弃去上清,加入Trizol提取细胞总RNA,反转录成cDNA,以cDNA为模板进行PCR。引物设计见表1。PCR反应条件:94 ℃预变性 5 min;94 ℃变性30 s,退火(Bcl-6为52 ℃,PRDM1为56 ℃,C-myc为53 ℃)50 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min ,4 ℃保存。于30 g/L琼脂糖凝胶上电泳,用紫外透射分析仪观察结果。实验重复3次。采用Quantity one进行条带光密度测定,以目的基因与β-actin 条带光密度的比值作为目的基因mRNA的相对表达量。

表1 引物序列
1.6细胞中Bcl-6、PRDM1、C-myc蛋白的检测采用Western blot法。实验分组同1.3,培养48 h后收集细胞,用预冷的PBS洗涤2次,弃上清,提取细胞总蛋白,Bradford法测定蛋白含量。取蛋白30 μg进行SDS-PAGE电泳,将蛋白样本转移至NC膜上,用5 g/L脱脂奶粉封闭1 h,分别加入抗Bcl-6、抗PRDM1和抗C-myc多克隆抗体(均稀释200倍),4 ℃ 过夜。加入辣根过氧化物酶标记山羊抗兔IgG(稀释1 000倍),脱色摇床摇1 h,ECL显影成像。实验重复3次。用 Quantity one进行条带光密度测定,以目的蛋白与β-actin条带光密度的比值作为目的蛋白的相对表达量。
1.7统计学处理采用SPSS 17.0 进行分析,采用5×3析因设计的方差分析对细胞增殖抑制率进行分析,应用单因素方差分析对各组细胞周期、凋亡率和Bcl-6、PRDM1、C-myc mRNA及蛋白的相对表达量进行分析,两两比较用LSD-t检验,检验水准α=0.05。
2 结果
2.1FNC对Raji细胞增殖的影响见表2。

表2 FNC处理后Raji细胞增殖抑制率测定结果(n=3) %
F浓度=4 869.984,F时间=1 785.062,F交互=126.281,P均<0.001。
2.2FNC对Raji细胞周期及凋亡的影响见表3。

表3 FNC处理48 h后Raji细胞周期及凋亡率测定结果(n=3) %
*:两两比较,P均<0.05。
2.3FNC对Raji细胞Bcl-6、PRDM1、C-mycmRNA和蛋白表达的影响RT-PCR和Western blot结果见图1、2,FNC处理48 h后Raji细胞Bcl-6、PRDM1及C-myc mRNA与蛋白表达的分析结果见表4。
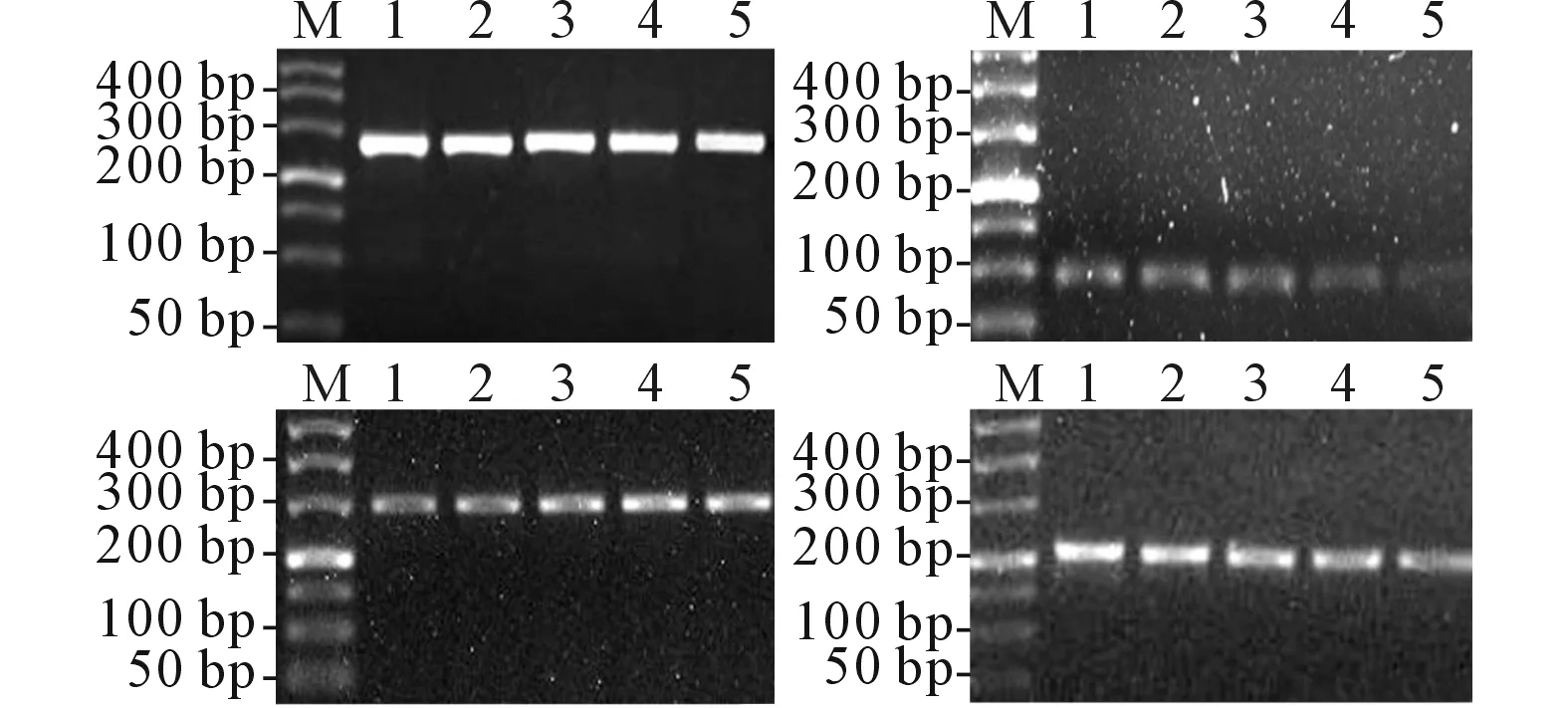
图1 Bcl-6、PRDM及C-myc mRNA测定结果

表4 FNC处理48 h后Raji细胞Bcl-6、PRDM1及C-myc mRNA与蛋白的表达(n=3)
*:两两比较,P均<0.05。
3 讨论
作者通过MTT法检测显示,FNC对人Burkitt淋巴瘤Raji细胞的增殖具有明显的抑制作用,呈剂量、时间依赖性。
近年研究[4]发现,细胞周期调控异常和细胞凋亡在肿瘤的发生发展中起重要作用。细胞增殖是通过细胞周期的运转来实现的。该研究结果显示,随着FNC浓度的增加,G0/G1期细胞增多,提示FNC抑制细胞的增殖可能与其阻滞细胞从G0/G1期向S期的转变有关,使细胞不能进入S期进行DNA的合成,最终导致增殖抑制,该作用呈明显的剂量-效应关系,提示诱导凋亡可能是FNC抗肿瘤作用的机制之一。
Bcl-6是一个含有锌指结构的转录抑制因子,是原癌基因,在很多类型的淋巴瘤中都能检测到Bcl-6基因的异常高表达。Bcl-6可以通过抑制p27及CCND2的表达,促进淋巴瘤细胞增殖;通过抑制PDCD2基因及P53基因,抑制淋巴瘤细胞凋亡[5-6]。Bcl-6可通过抑制PRDM1表达,抑制B细胞分化为成熟的浆细胞,从而导致淋巴瘤的发生[7]。PRDM1是一个含有5个锌指结构的转录抑制因子,是抑癌基因,又名B淋巴细胞诱导成熟蛋白,是参与B细胞和T细胞终末分化的关键调控因子[8-9],PRDM1功能的异常可导致B细胞不能分化为浆细胞而最终导致肿瘤的发生。研究[10]显示PRDM1有α与β转录本,可能是2个转录本的表达及比例异常导致了肿瘤的发生。C-myc是PRDM1直接抑制的下游基因[11],是一个原癌基因。C-myc是Burkitt淋巴瘤的遗传学标志[12],其功能是改变细胞周期、凋亡,促进细胞增殖及抑制细胞分化而引起淋巴瘤的发生[13]。C-myc 基因的异常表达是癌变过程中较早出现的分子改变,活化的C-myc 可以作为原癌基因参与肿瘤的形成及发展[14]。C-myc也可通过抑制其下游基因,而对细胞的凋亡和细胞周期产生影响[15]。该研究结果显示,在FNC作用下,Raji细胞中Bcl-6的表达降低,PRDM1的表达升高,从而导致C-myc的表达降低,从而产生抗肿瘤作用。
综上所述,FNC可下调Bcl-6、C-myc的表达,上调PRDM1的表达,从而抑制Raji细胞的增殖,诱导细胞凋亡。这可能是FNC抗肿瘤作用的重要机制。
[1] Macias-Perez IM, Flinn IW. B-cell receptor pathobiology and targeting in NHL[J]. Curr Oncol Rep, 2012, 14(5): 411
[2] 刘洋,李明花,邢向红.核苷类抗肿瘤药物研究进展[J].中国新药杂志,2012,21(21):2493
[3] Wang Q,Liu X,Zhang Y,et al.FNC,a novel nucleoside analogue inhibits cell proliferation and tumor growth in a variety of human cancer cells[J].Biochem Pharmacol,2011,81(7):848
[4] Hopker K, Reinhardt HC. p53-regulating pathways as targets for personalized cancer therapy[J].Dtsch Med Wochenschr,2013,138(3):82
[5] Baron BW, Hyjek E,Glandstone B,et al. PDCD2, a protein whose expression is repressed by BCL6, induces apoptosis in human cells by activation of the caspase cascade [J].Blood Cells Mol Dis, 2010, 45(2):169
[6] Cabanillas F. Non-Hodgkin’s lymphoma: the old and the new[J]. Clin Lymphoma Myeloma Leuk,2011,11(Suppl 1):S87
[7] Calame K. Activation-dependent induction of Blimp-1[J]. Curr Opin Immunol, 2008, 20(3): 259
[8] 张燕, 张群岭,洪小南. PRDM1基因功能及其在淋巴瘤发生、发展中的研究进展[J]. 中国癌症杂志, 2011,21(9):731
[9] Cayer MP, Drouin M,Proulx M,et al. 2-Methoxyestradiol induce the conversion of human peripheral blood memory B lymphocytes into plasma cells[J].J Immunol Methods, 2010, 355(1/2): 29
[10]Kis LL, Salamon D,Persson EK,et al.IL-21 imposes a type Ⅱ EBV gene expression on type Ⅲ and type Ⅰ B cells by the repression of C- and activation of LMP-1-promoter[J]. Proc Natl Acad Sci USA, 2010,107(2): 872
[11]Leucci E, Onnis A,Cocco M,et al. B-cell differentiation in EBV-positive Burkitt lymphoma is impaired at posttranscriptional level by miRNA-altered expression[J]. Int J Cancer, 2010, 126(6):1316
[12]Bueno MJ,Gómez de Cedrón M, Gómez-López G,et al. Combinatorial effects of microRNAs to suppress the Myc oncogenic pathway[J]. Blood, 2011, 117(23): 6255
[13]Choi SY,Kim SJ,Kim WS, et al. Aggressive B cell lymphomas of the gastrointestinal tract: clinicopathologic and genetic analysis[J]. Virchows Arch, 2011, 459(5): 495
[14]申志华,李飞虹,姜汉国,等. PTTG 与C-MYC在非霍奇金淋巴瘤中的表达及意义[J].现代肿瘤医学,2008,16(1) : 99
[15]Zhang L, Sang H,Liu Y,et al.Manganese activates caspase-9-dependent apoptosis in human bronchial epithelial cells[J]. Hum Exp Toxicol, 2012 Dec 21[Epub ahead of print]
