碳青霉稀类耐药肺炎克雷伯菌耐药机制和多位点序列分型研究
2013-11-20彭乃杰林哈妮李克诚葛少红
彭乃杰, 林哈妮, 夏 菲, 李克诚, 张 青, 葛少红
(瑞安市人民医院检验科,浙江瑞安325200)
碳青霉烯类抗菌药物被认为是为数不多的可有效治疗高产 AmpC酶和超广谱 β-内酰胺酶(ESBLs)多重耐药菌引起的严重感染的药物之一。然而,随着碳青霉烯类药物在临床中的大量、广泛应用,碳青酶烯类耐药的肠杆菌科细菌不断增加。其机制主要是细菌产生的碳青霉烯酶能够水解碳青霉稀类抗生素。肺炎克雷伯菌产生碳青霉烯酶主要为产KPC酶。KPC是一种质粒介导的Ambler分类B类酶,能水解几乎所有的β-内酰胺酶和碳青霉稀类抗菌药物。
多位点序列分型(MLST)通过测序来揭示保守基因的等位基因突变来对病原菌进行分型和鉴定。由于不同实验室能通过网络与基于核苷酸的DNA数据库进行比对,且基于DNA的模式能更好的反应菌株间的遗传变异情况,使得MLST技术在了解流行病学特征、病原菌的传播途径、追溯传染源及临床传染性疾病诊断中发挥了重要作用。
由于本地区尚缺乏碳青霉稀类耐药肺炎克雷伯菌的耐药机制和分子流行病学资料。因此,我们使用MLST和Minimum spanning trees分析研究本地区碳青霉烯类耐药肺炎克雷伯菌基因特征和遗传性质。
一、材料和方法
1.菌株来源 收集瑞安人民医院2010年1月至12月临床分离的耐碳青霉烯类抗菌药物的肺炎克雷伯菌8株。
2.仪器与试剂 Vitek2全自动微生物系统及其配套的鉴定卡(法国生物梅里埃公司),E-test试条(瑞典AB BIODISK公司产品)。
3.菌株鉴定 分离纯化菌株,采用Vitek2全自动微生物系统及其配套的鉴定卡。
4.体外药敏试验 药敏试验按照美国临床实验室标准化协会(CLSI)推荐纸片扩散法,药敏纸片(头孢唑啉、头孢西丁、亚胺培南、阿米卡星、左氧氟沙星、复方磺胺甲噁唑、氨曲南、头孢他啶、头孢曲松、哌拉西林-他唑巴坦、头孢呋辛、头孢哌酮-舒巴坦、美洛培南、庆大霉素、环丙沙星、呋喃妥因、头孢吡肟、头孢噻肟)由英国OXOID公司提供。
5.E-test药敏试验 将0.5麦氏比浊度的实验菌株分别均匀涂布于M-H琼脂平板上,于平板上贴亚胺培南、美罗培南E-test药敏纸片。根据CLSI 2010年6月更新的准则判断结果。
4.改良Hodge试验 将0.5麦氏比浊度的大肠埃希菌(ATCC25922)均匀涂布于M-H琼脂平板上,再将10μg/片亚胺培南纸片贴于平板的中间,将实验菌株分别以亚胺培南纸片为起点,沿离心方向划线,35℃培养过夜,抑菌圈内呈矢状者为阳性,并设阴、阳性对照。
5.PCR扩增及测序 煮沸裂解法提取实验菌株全基因,用引物KPC-F(5'-GCTACACCTAGC TCCACCTTC-3')、KPC-R(5'-GCATGGATTACCAAC CACTGT-5')扩增blaKPC基因。循环参数:94℃预变性5 min,94 ℃ 45 s、55 ℃ 45 s、72 ℃ 45 s,30 个循环后72℃延伸10 min。扩增产物送上海生工生物有限公司测序部双向测序。测序结果用BLAST比对(http://www.ncbi.nlm.nih.gov/BLAST)。
6.MLST分析 对实验菌株的7个管家基因(rpoB、gapA、mdh、pgi、phoE、infB、tonB)参照http://www.pasteur.fr/recherche/genopole/PF8/mlst/primersKpneum oniae.html公布的通用引物及退火温度进行PCR扩增并测序,将序列与数据库中储存的序列比对,确定其等位基因谱型及菌株序列型(ST型)。利用官方提供的工具生成Minimum spanning trees。
二、结果
1.菌株鉴定 采用Vitek2全自动微生物系统鉴定实验菌株均为肺炎克雷伯菌。
2.K-B药敏试验 实验菌株临床常规药物敏感实验均为耐药。
3.E-test药敏试验 用E-test药敏试验进行实验菌株的最小抑菌浓度(MIC)测定,显示所有菌株对亚胺培南、美罗培南耐药,MIC均>32 mg/L。
4.改良Hodge试验 实验菌株Hodge试验均阳性。
5.PCR扩增及测序 用KPC引物扩增并电泳可见实验菌株均有1条1 000 bp左右的条带,见图1。测序结果进行比对均为KPC-2。
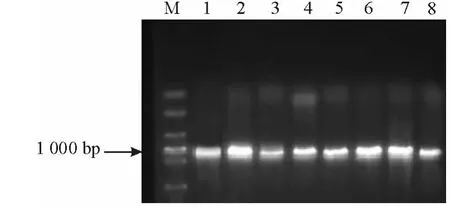
图1 bla KPC PCR产物
6.MLST分析 MLST显示有4种ST型,流行型为ST-11(5/8),此外 ST-494、ST-15、ST-258各1株,见表1。

表1 MLST和KPC结果
三、讨论
碳青霉烯酶是指能够明显水解至少一种碳青霉烯类抗菌药物的一类β内酰胺酶,肠杆菌科细菌产生碳青霉烯酶是其对碳青霉烯类抗菌药物耐药的主要机制。在浙江瑞安地区2010年总共分离出了8株碳青霉烯类耐药肺炎克雷伯菌,经纸片扩散法和E-test测定均对亚安培能和美罗培南耐药。经PCR扩增和测序表明其耐药机制均为产KPC-2型碳青霉烯酶,和文献[1-4]报道一致。
最近,ST-258型的产KPC肺炎克雷伯菌作为一种主要的分子流行克隆型被全球广泛报道。本研究结果显示在瑞安地区ST-11为产KPC肺炎克雷伯菌中主要的克隆型(5/8),与文献[4]报道的一致。ST-11与ST-258只有一个单基因位点变异(ton B),这表明他们之间密切相关。ST-11和ST-258属于同一个克隆复合体CC258,这个复合体包括了 ST-11、ST-258和其他 5个 ST型(ST270、ST340、ST379、ST407和 ST418)。CC258与耐万古霉素肠球菌(VRE)的CC17及耐碳青霉烯类鲍曼不动杆菌(CRAB)的CC22以同一种方式广泛传播。ST-11可能是产KPC酶肺炎克雷伯菌的另一种优势克隆型。由此可以推断有些ST型(ST-11和ST-258)可能比较容易在质粒存留,使这些菌株在人群中传播。
另外,ST-15与ST-14有一个单基因位点变异(inf B),可能属于另一个克隆复合体。ST-15可能只在美国中西部地区局限型传播[5]。在国内,杭州一家医院有报道过一例[4]。本研究中有一株ST-15,属于散发流行。2011年希腊首次报道了ST-494[6],本研究中ST-494为国内首次报告。
在国内,产KPC酶肺炎克雷伯菌以前只在少数地方报道过,现在已经全国流行。瑞安地区产KPC酶肺炎克雷伯菌也越来越多的被发现。产KPC酶肺炎克雷伯的蔓延令人担忧。因此,我们应认真关注这一问题,密切监测和采取严格的感染控制措施来控制医院感染。
[1]朱健铭,刘国庆,姜如金,等.多药耐药肺炎克雷伯菌β-内酰胺类耐药机制研究[J].中华医院感染学杂志,2012,22(4):674-678.
[2]Wei ZQ,Du XX,Yu YS,etal.Plasmid-mediated KPC-2 in a Klebsiella pneumoniae isolate from China[J].Antimicrob Agents Chemother,2007,51(2):763-765.
[3]冯雅君,沈 萍,杜小幸,等.产碳青霉烯酶KPC-2肺炎克雷伯菌局部流行[J].浙江医学,2008,30(9):923-925.
[4]Qi Y,Wei Z,Ji S,etal.ST11,the dominant clone of KPC-producing Klebsiella pneumoniae in China[J].JAntimicrob Chemother,2010,66(2):307-312.
[5]Kitchel B,Rasheed JK,Patel JB,etal.Molecular epidemiology of KPC-producing Klebsiella pneumoniae isolates in the United States:clonal expansion of multilocus sequence type 258[J].Antimicrob Agents Chemother,2009,53(8):3365-3370.
[6]Giakkoupi P,Papagiannitsis CC,Miriagou V,etal.An update of the evolving epidemic of blaKPC-2-carrying Klebsiella pneumoniae in Greece(2009-10)[J].J Antimicrob Chemother,2011,66(7):1510-1513.
