细菌中LuxS/AI-2密度感应系统分子机制研究进展
2013-11-20杨瑞宁李先富
杨瑞宁, 操 敏, 李先富, 牛 雷
(1.解放军81医院检验科,江苏 南京210002;2.南京军区疾病预防控制中心,江苏南京210002)
近年来的研究证明,细菌之间存在信息交流,许多细菌都能合成并释放一种称为自诱导物质(autoinducer,AI)的信号分子。胞外的AI浓度能随细菌密度的增加而增加。当达到临界浓度时,AI能结合并激活细胞内受体,启动菌体中相关基因的表达,从而调控细菌的生理行为,产生毒力因子等,使细胞的活动具有组织性,成为类似于多细胞生物的群体性活动。由于这一现象是细菌密度依赖的方式,因此称为密度感应(quorum sensing,QS)。
目前,已发现多种QS系统,他们或分别或共同作用,调控细菌的代谢、生理、毒力等多种功能。我们介绍的是在革兰阳性和阴性细菌中共同的LuxS/AI-2 QS信号系统:信号分子为呋喃酰硼酸二酯(furanosylborate diester)一类分子,能被不同种属细菌识别,即AI-2信号分子,其合成主要依赖于在许多菌属序列保守的 luxS基因编码的LuxS蛋白酶。目前已报道在超过80种细菌中广泛存在[1-2]。我们从该系统信号分子的AI-2发现、合成、LuxS蛋白结构及其与信号分子相互作用的机制等方面综述了该系统分子机制的研究进展,为寻找新型抗菌药物提供新靶点,也为控制感染提供新思路。
一、LuxS/AI-2 QS分子机制
(一)AI-2信号分子的发现
早在1993年,Bassler等[3]首次发现哈氏弧菌在产生并感应AI-1信号分子的同时,还能产生并感应AI-2信号分子。他们巧妙地从哈氏弧菌野生株BB120中将感应AI-1的感应子失活突变,获得哈氏弧菌突变株BB170(sensor1-,sensor2+),仅能感应AI-2引起的发光反应。因此,在AI-2介导QS成分未鉴定之前,用该报告菌株已检测到该诱导分子的存在[4]。1997年,他们发现不同种属的细菌如霍乱弧菌和副溶血性弧菌等都能引起哈氏弧菌的发光反应,表明AI-2活性是非特异性的[5]。1999年,仍是这个研究小组,利用基因文库、转座子图标等技术,从哈氏弧菌野生株BB120、沙门氏菌、大肠埃希菌中筛选到能产生AI-2信号的转化子,鉴定到合成AI-2的LuxS蛋白酶基因序列,并发现该基因碱基序列在许多细菌中高度保守[6]。
(二)AI-2的合成途径
虽然1999年Surette等鉴定了LuxS蛋白能产生AI-2,2002年Winzer等[7]在看40年前文献时无意中发现,早在上世纪60年代,就有关于LuxS蛋白作为活化甲基循环(activated methyl cycle,AMC)途径中代谢酶的描述,并阐述了AI-2前体4,5-二羟基2,3-戊二酮(4,5-dihydroxy 2,3-pentailedion,DPD)的形成机制。AI-2的合成由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)通过三步酶催化反应生成。SAM作为甲基供体产生有毒的中间产物 S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),随即被 S-腺苷高半胱氨酸核苷酸酶水解为S-核糖高半胱氨酸(S-ribosylhomocysteine,SRH)和腺嘌呤,LuxS 蛋白作为SRH裂解酶,催化SRH产生高半胱氨酸。高半胱氨酸经过至少三步反应再生成SAH,进入下一轮循环。DPD经过自发环化形成AI-2。AI-2其实是一类信号分子的总称,他们均由共同的前体DPD转变而来。在大多数已知产生AI-2的细菌中,合成AI-2的途径都是相同的,由LuxS蛋白催化产生。然而,基于一些没有LuxS蛋白同源物的高等有机体能产生AI-2类似活性,并且体外实验证实,D-5-磷酸核酮糖(ribulose-5-phosphate,Rul-5-P)能自发去磷酸形成DPD,DPD自发环化形成能产生AI-2发光活性的4-羟-5甲基呋喃[4-hydroxy-5-methyl-3(2H)-furanone,MHF][8]。2008年有学者发现,大肠埃希菌pgi-eda-edd luxS突变菌株以Rul-5-P为专一中间产物,完全通过氧化戊糖途径降解葡萄糖。但在其富含葡萄糖培养上清液中,可检测到微弱的AI-2样活性。提示Rul-5-P很可能在体内提供一种不依赖LuxS蛋白形成AI-2的新路线[9]。但他们也指出,这种不依赖LuxS蛋白形成AI-2的途径在大肠埃希菌中是可以忽略的,可能在缺乏LuxS蛋白的菌株中起作用[10]。由Rul-5-P自动转化产生足以检测到AI-2活性的DPD水平具有重要意义。Rul-5-P在代谢活跃的细胞中无所不在,很可能AI-2类似分子是所有有机体戊糖磷酸代谢的内在产物,不依赖LuxS蛋白酶催化。有报道在化脓性链球菌、猪链球菌2型、变形链球菌的luxS突变株培养上清液中都检测到微弱AI-2信号[11-12]。此外,这也可以解释在不含LuxS蛋白同源物的细菌中,如草木樨中华根瘤菌中也存在Lsr-型的AI-2摄取和AI-2激酶系统[13],可能是为了尽可能地减少内源生成DPD产物的损失或是掠夺微环境中其他细菌、植物释放的AI-2类分子。
(三)AI-2分子结构
AI-2的分子结构最早是 Chen等[14]在2002年研究哈氏弧菌的AI-2受体蛋白LuxP结晶结构时,偶然发现与其结合共结晶的AI-2分子,通过X-射线结晶学分析揭示其结构为呋喃酰硼酸二酯。2004年,Miller在对大肠埃希菌和沙门氏菌研究中,以相同的方法确定了与胞质结合蛋白LsrB(LuxS调节B蛋白)结合的AI-2结构为呋喃酰二酯(R-THMF),而并不是硼酸呋喃酯[15]。这种区别可能是因为硼在海洋环境很丰富,而大肠埃希菌和沙门氏菌生存的小肠环境则很少的缘故。R-THMF与D-核糖的相似性很高。另一种已揭示的体外合成AI-2的分子结构为MHF,但他是否作为体内的AI-2分子起作用仍需要更多的证据。除此之外,虽然在超过70种细菌中报告有AI-2活性,但由于缺乏相关AI-2结合蛋白的信息,大多数细菌中AI-2具体结构尚不清楚。不同种属的AI-2分子可能存在一定差异,但都具有很高的相似性,可以被不同菌属相互识别,从而成为不同种属间交流的语言。
(四)LuxS蛋白结构
LuxS蛋白是一种小分子金属酶,催化SAM循环中一个稳定的硫醚键的非氧化还原裂解以产生AI-2。自然界能催化这种反应的酶很少,一般都需要具有氧化还原活性的辅助因子,但LuxS蛋白可以独立完成这个反应。至少有5种细菌(幽门螺旋杆菌、嗜血流感菌、耐辐射球菌、精细芽孢杆菌和变形链球菌)中的LuxS蛋白获得了晶体结构并进行了X射线衍射图形分析[16-21]。该活性蛋白以同源二聚体的形式存在,来自于2个亚基的氨基酸残基在二聚体界面上形成2个相同的活性位点,每个活性位点含有1个二价金属离子,起初认为是Zn2+,后来证实是Fe2+。对比多个菌属的LuxS同源氨基酸序列,发现LuxS蛋白序列中存在一个保守、稳定的模体(His-Xaa-Xaa-Glu-His,HXXGH)。该模体的2个组氨酸支链与金属离子配位,第4个配位点的半胱氨酸与水分子结合[17]。通过对哈氏弧菌LuxS氨基酸序列的深入研究发现,另一个革兰阴性菌特征性模体为Lys-Ile-Pro-Glu-Leu-Asn-Glu-Tyr,该序列与酪氨酸激酶磷酸化位点[Lys/Arg]-Xaa2-3-[Asp/Glu]-Xaa2-3-Tyr完全匹配,在已知的几种革兰阴性菌中该位点的结构非常保守[22]。在大肠埃希菌中Cys-84和Glu-57被证实在催化活性中起重要作用,还有S9、H11和Arg39对LuxS蛋白完整活性很重要。通过点突变分析,活性位点上第83位保守的半胱氨酸残基为LuxS蛋白催化活性所必需,且为该蛋白翻译后修饰位点[23-24]。在空肠弯曲菌中发现LuxS蛋白上决定AI-2分子活性的关键氨基酸G92D一个突变可导致细菌丧失产生AI-2分子的能力[25]。大多数LuxS蛋白在骨架结构中具有很高的相似性,但是Moitrayee Bhattacharyya等应用蛋白结构网络(protein structure networks,PSN)及图像理论分析手段,对23种细菌的LuxS蛋白晶体结构或模式结构的二聚体界面模体进行分析,发现不同类别LuxS蛋白结构界面模体在其支链相互作用水平上是有特征性差异的,并指出不同特征的界面与其生物功能如致病性之间存在一定关联。同时,他们还用该方法揭示了界面上潜在的突变位点和几何模式[26]。对于LuxS蛋白的结构分析可以使我们更好地理解LuxS蛋白在细菌中的作用,还可以为设计LuxS蛋白酶的抑制分子指明方向,探索研制新型抗菌剂。
(五)AI-2作用机制及影响因素
目前能与AI-2结合并确定作用机制的受体蛋白仅2种,分别是哈氏弧菌中的LuxP蛋白和大肠埃希菌及沙门氏菌中的LsrB蛋白,其作用机制有所不同。有报道RbsB(核糖结合蛋白)也能与AI-2结合,其作用机制尚不明确。
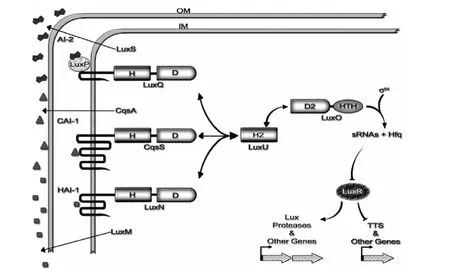
图1 哈氏弧菌多重QS系统的作用通路
1.通过受体LuxQP途径的AI-2感应调控机制 该途径目前仅在弧菌属发现,对于AI-2在哈氏弧菌中的调控机制了解得比较清楚[27]。LuxP是直接与AI-2结合的可溶性周质结合蛋白;LuxQ是一种双组分蛋白,与AH1-1受体LuxN类似,由感应激酶和反应调节蛋白2种成分组成,可识别AI-2/LuxP复合物。以AI-2感应发光为例阐述其作用机制:当环境中细菌密度低时(即无信号分子存在时),LuxQ通过自磷酸化将磷酸转移给磷酸转移酶蛋白LuxU,接着传递给反应调节蛋白LuxO。磷酸化的LuxO在活性状态下,与σ54一起激活小RNA,小RNA与其RNA伴侣Hfq一起,使编码激活蛋白LuxR的mRNA处于不稳定状态。由于LuxR是荧光素酶操纵子LuxCDABE转录所必须的,在此状态下细菌不发光。由于信号分子的作用,LuxQ从激酶状态转变为磷酸酶,磷酸的流向正好相反,去磷酸化的LuxQ是不活跃的,不能增强小RNA的表达,使得处于抑制状态的LuxR得以转录,LuxR结合LuxR启动子,激活荧光素酶的表达致使菌体发光。在哈氏弧菌中,有3个平行的QS系统,除AI-2/LuxS系统外,还有酰基高丝氨酸环内酯类AHI-1为信号分子的LuxM/LuxN QS系统,以及最先在霍乱弧菌中发现的霍乱自诱导分子1(cholerae autoinducer1,CAI-1)信号分子QS系统。在哈氏弧菌中这3个QS系统各自都能独立完成调控功能,但任何一个系统都可以对调控起增效作用,并且3个系统共享从LuxU开始的信号级联传递通路,见图1。实际上,在哈氏弧菌中3个QS系统都是通过该通路来调控靶基因的表达,包括调控生物发光、三型分泌系统、铁载体、多糖、非金属蛋白酶生成等多种生物功能[28]。在霍乱弧菌中有 2种 QS系统[29],即AI-2信号分子的LuxS/LuxP和CAI-1类的CqsSQS,也是通过与哈氏弧菌类似的QS信号传递通路调控靶基因,但目前这样的通路仅在弧菌属部分细菌中被发现。Sun等[1]对138种细菌微生物的全基因组序列进行检测发现,尽管LuxS广泛存在于不同细菌,其中仅28种细菌含有与LuxP结构类似的蛋白,104种细菌含有与LuxQ和LuxO类似的蛋白结构,但还没有足够的证据说明这些细菌微生物中亦存在与哈氏弧菌同样的AI-2感应识别路径,他们可能通过其他完全不同的感应通路识别AI-2,或者根本不存在QS系统。
2.通过ABC-转运子LsrB途径的AI-2作用机制 直接与AI-2结合的蛋白LsrB是通过众多寻找AI-2相关基因的研究发现的,主要在大肠埃希菌和沙门氏菌中存在[30-31],在引起牙周炎疾病的伴放线杆菌中也有报道[32]。在大肠埃希菌和沙门氏菌中,整个对数生长期都能检测到AI-2存在,但进入静止期后AI-2急剧减少,这个现象引起了研究者的兴趣。2001年Taga等[33]通过随机插入突变技术,鉴定了在沙门氏菌14028及其突变株中差异表达的7个基因位于同一操纵子IsrACDBFGE,能被胞外添加的AI-2激活。类似的操纵子于2005年在大肠埃希菌中也得到鉴定。Lsr操纵子前4个基因编码ABC型转运子,LsrB与核糖转运子Rbs高度同源,AI-2通过转运子进入细胞时磷酸化,然后与阻遏蛋白LsrR结合,诱导IsrACDBFGE的转录。细菌分泌到胞外的AI-2被运回细胞内的机制,从代谢角度可以认为通过Lsr(LuxS调节蛋白)转运AI-2可能是在优势碳源不足的情况下,AI-2作为戊糖参与到糖代谢途径;从QS的角度理解可以认为细菌为了避免周围环境中其他细菌掠夺他的信号资源而采取的措施。事实上,AI-2在大肠埃希菌和沙门氏菌中是否真的作为QS信号分子是一直有争议的。因为AI-2调节的靶基因IsrACDBFGE目前确认的功能就是摄取、磷酸化和降解AI-2,Lsr的转录可被代谢中间产物丝状噬菌体(M13K07)G3蛋白N端结构域(PⅢN1)基因和磷酸二羟丙酮抑制的事实也支持其代谢作用的说法。在伴放线杆菌中,已证实LsrB与AI-2结合并与QS功能密切相关,但尚未有直接调控靶基因的证据。很可能在弧菌外,用AI-2作为QS信号的细菌远没有想象中多,需要进一步寻找AI-2调控机制的证据来阐述在其他细菌中的QS现象。
3.可能通过RbsB蛋白的AI-2调控机制在伴放线菌属和非典型流感嗜血菌中都观察到RbsB蛋白在对AI-2应答中的重要作用。RbsB是核糖结合蛋白,也是一种 ABC型转运子,与LsrB蛋白存在一定相似性。在伴放线杆菌中,已证实RbsB和LsrB共同作为AI-2的结合蛋白,并以QseBC双组分蛋白作为AI-2调控单元的级联效应过程的组分,调控细菌的生物膜形成及毒力功能[32]。在非典型流感嗜血菌86-028NP株中,已证实RbsB是 AI-2结合蛋白,rbsB突变株与luxS突变株相似,生物膜变薄且总量及磷酸胆碱减少,细菌在栗鼠耳中存留能力降低,表明其是LuxS/AI-2调节蛋白,为摄入和应答AI-2所必需[34]。但目前还没有其直接调控靶基因的证据,该途径作用的通路还需进一步明确。关于AI-2调节作用的最新报道是对于幽门螺旋杆菌的研究,细菌通过化学感应受体TlpB将AI-2作为化学排斥剂来感应,这一作用与细菌的泳动功能相关[35];在沙门氏菌中,脂肪酸分子能调节AI-2对细菌侵袭力的影响[36],其具体作用机制尚不清楚。
二、针对LuxS/AI-2系统制定新型抗菌策略
随着LuxS/AI-2系统分子机制的揭示,提示了一种新型抗菌策略,即设计干扰致病菌LuxS/AI-2系统的新药物,以达到控制病菌的目的。目前已尝试的方法如下。
1.抑制LuxS蛋白酶活性 Malladi等[37]设计LuxS蛋白酶作用底物SRH的类似物,与SRH竞争结合LuxS蛋白酶活性位点,达到抑制AI-2分子产生的目的。
2.抑制AI-2分子信号功能 设计AI-2分子类似物,与受体蛋白竞争性结合来阻断AI-2介导的信号通路。Lönn-Stensrud 等[38]合成了(Z)-5-溴化亚甲基2(5H)-呋喃分子,发现该分子抑制了咽峡炎链球菌、中间链球菌和变形链球菌的生物膜形成及诱导哈氏弧菌 BB152发光能力,但对咽峡炎链球菌与中间链球菌luxS突变株形成生物膜能力无影响,显示出其干扰AI-2信号通路的作用。Ren等[39]发现由海洋红藻产生的天然(5Z)-4-溴-5-(溴化亚甲基)-3-丁基-2(5H)-呋喃作为AI-2抑制剂,通过干扰AI-2介导的QS抑制大肠埃希菌中生物膜的形成及成群现象,并且基因芯片分析结果显示,该溴化呋喃与AI-2作用于相似的一套基因,但对于基因表达所起的效应不同,从而改变了AI-2信号作用[40]。此外,还可以寻找降解AI-2分子的酶来干扰此QS系统。可以预见,对于致病菌的防控方面,QS系统是具有研究和应用前景的新药靶标。
三、结束语
LuxS/AI-2广泛分布于多种细菌中,目前除弧菌、大肠埃希菌、沙门氏菌外,大多数细菌中AI-2在体内的调控途径以及与相邻细菌交流的机制尚不清楚,诠释LuxS/AI-2在QS和代谢中的相关功能,可为寻找新型抗菌药物提供新靶点,为控制感染提供新思路,将具有重要的理论意义和临床应用价值。
[1]Sun J,Daniel R,Wagner-Döbler I,etal.Is autoinducer-2 a universal signal for interspecies communication:a comparative genomic and phylogenetic analysis of the synthesis and signal transduction pathways[J].BMC Evol Biol,2004,4:36.
[2]Bassler BL,Losick R.Bacterially speaking[J].Cell,2006,125(2):237-246.
[3]Bassler BL,Wright M,Showalter RE,etal.Intercellular signalling in Vibrio harveyi:sequence and function of genes regulating expression of luminescence[J].Mol Microbiol,1993,9(4):773-786.
[4]Tischler AS,Riseberg JC,Cherington V.Multiple mitogenic signalling pathways in chromaffin cells:a model for cell cycle regulation in the nervous system[J].Neurosci Lett,1994,168(1-2):181-184.
[5]Bassler BL,Greenberg EP,Stevens AM.Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi[J].J Bacteriol,1997,179(12):4043-4045.
[6]Surette MG,Miller MB,Bassler BL.Quorum sensing in Escherichia coli,Salmonella typhimurium,and Vibrio harveyi:a new family of genes responsible for autoinducer production[J].Proc Natl Acad Sci USA,1999,96(4):1639-1644.
[7]Winzer K,Hardie KR,Williams P.Bacterial cell-tocell communication:sorry,can't talk now-gone to lunch[J].Curr Opin Microbiol,2002,5(2):216-222.
[8]Winzer K,Hardie KR,Burgess N,etal.LuxS:its role in central metabolism and the in vitro synthesis of 4-hydroxy-5-methyl-3(2H)-furanone[J].Microbiology,2002,148(Pt 4):909-922.
[9]Sauer U,Canonaco F,Heri S,etal.The soluble and membrane-bound transhydrogenases UdhA and PntAB have divergent functions in NADPH metabolism of Escherichia coli[J].J Biol Chem,2004,279(8):6613-6619.
[10]Tavender TJ,Halliday NM,Hardie KR,etal.LuxS-independent formation of AI-2 from ribulose-5-phosphate[J].BMC Microbiol,2008,8:98.
[11]Lyon WR,Madden JC,Levin JC,etal.Mutation of luxSaffects growth and virulence factor expression in Streptococcus pyogenes[J].Mol Microbiol,2001,42(1):145-157.
[12]Cao M,Feng Y,Wang C,etal.Functional definition of LuxS,an autoinducer-2(AI-2)synthase and its role in full virulence of Streptococcus suis serotype 2[J].JMicrobiol,2011,49(6):1000-1011.
[13]Vendeville A,Winzer K,Heurlier K,etal.Making'sense'of metabolism:autoinducer-2,LuxS and pathogenic bacteria[J].Nat Rev Microbiol,2005,3(5):383-396.
[14]Chen X,Schauder S,Potier N,etal.Structural identification of a bacterial quorum-sensing signal containing boron[J].Nature,2002,415(6871):545-549.
[15]Miller ST,Xavier KB,Campagna SR,etal.Salmonella typhimurium recognizes a chemically distinct form of the bacterial quorum-sensing signal AI-2[J].Mol Cell,2004,15(5):677-687.
[16]Das SK,Sedelnikova SE,Baker PJ,etal.Cloning,purification,crystallization and preliminary crystallographic analysis of Bacillus subtilis LuxS[J].Acta Crystallogr D Biol Crystallogr,2001,57(Pt 9):1324-1325.
[17]Hilgers MT,Ludwig ML.Crystal structure of the quorum-sensing protein LuxSreveals a catalytic metal site[J].Proc Natl Acad Sci USA,2001,98(20):11169-11174.
[18]Lewis HA,Furlong EB,Laubert B,etal.A structural genomics approach to the study of quorum sensing:crystal structures of three LuxS orthologs[J].Structure,2001,9(6):527-537.
[19]Rajan R,Zhu J,Hu X,etal.Crystal structure of S-ribosylhomocysteinase(LuxS)in complex with a catalytic 2-ketone intermediate[J].Biochemistry,2005,44(10):3745-3753.
[20]Li H,Zhao H,Zhu L,etal.Crystallization and preliminary X-ray analysis of S-ribosylhomocysteinase from Streptococcus mutans[J].Acta Crystallogr Sect F Struct Biol Cryst Commun,2012,68(Pt 2):199-202.
[21]Bhattacharyya M,Vishveshwara S.Elucidation of the conformational free energy landscape in H.pylori LuxS and its implications to catalysis[J].BMC Struct Biol,2010,10:27.
[22]De Keersmaecker SC,Sonck K,Vanderleyden J.Let LuxS speak up in AI-2 signaling[J]. Trends Microbiol,2006,14(3):114-119.
[23]Pei D,Zhu J.Mechanism of action of S-ribosylhomocysteinase(LuxS) [J].Curr Opin Chem Biol,2004,8(5):492-497.
[24]Zhu J,Patel R,Pei D.Catalytic mechanism of S-ribosylhomocysteinase(LuxS):stereochemical course and kinetic isotope effect of proton transfer reactions[J].Biochemistry,2004,43(31):10166-10172.
[25]Plummer P,Zhu J,Akiba M,etal.Identification of a key amino acid of LuxSinvolved in AI-2 production in Campylobacter jejuni[J].PLoS One,2011,6(1):e15876.
[26]Bhattacharyya M,Vishveshwara S.Functional correlation of bacterial LuxS with their quaternary associations:interface analysis of the structure networks[J].BMC Struct Biol,2009,9:8.
[27]Henke JM,Bassler BL.Three parallel quorum-sensing systems regulate gene expression in Vibrio harveyi[J].JBacteriol,2004,186(20):6902-6914.
[28]Turovskiy Y,Kashtanov D,Paskhover B,etal.Quorum sensing:fact,fiction,and everything in between[J].Adv Appl Microbiol,2007,62:191-234.
[29]Miller MB,Skorupski K,Lenz DH,etal.Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae[J].Cell,2002,110(3):303-314.
[30]Taga ME,Miller ST,Bassler BL.Lsr-mediated transport and processing of AI-2 in Salmonella typhimurium[J].Mol Microbiol,2003,50(4):1411-1427.
[31]Xue T,Zhao L,Sun H,etal.LsrR-binding site recognition and regulatory characteristics in Escherichia coli AI-2 quorum sensing[J].Cell Res,2009,19(11):1258-1268.
[32]Novak E A,Shao H,Daep CA,etal.Autoinducer-2 and QseC control biofilm formation and in vivo virulence of Aggregatibacter actinomycetemcomitans[J].Infect Immun,2010,78(7):2919-2926.
[33]Taga ME,Semmelhack JL,Basler BL.The LuxS-dependent autoinducer AI-2 controls the expression of an ABC transporter that functions in AI-2 uptake in Salmonella typhimurium[J].Mol Microbiol,2001,42(3):777-793.
[34]Armbruster CE,Pang B,Murrah K,etal.RbsB(NTHI-0632)mediates quorum singnal uptake in nontypeable Haemophilus influenzae strain 86-028 NP[J].Mol Microbiol,2011 ,82(4):836-850.
[35]Rader BA,Wreden C,Hicks KG,etal.Helicobacter pylori perceives the quorum-sensing molecule AI-2 as a chemorepellent via the chemoreceptor TlpB[J].Microbiology,2011,157(Pt 9):2445-2455.
[36]Widmer KW,Jesudhasan P,Pillai SD.Fatty acid modulation of autoinducer(AI-2)influenced growth and macrophage invasion by Salmonella typhimurium[J].Foodborne Pathog Dis,2012,9(3):211-217.
[37]Malladi VL,Sobczak AJ,Meyer TM,etal.Inhibition of LuxS by S-ribosylhomocysteine analogues containing a [4-aza]ribose ring[J].Bioorg Med Chem,2011,19(18):5507-5519.
[38]Lönn-Stensrud J,Petersen FC,Benneche T,etal.Synthetic bromated furanone inhibits autoinducer-2-mediated communication and biofilm formation in oral Streptococci[J].Oral Microbiol Immunol,2007,22(5):340-346.
[39]Ren D,Sims JJ,Wood TK.Inhibition of biofilm formation and swarming of Escherichia coli by(5Z)-4-bromo-5-(bromomethylene)-3-butyl-2 (5H)-furanone[J].Environ Microbiol,2001,3(11):731-736.
[40]Ren D,Bedzyk LA,Ye RW,etal.Differential gene expression shows natural brominated furanones interfere with the autoinducer-2 bacterial signaling system of Escherichia coli[J].Biotechnol Bioeng,2004,88(5):630-642.
