结直肠癌组织和结肠癌细胞中miR-31的表达及功能*
2013-11-20王朝杰
王朝杰,马 宁,周 云
河南省人民医院(郑州大学人民医院)肿瘤科 郑州 450003
2002年,Calin等[1]首先在慢性B淋巴细胞白血病中发现miR-15a和miR-16在68%的患者中缺失或表达下调,从此人们把microRNA和肿瘤联系起来。在随后的十余年里,microRNA和肿瘤发生、发展的研究逐渐深入,microRNA有可能成为肿瘤诊断的标志物和治疗的新靶点[2-3]。人miR-31首先在HeLa细胞中被发现,定位于染色体9p21.3[4]。miR-31在结直肠癌组织中表达上调已被诸多实验[5-6]所证实。作者研究了结直肠癌组织中miR-31的表达,并对miR-31的功能进行了初步研究。
1 材料与方法
1.1临床标本的收集及处理收集2011年10月至2012年6月在河南省人民医院诊治的98例结直肠腺癌患者的临床资料。男51例,女47例,年龄24~83(54.3±15.1)岁。入选病例术前未行放、化疗,无其他肿瘤病史。收集患者肿瘤标本及距离肿瘤边缘5 cm以上的正常结直肠黏膜组织(均经病理证实)标本,一部分保存于-80 ℃冰箱,备RNA提取,剩余部分用体积分数10%甲醛固定24 h,常规石蜡包埋、切片及HE染色,光镜下观察。98例中局部浸润T1+T2+T3 62例,T4 36例;12例有脉管浸润。高分化1例,中分化68例,低分化29例。TNM Ⅰ期16例,Ⅱ期29例,Ⅲ期48例,Ⅳ期5例。其中27例患者有血清癌胚抗原水平资料。
1.2组织中miR-31表达水平的测定取约50 mg组织,剪碎,Trizol(美国分子研究中心)法提取总RNA,-80 ℃保存。按照TaKaRa逆转录试剂盒(大连宝生物工程有限公司)逆转录生成cDNA,-20 ℃保存备用。miR-31逆转录茎环引物序列如下:5’-GTCGTATCCAGTGCTGGGTCCGAGTGATTCGCACTG GATACGACCAGCTA-3’(Invitrogen上海生物有限公司)。内参基因5S rRNA应用随机引物(TaKaRa)进行逆转录。根据表1引物及探针序列行PCR扩增。PCR反应体系如下:10×Mg2+free PCR Buffer3.0 μL,25 mmol/L MgCl23.0 μL,2.5 mmol/L dNTPs 3.6 μL,20 μmol/L上、下游引物各0.5 μL,10 μmol/LTaqMan探针1.0 μL,5×106U/L的Taq酶0.3 μL,ddH2O 17.1 μL,cDNA 1.0 μL。阴性对照用ddH2O代替cDNA。实时荧光定量PCR反应程序如下:94 ℃预变性3 min;94 ℃变性20 s,55 ℃退火25 s,60 ℃延伸35 s,40个循环。目的基因的表达量:R=E目的ΔCT目的/E内参ΔCT内参。R表示经内参基因标准化后,肿瘤组织相对于正常结肠黏膜组织目的基因的变化倍数。R>1.0表示肿瘤组织目的基因表达上调,<1.0表示目的基因表达下调。E表示扩增效率;ΔCT表示对照黏膜与肿瘤组织中目的基因的Ct值之差。

表1 miR-31及内参5S rRNA的PCR引物及探针序列
1.3细胞实验
1.3.1 细胞培养 人结肠癌细胞系HCT-116p53+/+和HCT-116p53-/-(瑞典林雪平大学肿瘤中心惠赠)在McCoy’s 5A 培养液 (瑞典Sigma-Aldrich公司) 中培养,其中添加体积分数10%胎牛血清及体积分数1% PEST和1.5 mmol/L的L-glutamine (美国Invitrogen公司)。
1.3.2 转染前后miR-31表达水平的测定 以2×103个/孔接种细胞于96孔板,按照转染试剂盒siPORTTMNeoFXTM(美国Applied Biosystems) 的操作说明操作,转染终浓度为100 nmol/L的Anti-miRTMmiR-31 抑制剂(anti-miR-31)或Anti-miRTM阴性对照(美国Applied Biosystems)。同1.2方法采用实时荧光定量PCR测miR-31的表达,结果用REST处理。
1.3.3 转染前后细胞增殖检测 以2×103个/孔接种细胞于96孔板,分别转染100 nmol/L anti-miR-31或阴性对照。转染24、48、72、96 h后,每孔加入5 g/L的MTT各20 μL,37 ℃孵育4 h后,加入二甲基亚砜150 μL/孔,振荡10 min,在490 nm下读取吸光度值。
1.3.4 转染前后细胞周期分析 24孔板每孔接种2.7×104个细胞,分别转染100 nmol/L anti-miR-31或阴性对照,48 h后消化细胞,PI染色,用FACScan (美国Becton-Dickinsson)行流式分析,数据应用ModFit LT for Mac V 3.1软件进行分析。
1.3.5 细胞迁移实验 采用QCMTM24孔细胞迁移实验 (美国Millipore Corporation),按照说明书要求进行。主要步骤如下:细胞转染24 h后,在无血清培养基中饥饿培养12 h。收集细胞,4×104个细胞悬浮于300 μL无血清培养基中,种植于上室内。下室内加入500 μL含体积分数10%胎牛血清的培养基。16 h后,小心吸去上室内的培养液及细胞,并用棉签小心擦去膜上面尚未迁移的细胞,膜下面的细胞即为发生迁移的细胞。染色后每个膜选择5个有代表性的视野进行照相并计数,记录穿膜细胞数。
1.4统计学处理实时荧光定量PCR所得数据经对数转化后作为miR-31的相对表达量。miR-31在肿瘤组织中的整体相对表达变化及细胞转染前后miR-31的变化测定用REST分析(http://www.wzw.tum.de/gene-quantification)。应用SPSS 11.5处理数据,采用两独立样本的t检验比较结直肠癌患者miR-31的相对表达量和临床病理指标的关系;采用2×4析因设计的方差分析观察转染anti-miR-31不同时间对HCT-116p53+/+和HCT-116p53-/-细胞增殖的影响,采用两独立样本的t检验比较转染anti-miR-31对细胞周期分布及迁移能力的影响,检验水准α=0.05。
2 结果
2.1结直肠癌组织中miR-31的表达98例结直肠癌组织中,89例(91%)miR-31的表达上调,REST分析表明结直肠癌组织中miR-31的表达升高,是正常黏膜的15倍(P=0.001)。miR-31的表达与结直肠癌患者各指标的关系见表2。
2.2anti-miR-31转染对2种HCT-116细胞miR-31表达水平的影响实时荧光定量PCR结果显示,在HCT-116p53+/+和HCT-116p53-/-细胞中,转染后miR-31的水平分别是转染前的44.1%和67.8%(P=0.042和0.046)。
2.3anti-miR-31转染对2种HCT-116细胞增殖的影响见表3、4。anti-miR-31转染对细胞增殖无明显影响(P>0.05)。
2.4anti-miR-31转染对2种HCT-116细胞周期分布的影响见表5、6。anti-miR-31转染对细胞周期分布无明显影响(P>0.05)。
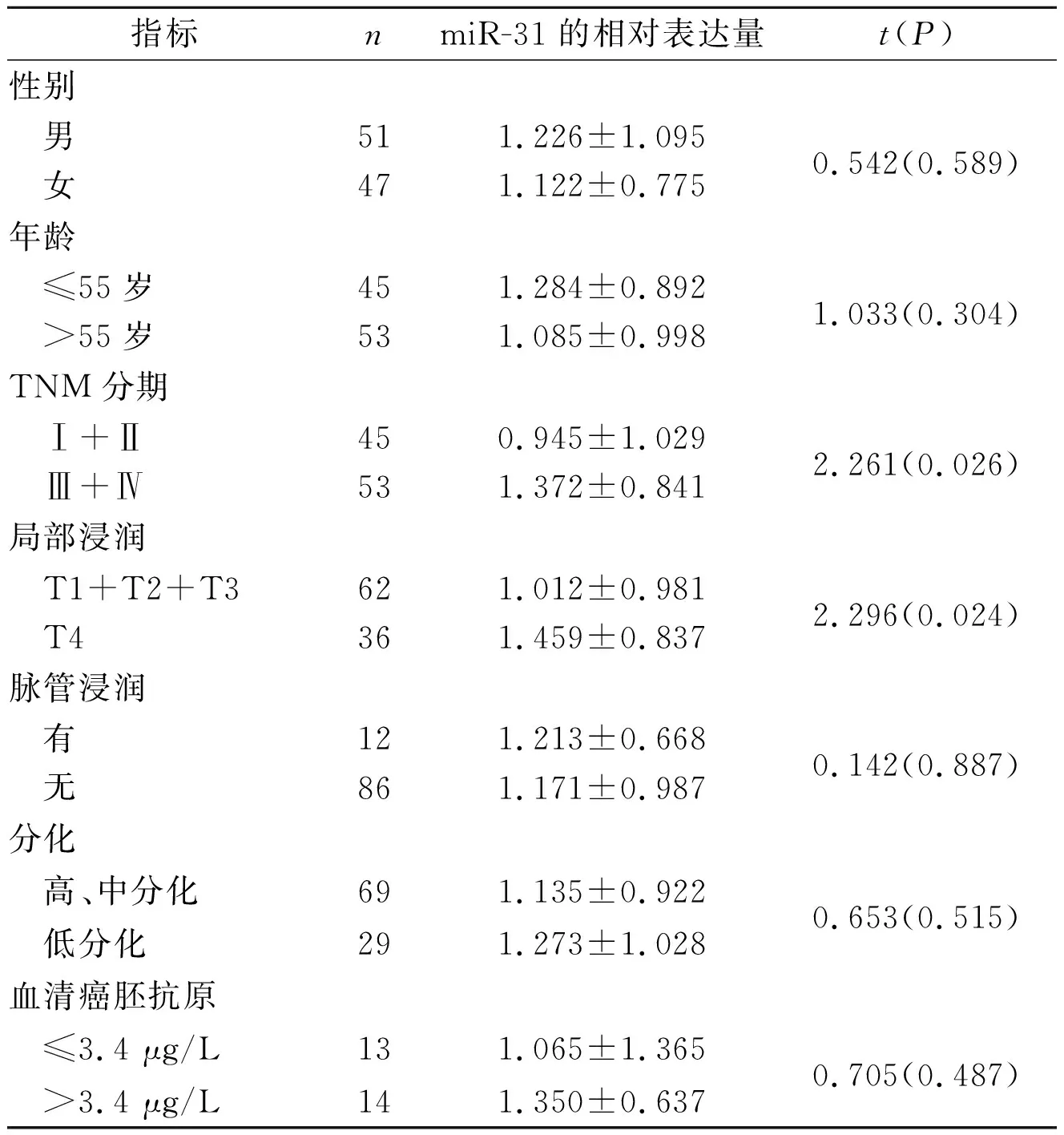
表2 miR-31的表达和结直肠癌患者各指标的关系
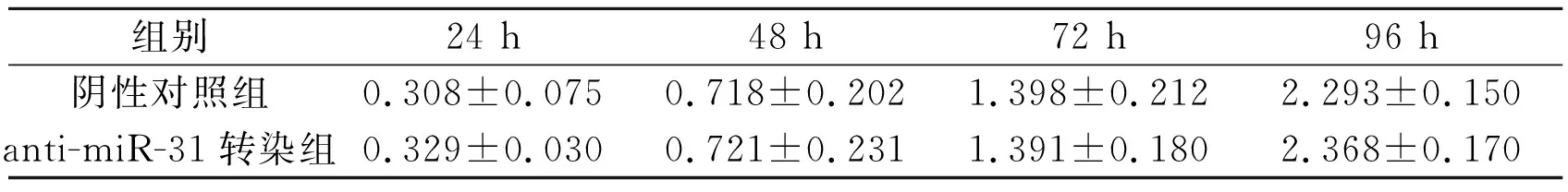
表3 anti-miR-31转染对HCT-116p53+/+细胞增殖的影响 (n=3)
F转染=0.112,P=0.743;F时间=162.187,P<0.001;F交互=0.072,P=0.974。

表4 anti-miR-31转染对HCT-116p53-/-细胞增殖的影响 (n=3)
F转染=0.616,P=0.444;F时间=214.951,P<0.001;F交互=0.327,P=0.806。
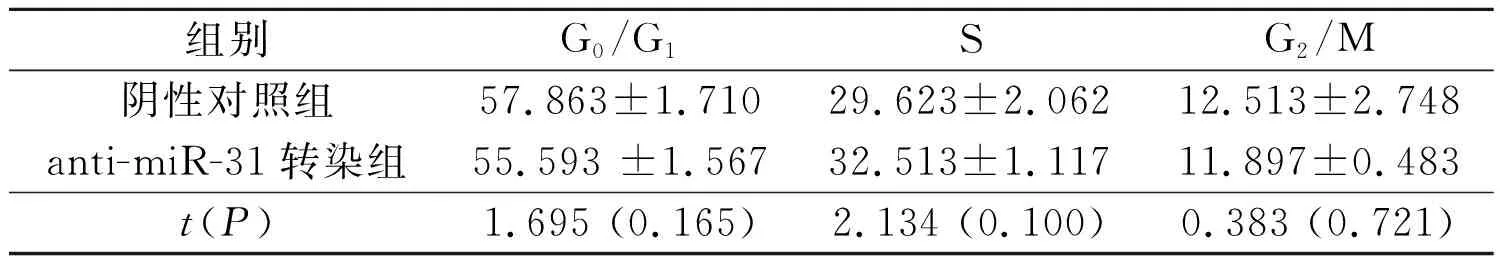
表5 anti-miR-31转染对HCT-116p53+/+细胞周期分布的影响 (n=3) %

表6 anti-miR-31转染对HCT-116p53-/-细胞周期分布的影响 (n=3) %
2.5anti-miR-31转染对2种HCT-116细胞迁移能力的影响见图1、表7。anti-miR-31转染可以明显降低细胞的迁移能力。
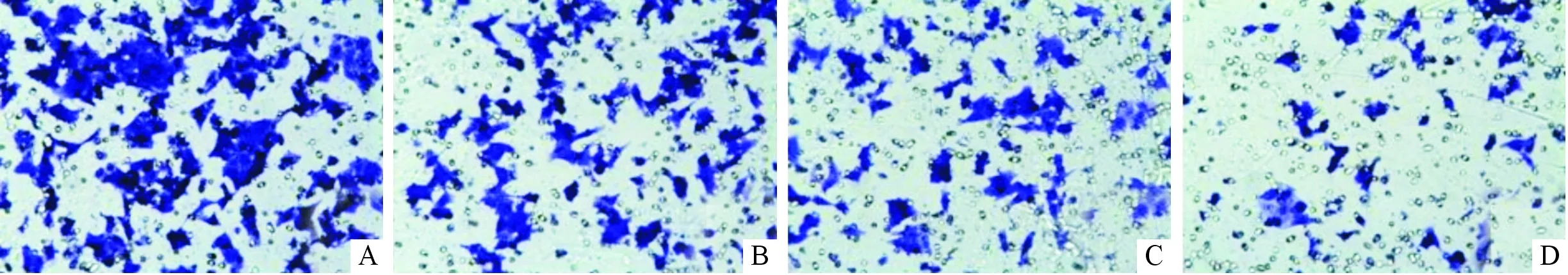
图1 anti-miR-31转染对2种HCT-116细胞迁移能力的影响(苏木素,×400)

表7 anti-miR-31转染对2种细胞迁移能力的影响
3 讨论
炎症性肠病患者结直肠癌的发病风险明显升高,从非炎症到炎症,再到不典型增生,直至最后癌变,miR-31的表达水平呈逐渐升高的趋势[7]。该研究结果显示结直肠癌组织中miR-31的表达水平是正常黏膜组织的15倍,提示miR-31高表达与结直肠癌的发生有关。
Bandrés等[8]在小样本(10例)研究中发现,miR-31在结直肠腺癌Ⅳ期中的表达高于Ⅱ期;Schee等[9]在大样本(100例)研究中也发现了miR-31和结直肠腺癌肿瘤分期有关,而Slaby等[5]和Xu等[10]的研究中却未发现miR-31和结直肠癌肿瘤分期的关系。这种差异的产生除和研究者纳入的样本量大小有关外,还可能和各个实验室所使用的研究方法不一致有关。该研究结果显示miR-31的表达和结直肠癌TNM分期及肿瘤局部浸润有关,推测miR-31可能参与了结直肠癌的发展。
有研究[11]显示,在结肠癌细胞系LIM1863中,miR-31可抑制TIAM-1,进而调节结肠癌细胞的侵袭和迁移。该研究结果显示,应用anti-miR-31转染结肠癌细胞HCT-116后,细胞中miR-31的表达水平降低,然而细胞的增殖及细胞周期并未受到影响,细胞的迁移能力与转染前相比降低了50%左右,提示抑制miR-31的表达影响结肠癌细胞的侵袭和迁移能力。
总之,miR-31在结直肠癌组织中高表达,且和肿瘤的分期及局部浸润有关,抑制miR-31的表达可以抑制肿瘤细胞的迁移能力;miR-31有可能成为结直肠癌潜在的诊断指标和治疗靶点。
[1]Calin GA, Dumitru CD, Shimizu M, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia [J]. Proc Natl Acad Sci USA, 2002, 99(24):15524
[2]沈洁,冯常炜,郝炳章,等.血清中miR-21和let-7a在胃癌无创性诊断及手术效果评定中的作用[J].郑州大学学报:医学版,2012,47(5):722
[3]吴春蓉,罗治彬,陈伟.miR-451对结肠癌细胞系SW620生物学行为的影响[J].解放军医学杂志,2011,36(5):478
[4]Lagos-Quintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs [J]. Science, 2001, 294(5543):853
[5]Slaby O, Svoboda M, Fabian P, et al. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer[J]. Oncology, 2007, 72(5/6):397
[6]Motoyama K, Inoue H, Takatsuno Y, et al. Over- and under-expressed microRNAs in human colorectal cancer [J]. Int J Oncol, 2009, 34(4):1069
[7]Olaru AV, Selaru FM, Mori Y, et al. Dynamic changes in the expression of microRNA-31 during inflammatory bowel disease-associated neoplastic transformation [J]. Inflamm Bowel Dis, 2012,18(4):641
[8]Bandrés E, Cubedo E, Agirre X, et al. Identification by real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues [J]. Mol Cancer, 2006, 5:29
[9]Schee K, Boye K, Abrahamsen TW,et al. Clinical relevance of microRNA miR-21, miR-31, miR-92a, miR-101, miR-106a and miR-145 in colorectal cancer [J]. BMC Cancer, 2012, 12: 505
[10]Xu XM, Qian JC, Deng ZL,et al. Expression of miR-21, miR-31, miR-96 and miR-135b is correlated with the clinical parameters of colorectal cancer [J]. Oncol Lett, 2012, 4(2):339
[11]Cottonham CL,Kaneko S,Xu L.miR-21 and miR-31 converge on TIAM1 to regulate migration and invasion of colon carcinoma cells [J].J Biol Chem,2010,285(46):35293
