活性维生素D3对糖尿病大鼠肾脏BMP-7及TGF-β1表达的影响
2013-11-20杨瑞凤王建生张宛哲赵瑛瑛孟晶茜申鹏霄张文吉
杨瑞凤,王建生,张宛哲,赵瑛瑛,孟晶茜,申鹏霄,张文吉
郑州大学第二附属医院肾内科 郑州 450014
糖尿病肾病(diabetic nephropathy, DN)是糖尿病常见的并发症,也是糖尿病患者的主要死亡原因之一[1],其确切的发病机制尚未完全清楚,目前治疗效果不理想。活性维生素D3的生物学作用广泛,其功能研究集中在调节钙磷代谢、细胞增生与分化、骨的再建及免疫调节[2]方面,近年来活性维生素D3的肾保护作用越来越受关注。转化生长因子-β1(transforming growth factor-beta 1, TGF-β1)高表达是导致糖尿病肾损害的重要环节。骨形成蛋白-7(bone morphogenetic protein-7, BMP-7)又称成骨蛋白-1,属转化生长因子超家族,能促进新骨的生成及修复,促进成骨细胞与软骨细胞的分化,是重要的肾保护因子,可通过抑制TGF-β1发挥抗肾纤维化作用[3]。作者观察了活性维生素D3对糖尿病大鼠肾脏BMP-7和TGF-β1表达的影响,探讨活性维生素D3肾脏保护作用的可能机制。
1 材料与方法
1.1主要试剂链脲佐菌素(STZ),美国Sigma公司;骨化三醇,上海罗氏公司;全自动生化仪(日立7600-010);兔抗大鼠BMP-7多克隆抗体,北京博奥森公司;兔抗大鼠TGF-β1多克隆抗体,Santa Cruz公司;Trizol及RT-PCR试剂盒,北京全式金生物有限公司;免疫组化试剂盒及免疫荧光试剂盒,北京中杉金桥生物工程有限公司。
1.2实验分组雄性SD大鼠36只,体质量225~275 g,由郑州大学实验动物中心提供。大鼠禁食不禁饮12 h后,随机取24只一次性腹腔注射60 mg/kg STZ(STZ用0.1 mmol/L无菌枸橼酸缓冲液配制,pH4.5)[4],72 h后尾静脉取血测血糖,血糖>16.7 mmol/L者为糖尿病大鼠,共造模成功22只。将22只大鼠随机分成糖尿病模型(DM)组,活性维生素D3(DC)组,每组各11只。余12只大鼠随机选取11只为正常对照(NC)组。DC组在模型建立后,将骨化三醇溶于0.05 mL花生油以0.03 μg/(kg·d)的剂量灌胃[5],NC组与DM组给予等量的花生油灌胃。实验期间大鼠均给予标准饮食,自由饮水,12 h光照周期,12周后处死,期间每组各死1只。处死前收集4~6 mL静脉血、24 h尿。切取双侧肾脏,称重,计算肾脏肥大指数,肾脏肥大指数=肾质量/体质量。取部分肾组织常规制片,其余肾组织液氮保存。
1.3肾组织形态学观察常规石蜡切片,PAS及Masson染色,观察肾小球基底膜、系膜区、肾小管及肾间质的改变。
1.4生化指标检测采用全自动生化仪检测24 h尿蛋白定量、血钙(Ca)、血尿素氮(BUN)、胱抑素C(Cys-C)、血肌酐(Scr)。
1.5肾组织BMP-7、TGF-β1mRNA的检测采用RT-PCR法检测。取约100 mg肾皮质按照Trizol说明书提取总RNA,取5 μg反转录成cDNA,进行PCR扩增。引物由北京博大泰克公司合成。BMP-7引物序列:上游5’-AAACAGCAGCAGTGACCAGA-3’,下游5’-GTCGTCGAAGTAGAGGACAGATA-3’,退火温度55 ℃,扩增产物长度为274 bp;TGF-β1引物序列:上游5’-CATCCCGCCCACTTTCTAC-3’,下游5’-CAAGCAGGTCACCATTTCA-3’ ,退火温度54 ℃,扩增产物长度1 759 bp;β-actin引物序列:上游5’-CCCATCTATGAGGGTTAC-3’,下游5’-GGAAGGTG GACAGTGAG-3’,退火温度58 ℃,扩增产物长度568 bp。产物经15 g/L琼脂糖凝胶电泳,用紫外线投射仪观察,用凝胶成像分析系统测定条带的吸光度,以目的基因与内参条带吸光度的比值表示目的基因mRNA的表达水平。
1.6肾组织BMP-7、TGF-β1蛋白的检测石蜡切片脱蜡水化后,用体积分数3% H2O2处理内源性过氧化氢酶,抗原热修复,山羊血清封闭后,分别滴加兔抗大鼠BMP-7多克隆抗体、兔抗大鼠TGF-β1多克隆抗体(均按100倍稀释)。37 ℃孵化30 min,4 ℃过夜。加入生物素二抗,室温孵育30 min,DAB显色,苏木素复染,常规脱水、透明、封片。以PBS代替一抗作阴性对照。阳性信号为棕黄色着色。应用病理图像分析系统(上海山富科学仪器有限公司)做半定量分析,每个切片测定20个含肾小球的视野(×200),测定阳性区积分光密度值,取均值作为最终结果。
1.7统计学处理采用SPSS 17.0进行统计分析,3组间肾脏肥大指数、生化指标、肾组织中TGF-β1和BMP-7 mRNA及蛋白表达水平的比较采用单因素方差分析,两两比较采用Bonferroni检验,检验水准α=0.05。
2 结果
2.1肾组织形态学表现见图1。NC组大鼠肾小球、肾小管结构清楚,基底膜厚度均一,毛细血管腔开放良好,间质未见炎性细胞浸润、纤维组织增生。DM组肾小球体积明显增大,基底膜增厚,系膜基质明显增多,部分毛细血管襻融合、扩张,部分肾小管上皮细胞肿胀,肾间质可见大量的淋巴细胞浸润,纤维成分明显增多。DC组系膜细胞及基质增生减轻,病变较DM组减轻。

图1 3组大鼠肾组织病理改变(×400)
2.2 3组大鼠肾脏肥大指数及生化指标的比较见表1。

表1 3组肾脏肥大指数、24 h尿蛋白定量、血Ca、血BUN、Cys-C及Scr的比较
*:与NC组比较,P<0.05;#:与DM组比较,P<0.01。
2.3 3组大鼠肾组织BMP-7、TGF-β1mRNA的表达见图2、表2。
2.4 3组大鼠肾组织BMP-7、TGF-β1蛋白的表达见图3、表3。
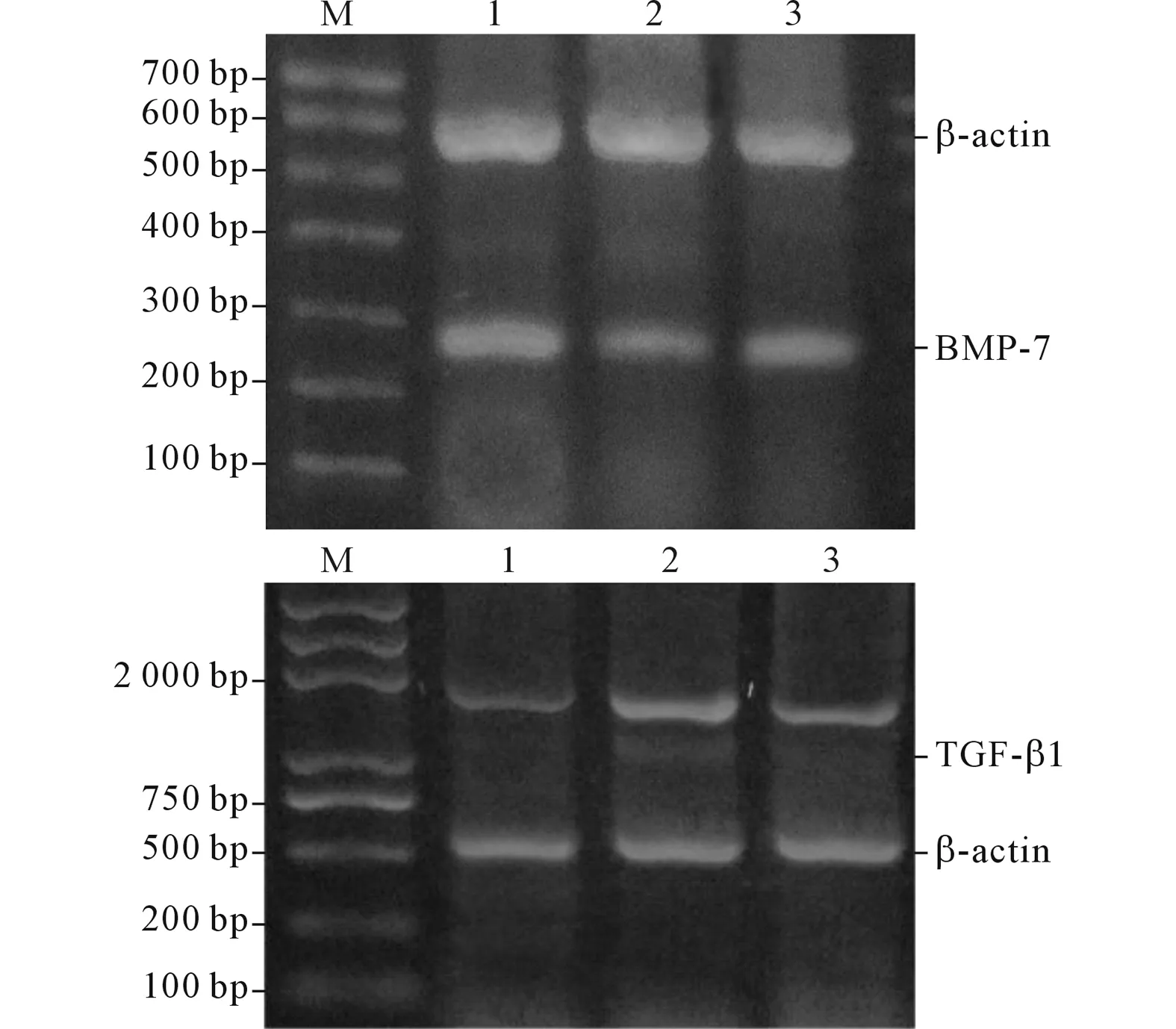
图2 3组大鼠肾组织BMP-7、TGF-β1 mRNA的表达
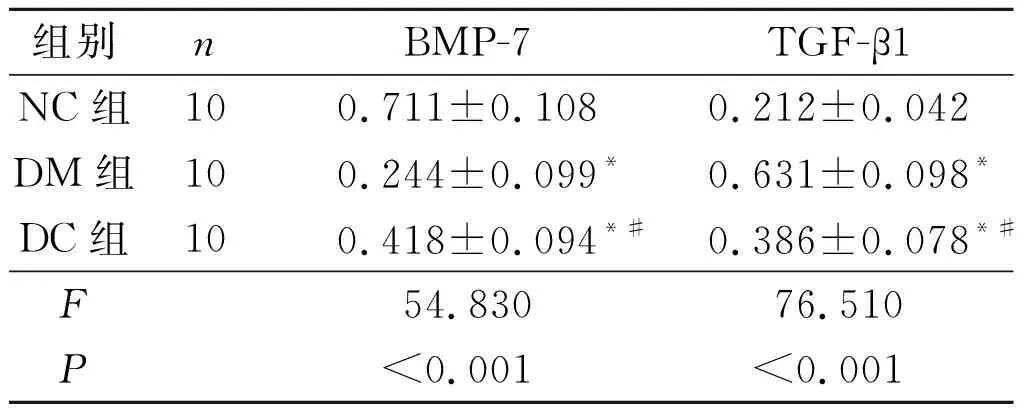
表2 3组肾组织中BMP-7、TGF-β1 mRNA的表达
*:与NC组比较,P<0.05;#:与DM组比较,P<0.05。

图3 3组大鼠肾组织BMP-7、TGF-β1蛋白的表达(×200)
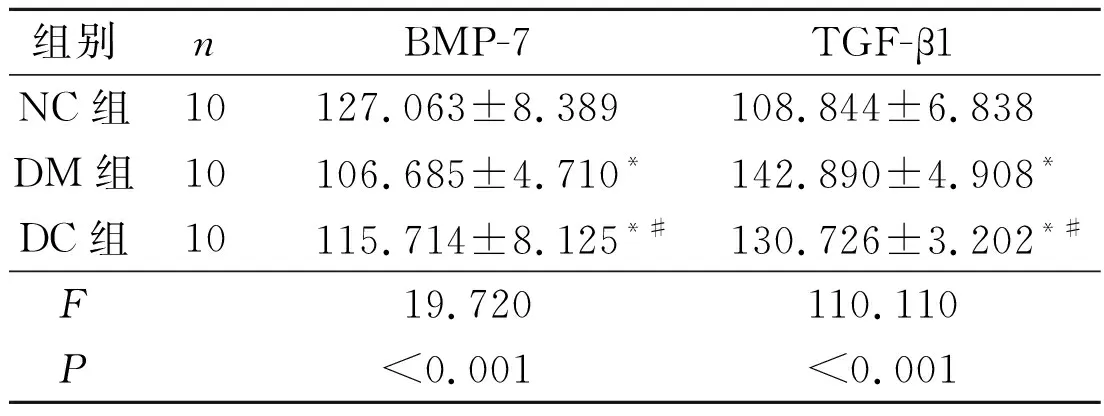
表3 3组肾组织BMP-7、TGF-β1蛋白表达
*:与NC组比较,P<0.05;#:与DM组比较,P<0.05。
3 讨论
中国糖尿病流行病学调查显示,我国已超过印度成为世界上糖尿病患者最多的国家[6],DN患病率也逐年增加,在我国已成为导致终末期肾功能衰竭的主要原因。目前DN的防治手段有限,主要为对症治疗,探索新的治疗方法日趋迫切。
越来越多的研究[7]表明活性维生素D3不仅具有调节钙磷代谢作用,而且还具有抗增殖、抗分化、调节细胞凋亡、介导免疫反应等肾脏保护作用,但其具体作用机制尚不完全清楚。已证实TGF-β1可通过抑制细胞增殖、促进肾组织肥大、诱导细胞外基质表达等多种途径导致糖尿病肾组织病理改变。Aschenbrenner等[8]研究证实,活性维生素D3可以通过抑制TGF-β1信号途径Smads通路,有效延迟Fisher-Lewis慢性同种异体移植模型大鼠慢性移植肾病的发生。维生素D3还可以显著抑制系膜增生性肾炎模型大鼠肾组织中TGF-β1的表达以及Ⅰ型、Ⅳ型胶原和α平滑肌肌动蛋白的表达,抑制系膜细胞的增殖和肾小球的硬化[9]。Zhang等[10]发现维生素D3可抑制维生素D受体敲除糖尿病模型大鼠RAS系统及系膜细胞、近球细胞中TGF-β1的表达,进而减少尿蛋白,抑制肾小球肥大及肾小球硬化。该研究结果显示,DM组大鼠肾组织TGF-β1 mRNA及蛋白的表达较NC组明显升高,DC组大鼠肾组织中TGF-β1 mRNA及蛋白的表达均较DM组明显下降,同时尿蛋白明显减少,病理改变减轻,表明活性维生素D3可通过下调TGF-β1表达在DN发生发展过程中发挥保护作用。
BMP-7与TGF-β1虽同属转化生长因子超家族的成员,但作用完全不同,BMP-7可拮抗TGF-β1引起的纤维化及上皮间质转化[11],是肾脏保护因子,在多个器官中均发挥着重要作用,若肾脏早期发育中缺乏BMP-7会导致肾单位发育停止。Wang等[12]发现,在转BMP-7基因的糖尿病大鼠中,BMP-7不仅可通过抑制足细胞的脱落而减少尿蛋白,而且可减少胶原蛋白Ⅰ及纤连蛋白的表达,从而延缓肾小球硬化及间质纤维化。该研究结果显示:无论是在RNA水平还是蛋白水平,DM组肾组织BMP-7的表达均较NC组明显减少,提示BMP-7对糖尿病肾组织具有重要作用,其减少可能加重糖尿病肾脏损害;与DM组相比,DC组大鼠肾脏肥大指数下降,肾脏病理改变明显减轻,24 h尿蛋白明显减少,血肌酐及尿素氮下降,提示活性维生素D3亦可通过上调肾组织中BMP-7的表达而发挥肾保护作用。
维生素D缺乏在DN患者中普遍存在,1,25(OH)2D3较25(OH)D3缺乏更明显[13]。该研究结果显示,在STZ诱导的糖尿病大鼠肾组织中BMP-7表达减少,TGF-β1表达增加,而活性维生素D3在糖尿病肾病中发挥肾脏保护作用,其作用机制可能与上调BMP-7、下调TGF-β1的表达密切相关,但对于活性维生素D3通过何种途径发挥上述作用,还有待进一步研究。
[1]黎磊石, 刘志红. 中国肾脏病学[M]. 北京: 人民军医出版社, 2008:626
[2]Holick MF. Vitamin D: a millenium perspective[J]. J Cell Biochem, 2003, 88(2):296
[3]Phillips AO,Fraser DJ. BMP-7 stops TGF-β in peritoneal fibrosis[J]. Nephrol Dial Transplant, 2010, 25(4):1036
[4]李青菊, 姚蔚, 李凤良,等. 褪黑素对早期糖尿病大鼠心肌非酶糖基化及氧化应激反应的影响[J].郑州大学学报:医学版, 2005, 40(3):488
[5]刘雷, 甘华, 王辉,等. 活性维生素D3对糖尿病大鼠肾脏TGF-β1及HGF表达的影响[J]. 重庆医科大学学报, 2008, 33(9):1058
[6]Yang SH, Dou KF, Song WJ.Prevalence of diabetes among men and women in china[J]. N Engl J Med, 2010, 362(25):2425
[7]陈兆聪. 维生素D再认识[J]. 医药导报, 2011, 30(5):555
[8]Aschenbrenner JK, Sollinger HW, Becker BN, et al. 1,25-(OH(2))D(3) alters the transforming growth factor beta signaling pathway in renal tissue[J]. J Surg Res, 2001, 100 (2):171
[9]Panichi V,Migliori M,Taccola D, et al. Effects of 1,25-(OH)2D3 in experiment mesangial proliferative nephritis in rats[J]. Kidney Int, 2001, 60 (1):87
[10]Zhang Z,Sun L,Wang Y,et al.Renoprotective role of the vitamin D receptor in diabetic nephropathy[J].Kidney Int,2008,73(2):163
[11]Veerasamy M, Nguyen TQ, Motazed R, et al.Differential regulation of E-cadherin and alpha -smooth muscle actin by BMP-7 in human renal proximal tubule epithelial cells and its implication in renal fibrosis[J].Am J Physiol Renal Physiol,2009,297(5):F1238
[12]Wang SN,de Caestecker M,Kopp J,et al. Renal bone morphogenetic protein-7 protects against diabetic nephropathy[J]. J Am Soc Nephrol, 2006, 17(9):2504
[13]Levin A,Le Barbier M,Er L, et al. Incident isolated 1,25-(OH)2D3 deficiency is more common than 25(OH)D deficiency in CKD[J]. J Nephrol, 2012, 2(25):204
