紫杉醇肿瘤靶向给药系统对MCF-7细胞的抑制作用观察*
2013-11-20张艳艳张晓艳付旭东刘康栋赵继敏董子明张振中
张艳艳,张晓艳,付旭东,刘康栋,赵继敏,董子明#,张振中
1)郑州大学基础医学院病理生理学教研室 郑州 450001 2)郑州大学第五附属医院神经外科 郑州 450052 3)郑州大学药学院 郑州 450001
紫杉醇(paclitaxel)可促进微管蛋白聚合及抑制微管解聚,阻碍细胞内骨架的合成,从而干扰有丝分裂,主要用于治疗乳癌、卵巢癌及非小细胞肺癌、食管癌、膀胱癌等恶性肿瘤[1]。紫杉醇不溶于水,溶解性问题是紫杉醇制剂的首要问题;且因为缺乏肿瘤靶向性,易导致全身毒性。提高紫杉醇的水溶性及增加其治疗的靶向性已成为药理学家研究的重点。单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)是一种新型的非病毒基因药物载体,具有独特的跨膜能力,能够被动穿过多种细胞膜,在药物、核酸转运方面具有很大的应用价值[2-3],但是其表面高度疏水,不溶于水和有机溶剂,生物相容性差,故其在生物医学领域的应用受到限制。适当功能化的SWCNTs能够承载多种生物分子和药物进入细胞,且不表现明显毒性[4-5]。已证实NGR(N:天冬酰氨酸,G:氨基乙酸,R:精氨酸)是具有肿瘤靶向性的多肽分子,能够与肿瘤细胞及新生血管特异性结合[6]。该研究使用苯丙氨酸等氨基酸对SWCNTs进行表面修饰,将紫杉醇分散吸附到其表面,再与靶向基团NGR连接,构建了抗肿瘤药物靶向给药系统NGR-SWCNTs-Paclitaxel,观察了该给药系统对乳癌细胞MCF-7的抑制作用。
1 材料与方法
1.1试剂及细胞紫杉醇(北京怡禾生物工程有限公司),SWCNTs(中国科学院成都有机化学研究所),NGR(上海吉尔生化有限公司),泊洛沙姆188(德国BASF公司),苯丙氨酸(湖北远成股份有限公司),DSPE-PEG2000-maleimide(DPM)和FITC(美国Sigma公司)。MCF-7由河南省医药科学研究院惠赠,于37 ℃、体积分数5% CO2条件下培养,培养基为含有体积分数10%胎牛血清(FBS)和青霉素100 U/mL、链霉素100 mg/L的RPMI 1640,每2~3 d消化、传代一次。
1.2NGR-SWCNTs-Paclitaxel复合物的构建称取处方量的Paclitaxel,加入适量无水乙醇溶解后,再加入处方量的SWCNTs,在超声环境下逐滴加入超纯水,离心得到SWCNTs-Paclitaxel复合物。取SWCNTs-Paclitaxel复合物2 mL,加入0.2 mg DPM,超声处理20 min,加入苯丙氨酸和泊洛沙姆188(终质量浓度为2.0 g/L),探头超声处理得分散体,100 μm滤膜过滤,再用超纯水重新分散,得到DPM修饰的SWCNTs-Paclitaxel。将NGR加入DPM修饰的SWCNTs-Paclitaxel中,使NGR与DPM的物质的量比为151,避光振荡过夜,得到NGR-SWCNTs-Paclitaxel,用滤膜过滤,除去未反应完全的NGR。
1.3MCF-7细胞吞噬实验准确量取NGR-SWCNTs-Paclitaxel或SWCNTs-Paclitaxel分散体溶液5 mL,加入含质量浓度为1 kg/L FITC的DMSO溶液1 mL,探头超声处理后,静置24 h,葡聚糖凝胶柱纯化,除去未吸附的FITC,得到FITC标记的制剂。取对数生长期细胞,按每孔1.0×106个细胞种植于6孔细胞培养板中培养24 h后,分别用含FITC标记的NGR-SWCNTs-Paclitaxel、SWCNTs-Paclitaxel、Paclitaxel的培养基培养,每组FITC浓度相同,每组设置3个复孔。培养1、2、4 h后吸去含药培养基,PBS冲洗细胞3次,用体积分数75%冰乙醇固定30 min,荧光显微镜下观察、记录细胞摄取情况。
1.4NGR-SWCNTs-Paclitaxel对MCF-7细胞增殖的影响收集对数生长期细胞,用RPMI 1640培养液调整细胞浓度,96孔板铺板,使细胞密度为6×103个/孔,于37 ℃、体积分数5% CO2培养箱中继续培养24 h。实验分4组:NGR-SWCNTs-Paclitaxel组、SWCNTs-Paclitaxel组、Paclitaxel组和对照组,前3组加入相应药物,使Paclitaxel终质量浓度为8.0 g/L,对照组不加药物。每组设置6个复孔。分别于作用24、48和72 h后,采用MTT法测定细胞增殖抑制率。用酶标仪于570 nm波长处检测光密度(D)。抑制率=(1-实验组D值/对照组D值)×100%,其中实验组和对照组值均为扣除空白对照后的值。
1.5NGR-SWCNTs-Paclitaxel对MCF-7细胞周期的影响取对数生长期细胞,用胰酶消化后制备混悬液,实验分组处理方法同1.4,每组复孔3个,采用流式细胞术PI单染色法分析细胞周期。
1.6细胞凋亡检测按照1.4项分组处理细胞48 h后,采用流式细胞术Annexin V-FITC法测定细胞凋亡率。
1.7统计学处理采用SPSS 17.0进行数据处理。组间细胞增殖抑制率、细胞周期及凋亡率的比较采用单因素方差分析及LSD-t检验,检验水准α=0.05。
2 结果
2.1MCF-7细胞吞噬实验结果荧光显微镜下可见,与对照组比较,NGR-SWCNTs-Paclitaxe组细胞在视野范围内均呈现强烈的荧光,并且随着时间的延长,荧光增强。SWCNTs-Paclitaxel也能被细胞摄取,但荧光强度较弱,用时较长。Paclitaxel组细胞基本无荧光点。见图1。
2.2细胞增殖抑制率测定结果见表1。NGR-SWCNTs-Paclitaxel组抑制效果最强。
2.3细胞周期检测结果见表2。可以看出Paclitaxel可阻止MCF-7细胞于G2/M期。SWCNTs-Paclitaxel和NGR-SWCNTs-Paclitaxel阻止MCF-7细胞于G2/M期的作用更强,尤其NGR-SWCNTs-Paclitaxel对MCF-7细胞周期的影响最明显。
2.4细胞凋亡检测结果见表3。各组制剂作用MCF-7细胞48 h后均可诱导细胞凋亡,但细胞凋亡率有所不同,其中NGR-SWCNTs-Paclitaxel诱导的MCF-7细胞凋亡效果最显著。
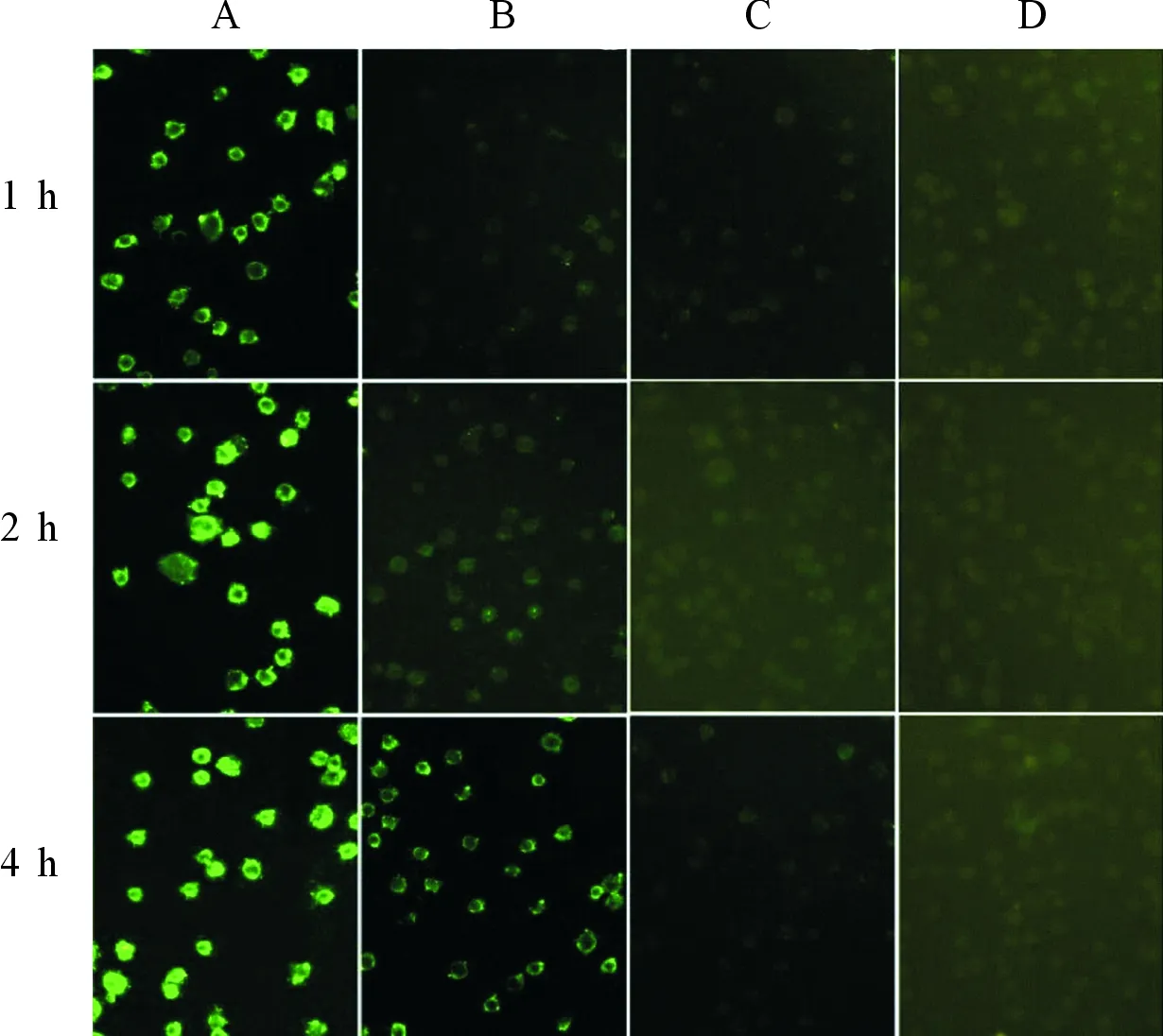
图1 MCF-7细胞吞噬实验的荧光显微镜图
A:NGR-SWCNTs-Paclitaxel组; B:SWCNTs-Paclitaxel组; C:Paclitaxel组; D:对照组。

表1 3组细胞增殖抑制率的比较 %
*:与Paclitaxel组比较,P<0.05;#:与SWCNTs-Paclitaxel组比较,P<0.05。

表2 4组MCF-7细胞周期测定结果 %
*:与对照组比较,P<0.05;△:与Paclitaxel组比较,P<0.05; #:与SWCNTs-Paclitaxel组比较,P<0.05。

表3 4组细胞凋亡率的比较 %
*:与对照组比较,P<0.05;△:与Paclitaxel组比较,P<0.05; #:与SWCNTs-Paclitaxel组比较,P<0.05。
3 讨论
紫杉醇是一种传统的广谱抗肿瘤药物,但其溶解度只有0.25 mg/L,这就制约了其在注射给药方面的应用。目前,国内外市售紫杉醇制剂中除力朴素为脂质体外,余均以聚氧乙烯蓖麻油与乙醇作为溶媒,而聚氧乙烯蓖麻油虽能增加紫杉醇的水溶性,但会引起许多不良反应,如过敏反应、肾毒性、心血管毒性和神经毒性等[7]。目前,国内外对于紫杉醇的研究较集中于开发新型制剂,寻找新的增溶系统和方法,以及提高紫杉醇安全性和肿瘤靶向性。微乳、prodrug、脂质体、碳纳米管、大分子聚合物、凝胶剂、植入剂、环糊精包合物等是目前研究较集中的制剂。其中碳纳米管以其独特的光学特性、功能化后良好的生物相容性、优越的细胞穿透能力以及能够改变药物体内分布的特性等特点越来越受到研究者的关注。
Abraxane是一种注射用紫杉醇白蛋白纳米悬乳剂[8],是紫杉醇新型制剂中较为成功的一例。该蛋白化纳米粒不仅能减低溶媒的毒副作用,还可以在快速生长的肿瘤中蓄积,提高靶向部位浓度,定向释放给肿瘤细胞,从而提高药物疗效,是紫杉醇的首个主动靶向制剂,该制剂疗效基本是常见的以聚氧乙烯蓖麻油为溶媒制剂的2倍。Potineni 等[9]制备了紫杉醇pH敏感聚氨酯纳米粒,该制剂具有较高的载药量和包封率,能被BT-20细胞非特异性内吞。Yang等[10]在普通紫杉醇脂质体表面偶联单克隆抗体,脂质体能够与肿瘤细胞表面的表皮生长因子受体HER-2特异性结合,从而提高了紫杉醇在肿瘤组织和细胞中的分布。Kam等[11]通过荧光标记观察到碳纳米管可将蛋白质携带入不同细胞(悬浮和贴壁细胞)内部。Kam等[12]通过叶酸化得到磷脂修饰的SWCNTs,并将DNA与SWCNTs结合,将单义寡核苷酸转运到活细胞内,通过脉冲的激光照射,观察到核苷酸可以进入细胞内部。Ladeira等[13]设计出一种siRNA细胞内转运的方法,使siRNA盘旋于羧基修饰的SWCNTs,该转运系统被证明没有明显毒性且转染效率大于95%。
作者以DPM 修饰SWCNTs,再与靶向基团NGR连接,制备了NGR-SWCNTs-Paclitaxel复合物。细胞吞噬实验结果显示,Paclitaxel不能进入MCF-7细胞内,而NGR-SWCNTs-Paclitaxel复合物可被MCF-7细胞大量快速的摄取。这与Wang等[4]的研究一致。
有文献[14-15]报道紫杉醇能够抑制肿瘤细胞的增殖,诱导其凋亡。该研究结果表明NGR-SWCNTs-Paclitaxel对MCF-7细胞的增殖抑制作用、G2/M期阻滞效果及其诱导的早期和晚期细胞凋亡率均明显高于紫杉醇和SWCNTs-Paclitaxel,这与Frank等[16]的研究结果一致。
综上所述,作者成功构建了NGR-SWCNTs-Paclitaxel复合物,该复合物具有良好的肿瘤靶向性和优于紫杉醇的抗肿瘤效果。今后作者将从分子水平上进一步探讨紫杉醇诱导肿瘤细胞凋亡的机制,为新制剂的研发提供理论依据。
[1]Singla AK, Garg A, Aggarwal D. Paclitaxel and its formulation[J]. Int J Pharm, 2002, 235(1/2):179
[2]Zhou WW, Rutherglen C, Burke PJ. Wafer scale synthesis of dense aligned arrays of single-walled carbon nanotubes[J]. Nano Res, 2008,1(2): 158
[3]Prato M,Kostarelos K,Bianco A.Functionalized carbon nanotubes in drug design and discovery[J].Acc Chem Res 2008,41(1):60
[4]Wang L, Shi J, Zhang H,et al. Synergistic anticancer effect of RNAi and photothermal therapy mediated by functionalized single-walled carbon nanotubes[J]. Biomaterials, 2013,34(1):262
[5]Delogu LG, Vidili G, Venturelli E,et al.Functionalized multiwalled carbon nanotubes as ultrasound contrast agents[J]. Proc Natl Acad Sci USA, 2012,109(41):16612
[6]Kondo N, Tsukuda M, Ishiguro Y,et al. Antitumor effects of lapatinib (GW572016), a dual inhibitor of EGFR and HER-2, in combination with cisplatin or paclitaxel on head and neck squamous cell carcinoma[J]. Oncol Rep, 2010,23(4):957
[7]Chervinsky DS, Brecher ML, Hoelcle MJ. Cremophor-EL enhances taxol efficacy in a multi-drug resistant C1300 neuroblastoma cell line[J]. Anticancer Res, 1993,13(1): 93
[8]Moreno-Aspitia A, Perez EA.Nanoparticle albumin-bound paclitaxel (ABI-007): a newer taxane alternative in breast cancer[J]. Future Oncol, 2005,1(6):755
[9]Potineni A, Lynn DM, Langer R, et al. Poly(ethylene oxide)-modified poly(beta-amino ester) nanoparticles as a pH-sensitive bio-degradable system for paclitaxel delivery[J]. J Control Release, 2003, 86(2/3):223
[10]Yang T, Choi MK, Cui FD,et al. Preparation and evaluation of paclitaxel-loaded PEGylated immunoliposome[J]. J Control Release, 2007, 120(3): 169
[11]Kam NW, Liu Z, Dai H.Carbon nanotubes as intracellular transporters for proteins and DNA:an investigation of the uptake mechanism and pathway[J].Angew Chem Int Ed Engl,2006,45(4):577
[12]Kam NW, O'Connell M, Wisdom JA, et al. Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction[J]. Proc Natl Acad Sci USA, 2005, 102(33): 11600
[13]Ladeira MS, Andrade VA, Gomes ER, et al. Highly efficient siRNA delivery system into human and murine cells using single-wall carbon nanotubes[J]. Nanotechnology, 2010, 21(38): 385101
[14]Roy Choudhury S, Karmakar S, Banik NL, et al. Valproic acid induced differentiation and potentiated efficacy of taxol and nanotaxol for controlling growth of human glioblastoma LN18 and T98G cells[J]. Neurochem Res, 2011, 36(12): 2292
[15]Dubey N, Shukla J, Hazari PP, et al. Preparation and biological evaluation of paclitaxel loaded biodegradable PCL/PEG nanoparticles for the treatment of human neuroendocrine pancreatic tumor in mice[J]. Hell J Nucl Med, 2012, 15(1): 9
[16]Frank GP, Heike L,Doris S,et al. Preclinical evaluation of gemcitabine/paclitaxel-interactions in human bladder cancer lines[J]. Anticancer Res, 2003, 23(6C): 4805
