胶质瘤组织中CPEB4和Bcl-xL的表达及预后影响因素分析*
2013-11-20王新军周少龙
梁 博,王新军,周少龙
郑州大学第五附属医院神经外科 郑州 450052
研究[1]表明胞质多聚腺苷酸化成分结合蛋白4(cytoplasmic polyadenylation element-binding protein 4, CPEB4)对于基因转录后调节起关键作用,CPEB4的过表达存在于多种肿瘤中。Bcl-xL蛋白在细胞的凋亡过程中发挥重要作用,在多种肿瘤组织中有过表达现象,它的过表达可使肿瘤细胞逃避凋亡, 与肿瘤的发生、发展、侵袭、转移甚至耐药性有关[2]。作者应用免疫组化技术检测了不同级别胶质瘤组织中CPEB4和Bcl-xL的表达,并探讨二者及多种临床因素与胶质瘤患者预后的关系。
1 材料与方法
1.1材料2008至2009年在郑州大学第五附属医院神经外科接受手术、资料完整的胶质瘤患者165例,其中男89例,女76例,年龄3~82(47.2±3.1)岁。按WHO中枢神经系统肿瘤分类,其中低级别胶质瘤69例,包括毛细胞型星形细胞瘤(Ⅰ级)27例和弥漫型星形细胞瘤(Ⅱ级)42例;高级别胶质瘤96例,包括间变性星型细胞瘤(Ⅲ级)61例和胶质母细胞瘤(Ⅳ级)35例。其他评估因素包括患者年龄、性别、术前KPS评分、肿瘤直径、肿瘤切除范围、术后是否放疗或化疗、肿瘤位置、病理级别、是否复发及术后3 a生存率等。术后随访情况包括是否死亡及死亡时间、症状是否有进展及进展发生的时间。随访资料的取得来源于患者本人或家属的门诊或电话随访,随访期2010至2012年。
1.2胶质瘤组织中CPEB4和Bcl-xL的免疫组化染色检测CPEB4、Bcl-xL兔抗人多克隆抗体分别购自美国Sigma公司和武汉博士德生物工程有限公司,即用型SP超敏免疫组化试剂盒、DAB显色试剂盒购自福州迈新生物技术有限公司。CPEB4和Bcl-xL一抗均按1200稀释,标本经脱蜡、抗原修复后进行免疫组化染色,苏木素复染,脱水、封片后显微镜下观察。以PBS液代替一抗作阴性对照,已知阳性的胰腺癌组织切片作阳性对照。
1.3结果判定由两位病理科医师采用双盲法观察切片。CPEB4、Bcl-xL蛋白表达均以肿瘤细胞胞质棕黄色着色为染色阳性。每个切片选取5个高倍视野,每个视野计数100个细胞,计算阳性细胞百分比。采用Ortiz-Zapater等[1]提出的染色标准评定CPEB4的检测结果:阳性细胞百分比≤10%为 1分,~50%为2分,>50%为3分;无着色为0分,淡黄色为1分,棕黄色为2分。两项得分相加为最后得分,0分为阴性,≥1分为阳性。采用Karczmarek-Borowska等[2]提出的标准评定Bcl-xL蛋白检测结果:阳性细胞百分比≤10%为阴性,>10%为阳性。
1.4统计学处理应用SPSS 17.0处理数据。不同级别胶质瘤组织中CPEB4和Bcl-xL蛋白阳性表达率的比较采用χ2检验,多种因素与胶质瘤患者3 a生存率的关系采用logistic回归模型进行分析,选择其中有意义的变量进行多因素分析,检验水准α=0.05。
2 结果
2.1胶质瘤组织中CPEB4和Bcl-xL蛋白的表达
见图1、表1。
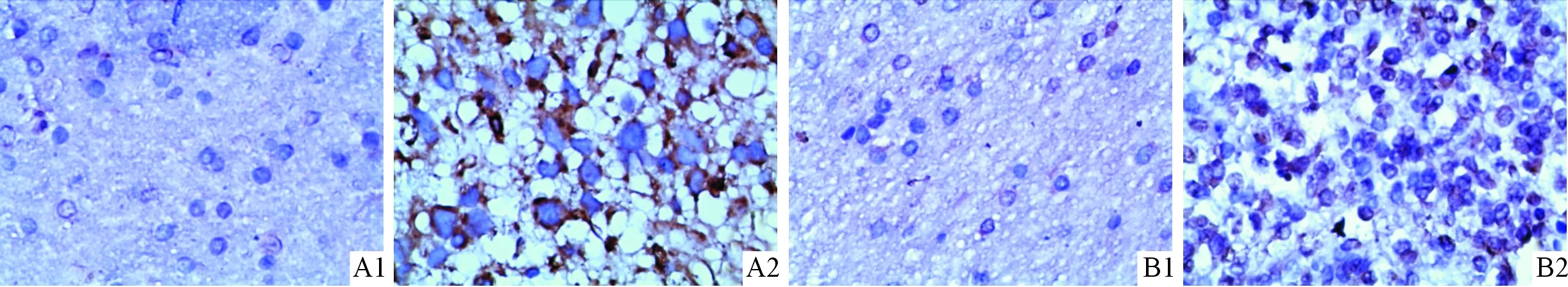
图1 胶质瘤组织中CPEB4(A)和Bcl-xL(B)蛋白的表达(SP,×400)
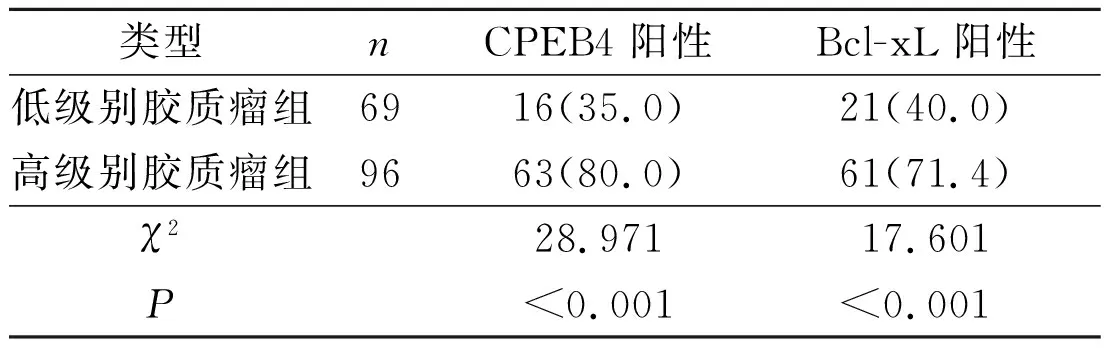
表1 不同级别的胶质瘤组织中CPEB4和Bcl-xL蛋白的表达 例(%)
2.2影响胶质瘤患者预后指标的单因素和多因素分析主要变量赋值见表2。
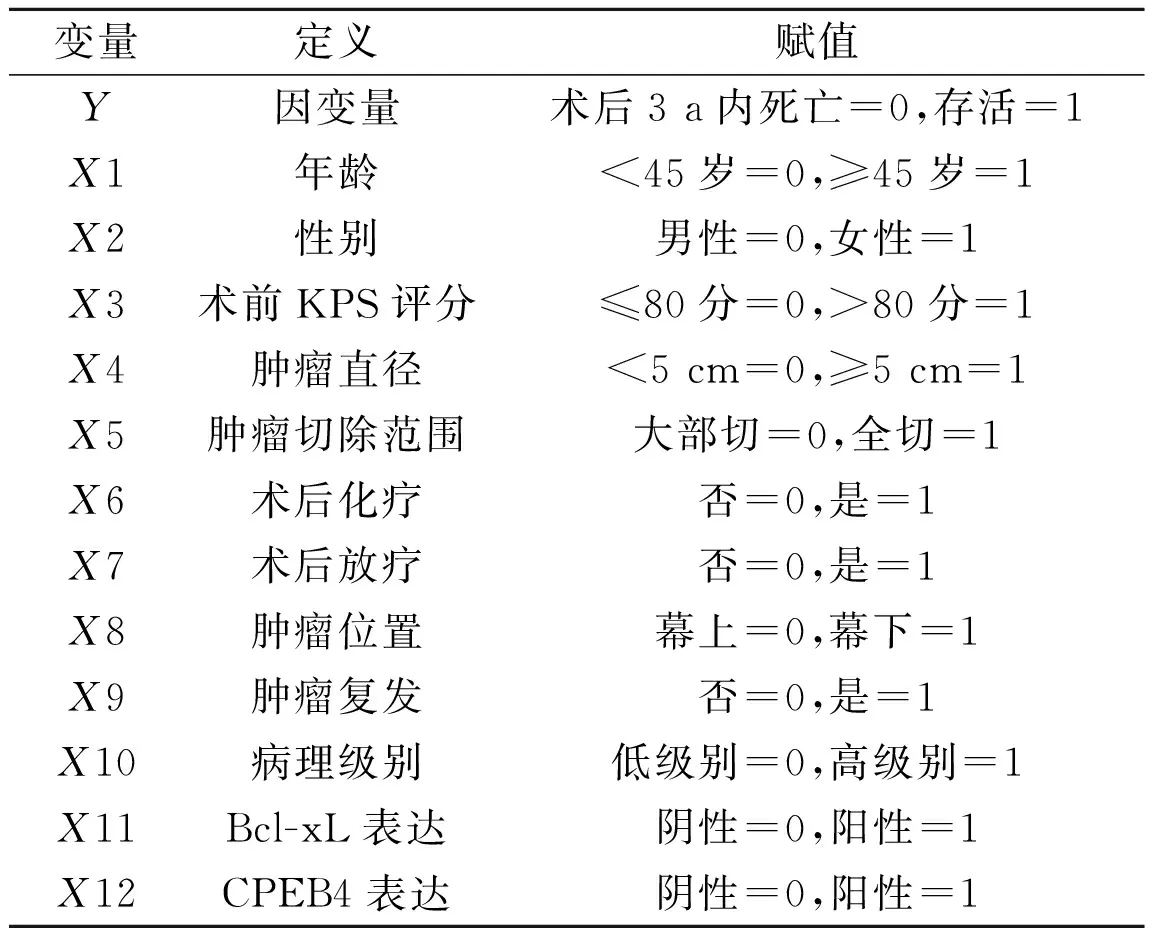
表2 主要变量赋值表
利用logistic回归分析筛选出术前KPS评分、肿瘤直径、肿瘤切除范围、术后放疗、术后化疗、病理级别、CPEB4和Bcl-xL表达8个有意义的变量。对单因素分析有意义的因素进行logistic回归分析,最终能进入回归模型的变量有6个,病理级别、CPEB4和Bcl-xL的表达是胶质瘤预后的危险因素,而术前KPS评分>80分、肿瘤全切、术后化疗则为保护因素,见表3。影响胶质瘤预后的全部指标同时进入判别方程进行分析,将判别分类与原分类对照,判别符合率90.9%;用前进法筛选出6个影响胶质瘤预后的指标,判别函数Y=-0.644+1.386X3+1.052X5+1.248X6-2.679X10-1.042X11-2.659X12。将判别分类与原分类对照,判别符合率为88.3%,与全部指标进入判别方程得到的判别符合率接近。

表3 胶质瘤预后危险因素的多因素分析
3 讨论
肿瘤的发生发展是一个多基因参与的复杂过程,其中包括原癌基因的激活、抑癌基因的失活[3]以及凋亡基因的异常表达等。CPEB4是CPEBs家族中的一员,这个家族的成员主要通过控制靶基因的多聚腺苷酸化来调节其翻译过程[4]。已有报道[5-6]认为CPEB4是神经细胞中的一种存活蛋白,可以调控减数分裂的细胞。Ortiz-Zapater等[1]研究发现CPEB4在胰腺癌及胶质母细胞瘤组织中呈过表达,并认为过表达的CPEB4与肿瘤的生长和血管生成相关;通过对小鼠肿瘤模型的研究发现敲除CPEB4基因的肿瘤细胞其侵袭性和恶性转移能力明显减弱,且肿瘤的生长和增殖能力也显著减弱,肿瘤血管生成减少,小鼠存活率升高。CPEB4的过表达还存在于许多其他种类的肿瘤中,如皮肤癌、结直肠癌、肾癌及子宫内膜癌等[7]。然而Tian等[8]在最近的研究中发现,在肝癌组织中,CPEB4的蛋白及mRNA表达水平下调,CPEB4的高表达预示着肝癌患者有一个较好的预后。这种矛盾的现象可能与肿瘤组织的特异性有关,不同的细胞中,CPEB4通过结合不同基因3’-UTR区的CPE序列来调节靶基因的下游目标,以完成对基因翻译过程的控制。Bcl-xL蛋白是Bcl-2蛋白家族中的重要成员,是一种抑制凋亡的蛋白,在多种恶性肿瘤中表达上调[9],与肿瘤的生长分化关系密切。该研究结果提示,CPEB4和Bcl-xL的阳性表达率与胶质瘤的恶性程度密切相关,CPEB4和Bcl-xL表达水平的不同可能是胶质瘤分化程度存在差异的原因之一。
影响胶质瘤患者预后的因素较多。多因素分析筛选出影响预后的因素有6个:术前KPS评分、肿瘤切除范围、病理级别、术后化疗、CPEB4和Bcl-xL表达。判别分析显示影响胶质瘤预后各项因素对预后的判别符合率(90.9%)与以上6因素对预后的判别符合率(88.3%)非常接近,提示这6个因素是预测胶质瘤预后比较敏感的指标,有一定的临床应用价值。
该研究结果表明术前KPS评分是影响患者生存率的主要因素,与Valduvieco等[10]的研究结果一致。术前KPS评分高说明肿瘤发展处于初级阶段且患者身体条件较好,对手术的耐受能力较强,因此术后具有较高的生存率。
目前胶质瘤的治疗多采用手术、放疗或化疗联合的综合治疗,但手术仍是最主要的治疗方法且仍是影响存活率的最主要因素。美国儿童肿瘤联合调查组大宗病例分析[11]证实,在胶质母细胞瘤患者中,根治性切除和部分切除的5 a无瘤生存率分别为(29±6)%和(4±3)%;在间变性星形细胞瘤患者中,5 a无瘤生存率分别为(44±11)%和(22±6)%。Allahdini等[12]研究发现最大程度地切除肿瘤对延长患者生存期有重要意义,不仅如此,Bloch等[13]还发现对于首次手术行次全切的胶质瘤复发患者,二次手术行肿瘤全切仍能最大程度延长患者生存期。该研究结果显示肿瘤全切对患者预后有重要意义,与上述研究结论一致,因此对胶质瘤患者,手术应当争取全切,这是提高手术效果、减少复发的根本措施。
研究[14]显示胶质瘤的病理级别与患者预后有关,病理级别越高,患者预后越差。该研究结果亦表明胶质瘤病理级别与患者3 a生存率有关,与上述研究结论一致,这也符合胶质瘤本身所固有的生物学特性。
放、化疗是胶质瘤治疗的辅助手段,但是目前针对放疗和化疗对预后的影响仍有争议。对于毛细胞型星形细胞瘤,有文献[11]认为,未能全切者可给予一定剂量的放疗,不主张化疗。良性星形细胞瘤术后实性残余肿瘤行放射治疗对延长生存期有肯定效果。但欧洲癌症治疗研究组织和英国医学研究理事会[15]的研究结果认为低级别胶质瘤患者术后放疗可以提高无进展生存期,但对生存率无影响。针对放疗不敏感的胶质瘤患者,化疗是一种必要的治疗方式,但目前化疗方案较多,不同化疗方案的预后也不尽相同。一项由欧洲癌症研究治疗组织和加拿大国立癌症研究院[16]联合进行的Ⅲ期临床试验认为在放疗基础上联合应用替莫唑胺化疗后再给予6个周期的替莫唑胺辅助化疗可明显延长患者生存期。该组数据分析结果表明术后化疗对预后影响较大,是一项独立影响因素。
综上所述,CPEB4和Bcl-xL阳性表达与胶质瘤恶性程度有关;术前KPS评分、肿瘤切除范围、术后化疗、病理级别、CPEB4和Bcl-xL的表达可作为考察胶质瘤患者预后情况的重要指标。
[1]Ortiz-Zapater E, Pineda D, Martínez-Bosch N, et al. Key contribution of CPEB4-mediated translational control to cancer progression[J]. Nat Med,2011,18(1):83
[2]Karczmarek-Borowska B, Filip A, Wojcierowski J, et al. Estimation of prognostic value of Bcl-xL gene expression in non-small cell lung cancer[J]. Lung Cancer, 2006,51(1):61
[3]马林,徐国本,宋来君,等. 人脑星形细胞瘤组织中Survivin与 P53的表达[J]. 郑州大学学报:医学版,2006, 41(1):142
[4]梁博,王新军.胞质多聚腺苷酸化成分结合蛋白与肿瘤相关研究进展[J]. 肿瘤防治研究, 2013, 40(4):33
[5]Kan MC, Oruganty-Das A, Cooper-Morgan A, et al. CPEB4 is a cell survival protein retained in the nucleus upon ischemia or endoplasmic reticulum calcium depletion[J]. Mol Cell Biol, 2010, 30(24): 5658
[6]Igea A, Mendez R. Meiosis requires a translational positive loop where CPEB1 ensues its replacement by CPEB4[J]. EMBO J,2010, 29(13): 2182
[7]Fernández-Miranda G, Méndez R. The CPEB-family of proteins, translational control in senescence and cancer[J]. Ageing Res Rev,2012,11(4):460
[8]Tian Q, Liang L, Ding J, et al. MicroRNA-550a acts as a pro-metastatic gene and directly targets cytoplasmic polyadenylation element-binding protein 4 in hepatocellular carcinoma[J]. PLoS One, 2012, 7(11):e48958
[9]王新军, 赵忠伟, 寿纪新, 等. 髓母细胞瘤组织Bcl-xL mRNA和蛋白表达及临床意义[J]. 实用儿科临床杂志, 2006, 21(23):1615
[10]Valduvieco I, Verger E, Bruna J,et al. Impact of radiotherapy delay on survival in glioblastoma[J]. Clin Transl Oncol,2013,15(4):278
[11]王忠诚.王忠诚神经外科学[M].武汉: 湖北科学技术出版社,2005.
[12]Allahdini F, Amirjamshidi A, Reza-Zarei M,et al. Evaluating the prognostic factors effective on the outcome of patients with glioblastoma multiformis: does maximal resection of the tumor lengthen the median survival?[J]. World Neurosurg,2010,73(2):128
[13]Bloch O, Han SJ, Cha S, et al. Impact of extent of resection for recurrent glioblastoma on overall survival[J]. J Neurosurg,2012,117(6):1032
[14]Combs SE, Steck I, Schulz-Ertner D,et al. Long-term outcome of high-precision radiotherapy in patients with brain stem gliomas: results from a difficult-to-treat patient population using fractionated stereotactic radiotherapy[J]. Radiother Oncol,2009,91(1):60
[15]van den Bent MJ, Afra D, de Witte O,et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults:the EORTC 22845 randomised trial[J]. Lancet,2005,366(9490):985
[16]Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol,2009,10(5):459
