新型杯[4]冠醚衍生物聚合单体的合成*
2013-11-19蒋忠良常维夫
蒋忠良, 常维夫, 段 辉
(同济大学 化学系,上海 200092)
杯芳烃是继环糊精和冠醚之后出现的第三代主体分子.它具有空腔可调节,构象可变化,并易于化学改性和修饰等特点,既可络合离子又可包结中性分子[1~3]。杯芳烃冠醚是由杯芳烃与多甘醇二对甲苯磺酸酯缩合而成。将冠醚亚单元引入杯芳烃结构,得到的杯芳烃冠醚不仅仅是冠醚和杯芳烃的简单结合,两类亚单元之间还存在相互协同作用,其对客体的识别能力与冠醚和杯芳烃有很大的不同,往往表现为更加优越的客体识别能力[4]。将含可聚合基团(双键、炔键)杯芳烃冠醚单体通过均聚或与其它单体共聚可获得新型功能高分子材料[5~9]。
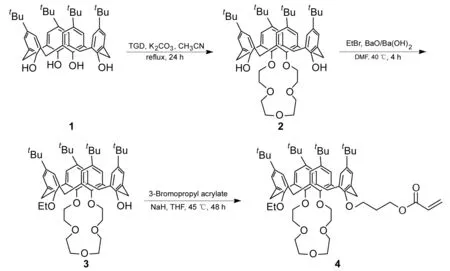
本文从对叔丁基杯[4]芳烃(1)出发,对其下沿的酚羟基进行修饰,先后在1,3-和2-酚羟基位点引入冠醚环和乙基;最后在NaH/THF中与3-溴丙烯酸丙酯反应制得聚合单体——新型杯[4]冠醚衍生物(4, Scheme 1),其结构经1H NMR和MS表征。
1 实验部分
1.1 仪器与试剂
XT-4型熔点仪(温度未校正);Bruker DMX-400型核磁共振仪(CDCl3为溶剂,TMS为内标);Finnigan LCQ型质谱仪。
THF经金属钠干燥;四甘醇二对甲苯磺酸酯(TGD)[10]和3-溴丙烯酸丙酯[11]参照文献方法制备;其余所用试剂均为分析纯。
1.2 合成
(1) 对叔丁基杯[4]-1,3-冠-5(2)的合成
Scheme 1
氮气保护,在三口烧瓶中依次加入乙腈300 mL,14.38 g(6.75 mmol), TGD 3.84 g(7.64 mmol)和无水K2CO31.06 g(7.64 mmol),搅拌下回流(80 ℃)反应24 h。过滤,滤液减压蒸除溶剂,残余物用CH2Cl2溶解、稀盐酸酸化后分液,有机层依次用饱和NaHCO3溶液和蒸馏水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂: A=V(乙酸乙酯) ∶V(石油醚)=1 ∶4]分离得白色固体2 4.03 g,收率74%, m.p.246 ℃~251 ℃;1H NMRδ: 7.19(s, 2H, OH), 7.07(s, 4H, ArH), 6.75(s, 4H, ArH), 4.37(d,J=13.1 Hz, 4H, ArCH2), 4.07(s, 8H, OCH2), 3.97(t,J=5.5 Hz, 4H, OCH2), 3.84(t,J=5.5 Hz, 4H, OCH2), 3.29(d,J=13.1 Hz, 4H, ArCH2), 1.31(s, 18H, CH3intBu), 0.91(s, 18H, CH3intBu); EI(+)-MSm/z: 825{[M+H2O+H]+}。
(2) 5,7,11,23-四叔丁基-25-羟基-27-乙氧基-杯[4]-1,3-冠-5(3)的合成
在三口烧瓶中依次加入2 0.29 g(0.36 mmol), BaO 0.22 g(1.44 mmol)和无水DMF 25 mL,搅拌下于40 ℃反应30 min;缓慢滴加溴乙烷0.39 g(3.60 mmol),滴毕,反应4 h。减压蒸除溶剂,残余物用CH2Cl2溶解,分液,有机层依次用10%盐酸、饱和NaHCO3溶液和蒸馏水洗涤,无水硫酸钠干燥,减压蒸除溶剂,残余物用CH2Cl2/CH3OH重结晶得白色固体3 0.27 g,收率90%, m.p.221 ℃~228 ℃;1H NMRδ: 7.04(s, 2H, ArH), 7.00(s, 2H, ArH), 6.89(s, 1H, OH), 6.65(s, 4H, ArH), 3.70~4.15(m, 16H, OCH2), 4.52, 3.20(AX,J=12.9 Hz, 4H, ArCH2), 4.41, 3.17(AX,J=13.2 Hz, 4H, ArCH2), 4.30(q,J=6.8 Hz, 2H, CH2in Et), 1.52(t,J=6.8 Hz, 3H, CH3in Et), 1.28, 1.26, 0.88[s, 36H(1 ∶1 ∶2), CH3intBu]; EI(+)-MSm/z: 853{[M+H2O+H]+}。
(3)4的合成
氮气保护,在三口烧瓶中依次加入30.68 g(0.80 mmol), NaH 0.48 g(16.0 mmol)和无水THF 15 mL,搅拌下于室温反应30 min;缓慢滴加3-溴丙烯酸丙酯3.08 g(16.0 mmol),滴毕,于45 ℃反应48 h。减压蒸除溶剂,残余物用CH2Cl2(40 mL)溶解,分液,有机层依次用10%盐酸、饱和NaHCO3溶液和蒸馏水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=1 ∶10)分离得白色固体40.45 g,收率57%, m.p.262 ℃~267 ℃;1H NMRδ: 7.12(s, 4H, ArH), 6.47(d,J=7.6 Hz, 4H, ArH), 6.41(d,J=1.2 Hz, 1H, =CH2), 6.15(m, 1H, =CH), 5.86(d,J=11.6 Hz, 1H, =CH2), 4.45(t,J=12.8 Hz, 2H, CO2CH2), 3.70~4.31(m, 20H, OCH2), 4.36, 3.17(AX,J=12.8 Hz, 4H, ArCH2), 4.34, 3.16(AX,J=12.4 Hz, 4H, ArCH2), 2.31~2.37(m, 2H, CO2CH2CH2), 1.53(t,J=6.8 Hz, 3H, CH3in Et), 1.35, 0.84, 0.82[s, 36H(2 ∶1 ∶1), CH3intBu]; IRν: 1 750(C=O) cm-1; EI(+)-MSm/z: 985{[M+2H2O+H]+}。
2 结果与讨论
在合成2的过程中,先选用叔丁醇钾/甲苯反应体系,反应速度慢,约48 h完成,且产率小于25%;改用K2CO3/CH3CN体系后,反应时间缩短至24 h,且产率提高到74%。
[1] Henirch Z. Synthesis Properities and Application of Organic Dyes and Pigment[M].Newyork,1987.
[2] Murakami H, Shinkai S. “Metal-switched” molecular receptor site designed on a calix[4]arene platform[J].Tetrahedron Lett,1993,34:4237.
[3] Ungaro R, Casnati A, Ugozzoli F A. A new class of novel macrocyclic mesogens[J].Angew Chem Int Ed Engl,1994,33:1505.
[4] 刘育,尤长城,张衡益.超分子化学[M].天津:南开大学出版社,2001.
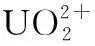
[6] Harris S J, Barrett G, McKervey M A. Polymeric calixarenes. Synthesis,polymerisation and Na+complexation of a calix[4]arene methacrylate[J].J Chem Soc Chem Commun,1991,17:1224.
[7] Kim S I, Shin T J. Synthesis and characterization of new polyimides containing calix[4]arenes in the polymer backbone[J].J Pol Sci Part A,Polym Chem,1999,37:2013.
[8] Blanda M T, Adou E. Syntheses and characterizations of three vinyl copolymers containing pendant calix[4]arenes[J].Polymer,1998,39:3821.
[9] Gravett D M, Guillet J E. Synthesis and photophysical properties of a novel water-soluble,calixarene-containing polymer[J].Macromolecules,1996,29:617.
[10] Kubo Y, Obara S, Tokita S. Metal Ionically-controlled optical signaling based on a chromoionophore-derived calix[4]crown[J].Supramolecular Chemistry,2002,14:461-467.
[11] Sahade, Daniel Antonio. Polymerizable liquid crystal compound, polymerizable liquid crystal composition, and alignment film[P].JP 072 652,2008.
