α-MAP偶氮物的合成*
2013-11-19金则兵郁东辉吴伟冬
徐 旋, 金则兵, 郁东辉, 吴伟冬
(浙江海翔川南药业有限公司,浙江 临海 317016)
β-MAP{1β-甲基碳青霉烯双环母核,化学名:(4R,5S,6S)-3-二苯基磷酰氧基-6-[(1R)-羟基乙基]-4-甲基-7-氧代-1-氮杂双环[3.2.0]庚-2-烯-2-羧酸对硝基苄酯(Chart 1)}是美罗培南、厄他培南、比阿培南、多尼培南等培南类药物的关键中间体母核[1]。按文献[2,3]方法合成β-MAP时,主要杂质为异构体α-MAP[4]。由于β-MAP的质量直接影响培南类药物成品质量,因此,控制α-MAP的生成对培南类药物的生产和质量管理有着重要的指导意义。

Chart1
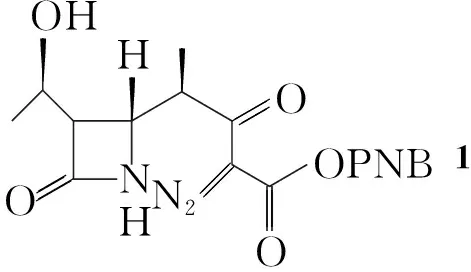
从文献方法的合成路线推断,α-MAP源于α-MAP偶氮物{1,化学名:(3S,4R)-3-[(R)-1-羟乙基]-4-[(1S)-1-甲基-3-重氮-3-对硝基苄氧基甲酰-2-酮-丙基]-2-氮杂环丁酮}。
本文主要研究1的合成,目的在于从源头控制1的生成,为培南类药物的成品质量提供有效保障。以α-4-BMA{(3S,4S)-3-[(R)-1-(叔丁基二甲基硅氧基)乙基]-4-[(S)-1-甲酰乙基]-2-氮杂环丁酮}为起始原料,经缩合、水解等反应合成了1(Scheme 1),其结构经1H NMR和IR核磁确证,并建立了相应的分析方法。
1 实验部分
1.1 仪器与试剂
YRT-3型毛细管熔点仪(温度计未经校正);WZZ-2S型自动旋光仪;VARIAN 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FT-IR-8400S型傅里叶变换红外光谱仪(KBr压片);岛津LC-20A型高效液相色谱仪[HPLC,流动相:V(乙腈) ∶V(水)=65 ∶35, 1.0 mL·min-1,柱温40 ℃,检测波长220 nm]。

Scheme1
α-4-BMA[5],β-MAP偶氮物{(3S,4S)-3-[(R)-1-羟乙基]-4-[(1R)-1-甲基-3-重氮-3-对硝基苄氧羟基-2-酮-丙基]-2-氮杂环丁酮,Chart 1}[2]按文献方法自制;其余所用试剂均为化学纯,有需特殊处理的均按有关方法处理。
1.2 合成
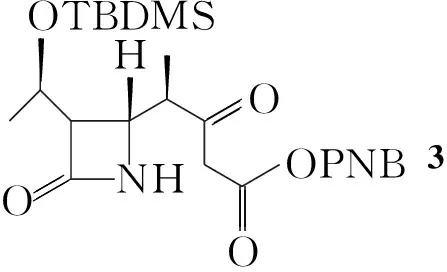
(1) (3S,4R)-3-[(R)-1-(叔丁基二甲基硅氧基)乙基]-4-[(1S)-1-甲基-3-对硝基苄氧基甲酰-2-酮-丙基]-2-氮杂环丁酮(3)的合成
在三口烧瓶中依次加入α-4-BMA 25 g(83 mmol),N′,N-羰基二咪唑18 g(111 mmol)和乙腈100 mL,搅拌释放大量CO2,在氮气保护下升温,于50 ℃反应0.5 h;滴加对硝基丙二酸单酯镁56 g(112 mmol)的乙腈(200 mL)溶液(约1 h),反应至终点(TLC跟踪)。用20%碳酸氢钾溶液洗至中性,分液,有机层浓缩至干得淡黄色油状液体3(直接用于下一步反应)。
(2) (3S,4S)-3-[(R)-1-(叔丁基二甲基硅氧基)乙基]-4-[(1S)-1-甲基-3-重氮-3-对硝基苄氧基甲酰-2-酮-丙基]-2-氮杂环丁酮(4)的合成
在三口烧瓶中加入3和无水乙酸乙酯400 mL,搅拌下于5 ℃~10 ℃滴加对十二烷基苯磺酸叠氮56 g和三乙胺8 g的混合溶液,滴毕,反应约6 h(TLC跟踪)。用0.5 mol·L-1盐酸调至pH 2~3,分液,有机层依次用20%碳酸氢钾溶液、饱和食盐水洗涤,无水硫酸钠干燥,活性炭脱色,旋蒸脱溶;残留物用乙酸乙酯(100 mL)溶解,冷却至5 ℃以下缓慢加入异丙醚100 mL,搅拌3 h。抽滤,滤饼干燥得浅黄色固体4。
(3) 1的合成
2 结果与讨论
分析结果表明,1的结构与Scheme 1所示一致,即为α-MAP偶氮物。
1最初来源于合成β-4-BMA时手性选择产生的异构体α-4-BMA[5]。其含量的多少直接由合成方法决定,专利US 5 104 984报道合成4-BMA时,β∶α=85 ∶15。专利JP 6 065 195A采用不同的合成方法,β∶α=92 ∶8。所以抑制α-4-BMA的生成也有利于控制最后1的含量。此外,在本文中显示1在异丙醇中有相当好的溶解度。通过异丙醇的精制作用,能除去大部分1,其含量能控制在0.1%以下。所以,此方法对于合成高纯度的β-MAP有相当大的帮助。
由于目前对药品的纯度和含量要求越来越高,所以从保证药品的安全性角度来看,相关杂质的研究是必须的[6]。一方面要控制起始原料的相关杂质,另一方面还要控制反应过程中生成的杂质,是新药研发中的难点,也是重点。
本文对培南药物相关杂质的研究与控制,即为提高药物的质量提供了帮助,也为改进工艺条件提供了有力的支持。
[1] 孔漫. 碳青霉烯类抗生素的研究进展[J].中国新药杂志,2003,12(9):700-703.
[2] Kazuhiko Kondo, Masahiko Seki, Tooru Kuroda,etal. 2-Substituted 2,3-dihydro-4H-1,3-benzoxazin-4-ones:A novel auxiliary for stereoselective synthesis of 1β-methylcarbapenems[J].J Org Chem,1995,60(5):1096-1097.
[3] Surulichamy Senthilkumar, Sekar Selvakumar. An improved process for the preparation ofβ-lactam antibiotic[P].WO 2 007 031 858 A2,2007.
[4] David H Shih, Lovji Cama, Burton G Christensen. Synthetic carbapenem antibiotics Ⅲ11-methyl thienamycin[J].Tetrahedron Letters,1985,26(5):587-590.
[5] Xinbo Lu, Zunle Xu, Guojun Yang,etal. Process development on (3S,4S)-{(R)-1′-[(tert-Butyldimethylsilyl)oxy]ethyl}-4-[(R)-1-carboxyethyl]-2-azetidinone:1β-Methylcarbapenem key intermediate[J].Organic Process Research & Development,2001,5:186-188.
[6] 魏农农. 创新型化学药物杂质研究目的、思路与技术要求[J].中国新药杂志,2008,17(16):1461-1463.
