老年胃肠道肿瘤患者围手术期肠内营养的临床研究
2013-11-10卜德勇罗华友
卜德勇 罗华友
围手术期肠内营养是一种贯穿于术前5~7天或更长时间及术后7~8天进行的肠内营养支持方法,是一项新的临床营养支持方法,尤其对于胃肠道肿瘤患者具有极其重要的作用。一般主张术前肠内营养以7~10天为宜,至少坚持5天,时间过短,难以达到预期效果;时间过久,则延迟肿瘤决定性治疗。现代营养支持的大多数研究中将手术后24小时内开始进行的肠内营养支持定义为术后早期肠内营养(Early Enteral Nutrition,EEN)。基于目前对围手术期肠内营养的研究已被认可,但大多局限于非老年人群,老年人围手术期又具有其独特性,故设计本实验,对老年胃肠道肿瘤患者安全渡过围手术期提供具有重要临床意义的实践探索。
1.材料与方法
1.1 材料 样本为我院2009年3月到2011年3月进行手术治疗的年龄在60~79岁的胃肠道肿瘤患者,共计60例,其中胃癌24例,结直肠癌36例,男性34例,女性26例,男/女约为1.3∶1。随机分为实验组(胃癌14例、结直肠癌16例)和对照组(胃癌12例、结直肠癌18例),每组在性别、年龄、体重、疾病种类及手术方式等方面均无统计学差异。入选标准:①经胃镜或结肠镜活检病理证实为胃癌或结直肠癌者;②存在手术指征,能行手术切除者;③同意并能配合者。排除标准:①存在严重心、肺、肝、肾功能障碍者;②合并有神经和精神系统疾病,不能配合者;③正在或近期(半年内)使用皮质激素或免疫抑制剂者;④存在严重感染或内分泌、代谢性疾病者;⑤已接受放疗或化疗者;⑥术后复发或转移接受二次手术者;⑦围手术期输注过血浆或人血白蛋白者;⑧术前有胃肠道梗阻情况;⑨术前严重营养不良需行完全肠外营养支持者。
1.2 方法
1.2.1 鼻饲管留置:①胃癌:术前将鼻饲管尖端插入普通胃管侧孔捆绑固定并经鼻插入胃,连同内导丝固定于颊部,胃管接负压盒。术中直视下顺着导丝将鼻饲管置入吻合口远端10~15cm为标准,拔出导丝,胃管末端置入吻合口近端用以术后减压,两管分别固定于颊部。②结直肠癌:术前将普通胃管经鼻插入胃,固定于颊部接负压盒,术后充当鼻饲管。
1.2.2 肠内营养液的选择及使用注意事项
1.2.2.1 肠内营养液的选择:为同时满足胃癌及结直肠癌术前准备及术后早期需要,选择无渣肠内营养制剂,以统一标准便于比较。且因其食用后肠道内无食物残渣存在,有清洁肠道的作用。
1.2.2.2 使用注意事项:①鼻饲管者:A.体位:半卧位。B.管理:妥善固定,防止脱落、扭曲、受压,每4小时及输注完毕以生理盐水20ml冲管,输注管每日更换。每次输注前,检查鼻饲管位置,若怀疑移位,应在X线下行碘油造影,发现其尖端位于吻合口上方应即刻放弃肠内营养,改为肠外营养,以免引起吻合瘘。C.滴注原则:速度:先慢后快,输液泵控速;浓度:先稀后浓,稀释液为生理盐水或5%葡萄糖;温度38~42℃,采用加温器加热法,加温器置于输注管距口腔的近端,每8小时移动位置。②口服者:少量多次适当加温慢饮,“调味包”改善口味。开启后2℃ ~10℃保存24小时。
1.2.3 方案:①实验组:术前5天开始口服肠内营养1500ml/d,术后第1天(即24小时)起,经鼻饲管滴注肠内营养500ml,用稀释液500ml按1∶1比例稀释,滴速为30~50ml/h;第2天经鼻饲管滴注肠内营养1000ml,稀释液500ml按1∶2比例稀释,滴速为50~80ml/h;第3~7天1500ml/d肠内营养,滴速为80~100ml/h,如病情允许已拔除鼻饲管改口服。热量30kcal/(kg·d),不足量由静脉补充。②对照组:术前按常规要求摄入半流质或流质、低渣或无渣饮食,术后经静脉补充葡萄糖、氨基酸、脂肪乳、维生素及电解质,待胃肠功能恢复后由流质-半流质-普食逐步过渡。热量30kcal/(kg·d),饮食过渡期不足量由静脉补充。
1.2.4 检测指标:(1)实验室指标:术前5天,术后第1、8天分别检测:①营养指标:血红蛋白(Hb)、白蛋白(Alb)、前白蛋白(PA);②免疫指标:IgA、IgG、IgM、;③应激指标:C反应蛋白(CRP)。(2)临床预后指标:观察术后并发症种类、术后住院时间、术后胃肠道功能恢复情况(排气、排便时间)。
1.3 统计学方法 用SPSS统计软件(17.0版)对数据进行分析处理,计量资料以±s表示,进行成组t检验;计数资料以频数和百分比表示,进行χ2检验。当P<0.05认为差异有统计学意义。
2.结果
2.1 营养指标
2.1.1 术前5天两组Hb、Alb、PA水平差异无统计学意义(P >0.05),见表1。
表1 实验室各指标术前5天(±s)

表1 实验室各指标术前5天(±s)
注:#与同期对照组比较,P<0.05。
组别 Hb(g/L)Alb(g/l)PA(g/L)IgG(g/L)IgA(g/L)IgM(g/L)CD+3(%)CD+4(%)CD+8(%)CRP(g/L)实验组110.27±7.40 31.77±3.70 106.51±24.54 15.34±1.41 1.62±0.55 0.97±0.22 57.37±6.38 28.67±2.00 29.97±0.66 0.70±0.16对照组110.40±9.82 32.61±3.39 105.57±15.91 14.29±2.50 1.72±0.52 1.19±0.63 58.59±6.41 29.63±2.69 29.17±1.66 0.73±0.14
2.1.2 术后1天对照组Hb、Alb、PA均较术前下降,其中PA差异有统计学意义(P<0.05),Hb、Alb差异无统计学意义(P>0.05),实验组Hb、Alb、PA均较术前及对照组升高,差异有统计学意义(P<0.05),见表2。
表2 实验室各指标术后1天(±s)

表2 实验室各指标术后1天(±s)
注:#与同期对照组比较P<0.05,*与术前5天比较P<0.05。
组别 Hb(g/L)Alb(g/L)PA(g/L)IgG(g/L)IgA(g/L)IgM(g/L)CD+3(%)CD+4(%)CD+8(%)CRP(g/L)实验组118.71±5.22#*36.80±3.27#*202.05±32.74#*12.48±2.41#*1.25±0.35*0.61±0.30*52.17±3.14*26.08±1.67*27.31±0.69#*13.39±1.05#*对照组107.00±5.13 30.71±2.00 83.54±24.40*9.57±2.97*1.26±0.28*0.80±0.37*51.63±5.18*25.40±2.34*26.49±1.18*14.87±1.33*
2.1.3 术后8天实验组Alb、PA高于对照组,差异有统计学意义(P<0.05),Hb差异无统计学意义(P>0.05),见表3。
表3 实验室各指标术后8天(±s)
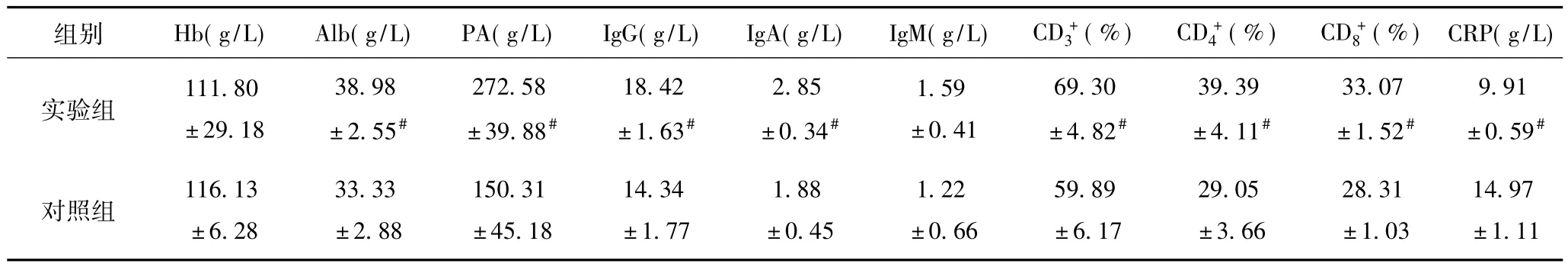
表3 实验室各指标术后8天(±s)
注:#与同期对照组比较P<0.05。
组别 Hb(g/L)Alb(g/L)PA(g/L)IgG(g/L)IgA(g/L)IgM(g/L)CD+3(%)CD+4(%)CD+8(%)CRP(g/L)实验组111.80±29.18 38.98±2.55#272.58±39.88#18.42±1.63#2.85±0.34#1.59±0.41 69.30±4.82#39.39±4.11#33.07±1.52#9.91±0.59#对照组116.13±6.28 33.33±2.88 150.31±45.18 14.34±1.77 1.88±0.45 1.22±0.66 59.89±6.17 29.05±3.66 28.31±1.03 14.97±1.11
2.2 免疫指标
2.3 炎性指标
2.3.1 术前5天两组CRP差异无统计学意义(P>0.05),见表1。
2.3.2 术后1天两组CRP均较术前升高,差异有统计学意义(P<0.05),但实验组升高幅度小,差异有统计学意义(P <0.05),见表2。
2.3.3 术后8天实验组CRP下降并低于对照组,差异有统计学意义(P<0.05),见表3。
2.4 术后并发症 实验组术后并发症总发生率、感染性及非感染性并发症发生率低于对照组,差异有统计学意义(P<0.05)。合并2个以上并发症发生率及死亡率实验组虽低于对照组,但差异无统计学意义(P>0.05),见表4、表5、表6。

表4 术后并发症(人)

表5 术后并发症发生率(%)
表6 术后各观察时间表(±s)

表6 术后各观察时间表(±s)
注:#与同期对照组比较P<0.05。
组别 术后平均住院时间(d)术后排气时间(h)术后排便时间(h)实验组 11.33±1.54# 68.40±4.82# 96.27±5.27#对照组15.00±2.00 99.07±4.62 127.80±7.44
2.5 术后平均住院时间 实验组术后平均住院时间较对照组缩短,差异有统计学意义(P<0.05),见表6。
2.6 术后消化道功能恢复情况 实验组术后肛门排气、排便时间较对照组缩短,差异有统计学意义(P<0.05),见表6。
3.讨论
3.1 围手术期肠内营养支持对老年胃肠道肿瘤患者的必要性 目前胃肠道肿瘤患者多为中、老年人,传统术前肠道准备(饮食限制、饥饿、营养摄入不足、水电解质紊乱、多次灌肠等)尤其容易降低其手术耐受性,术后长时间禁食更严重影响手术愈合及机体恢复,最终影响手术治疗效果。肠内营养既避免了肠道准备对人体的损害及不良影响,体现了对患者的心理及生活质量的人文关怀,把术前肠道准备过程转变为维持并有效改善患者营养状况、提高手术耐受性、保证手术安全性的过程,同时又能促进术后机体快速康复,在保持和维护胃肠功能、减少应激反应、促进肠蠕动、改善营养状况、提高免疫功能等多个方面起着积极的作用,是围手术期极佳的治疗方法。有证据表明,肠内营养是围手术期营养支持的首选途径[1],更有学者提出:围手术期肠内营养对胃肠道恶性肿瘤患者有无法替代的作用[2]。
3.2 围手术期肠内营养支持对老年胃肠道肿瘤患者的营养状况影响 研究显示:①术后1天对照组Hb、Alb、PA均较术前下降,PA差异有统计学意义(P<0.05),Hb、Alb差异无统计学意义(P>0.05)。提示PA是比Alb更敏感的反映蛋白质合成的指标。虽然Alb、PA均由肝脏合成,均可反映蛋白质营养状态,但其半衰期不同,Alb的半衰期较长为20天,而PA的半衰期较短为2~3天,当营养不良或负氮平衡时PA下降[3]。由于PA在体内总含量极少,其更新率高,可敏感地反映机体营养状况改变[4],可作为短期营养治疗效果监测的灵敏指标[5,6],故短期内监测Alb变化幅度不大。而Hb可能因对照组手术耐受性差,术中相对失血多,有输血病例存在干扰结果,故差异无统计学意义(P>0.05)。②术后1天实验组Hb、Alb、PA较术前及对照组升高,差异有统计学意义(P<0.05),表明术前肠内营养可在短期内改善机体高代谢状态,纠正负氮平衡,改善营养状况,提高手术耐受性。③术后8天实验组Alb、PA高于对照组,差异有统计学意义(P<0.05),Hb差异无统计学意义(P>0.05),原因同上。综上所述,围手术期肠内营养对降低因手术、术前肠道准备等所致的老年胃肠道肿瘤患者营养状况下降具有积极意义,可促进蛋白质合成,改善并稳定营养状态,从而提高患者对手术的适应性和耐受性。
3.3 围手术期肠内营养支持对老年胃肠道肿瘤患者的免疫功能影响 研究显示:①术后1天两组 IgG、IgM、IgA、均下降,说明手术创伤使细胞和体液免疫不同程度受到抑制,进一步加重肿瘤本身的免疫抑制。术后免疫抑制是继发感染并发症和多器官功能紊乱的主要原因。但实验组IgM、IgA与对照组相近,差异无统计学意义(P>0.05),说明当免疫营养物质进入机体组织5天,发挥调控炎性反应的作用相对弱。②继续坚持肠内营养的实验组术后8天 IgA、IgG均已回升,两组差异有统计学意义(P<0.05),仅IgM差异无统计学意义(P>0.05),这可能与样本量偏少有关。说明围手术期肠内营养能有效纠正术后细胞免疫抑制的状态,提高Th细胞比例,增高体液免疫指标水平[7,8],在术后早期达到改善免疫功能的作用。究其原因可能与下列机制有关:①肠内营养可改善营养状态,消除了因其所致的免疫功能下降;②肠内营养含有精氨酸、谷氨酰胺及ω-不饱和脂肪酸等营养底物和免疫调节剂,可促进肠黏膜生长,利于毒性物质清除[9];③肠内营养可维持肠黏膜结构完整性和免疫屏障[10],对防止肠道细菌繁殖和降低肠源性感染的发生有重要意义;④肠内营养可直接刺激、营养肠道,有助于肠道细胞正常分泌IgA,防止肠道废用性萎缩,促使肠道相关淋巴组织分泌免疫球蛋白,利于提高全身免疫力,增强大手术后机体抵抗力,降低术后感染发生率。综上所述,围手术期肠内营养对老年胃肠道肿瘤患者可提高患者免疫功能,降低手术风险和减轻手术创伤造成的免疫抑制。
3.4 围手术期肠内营养支持对老年胃肠道肿瘤患者的炎性反应影响 研究显示:术后1天两组CRP均较术前升高,但实验组较对照组升高幅度小,差异有统计学意义(P<0.05);术后8天实验组CRP下降并低于对照组,差异有统计学意义(P<0.05)。表明围手术期肠内营养能减轻过度和有害的炎症反应对机体的损害。
3.5 围手术期肠内营养支持对老年胃肠道肿瘤患者术后并发症的影响 研究显示:实验组术后并发症总发生率、感染性及非感染并发症发生率低于对照组,差异有统计学意义(P<0.05)。表明围手术期肠内营养对早期改善术后免疫抑制突出,可降低术后感染性并发症的发生,对老年患者围手术期肠内营养还可明显减少心肺功能不全、电解质紊乱、应急性溃疡等非感染性并发症的发生。合并2个以上并发症发生率及死亡率实验组虽低于对照组,但差异无统计学意义(P>0.05),这可能与样本量偏少有关。
3.6 围手术期肠内营养支持对老年胃肠道肿瘤患者术后机体恢复影响 术后住院时间的长短可间接反映术后机体恢复至接近生理状态的时间。本研究实验组术后平均住院时间较对照组缩短,差异有统计学意义(P<0.05)。原因可能与实验组术后并发症发生率低有关。表明围手术期肠内营养更适用于老年胃肠道肿瘤患者,能及早使患者术后达到接近生理状态,利于术后恢复。
3.7 围手术期肠内营养支持对老年胃肠道肿瘤患者的肠道功能影响 术后肛门排气、排便时间可反映肠道功能的恢复。本研究实验组术后肛门排气、排便时间均较对照组缩短,差异有统计学意义(P<0.05)。原因可能是由于食物刺激胃肠道激活了肠道神经内分泌免疫轴,促进肠道激素和胃激素的合成与释放,加速恢复胃肠分泌和蠕动功能[11]。
4.结论
围手术期肠内营养对于老年胃肠道肿瘤患者是安全、方便、有效的。本实验在术前及术后早期给予肠内营养,能有效地改善营养状况、调节免疫功能、抑制高炎症反应、降低并发症发生率、缩短术后住院时间、促进胃肠道功能恢复、增加老年胃肠道肿瘤患者对手术的耐受性。故围手术期肠内营养对老年胃肠道肿瘤患者有着无法替代的作用。
1 杨振淮,李关宁.胃肠道恶性肿瘤患者围手术期肠内营养支持的疗效分析[J].实用全科医学,2008,6(5):483-484.
2 徐海帆,谭风波.围手术期肠内营养支持对胃肠道恶性肿瘤患者的疗效评估[J].海南医学,2011,22(11):14-17.
3 葛学顺.血清前白蛋白的检测及临床应用[J].中国综合临床,2000,18(12):951.
4 李立和,田刚.血清前白蛋白的研究进展[J].国际检验医学杂志,2007,28(3):247.
5 胡建华,万向农,毛文义.肝癌与胃癌患者血清前白蛋白测定的临床意义[J].华北煤炭医学院学报,2006,8(3):338.
6 Beck FK,Rosenthal TC.Prealbumin:a marker for nutritional evaluation[J].Am Fam Phy,2002,65(8):1575.
7 许剑民,何连齐,吴新华,等.胃肠道肿瘤患者术前肠内免疫营养支持[J].中华消化杂志,2005,25(1):19 -22.
8 钟海均,应杰儿,马胜林.肿瘤专用型肠内营养乳剂对胃癌患者营养状况和免疫功能的影响[J].中华胃肠外科杂志,2006,9(5):405-408.
9 Lewis SJ,Egger M,Sylvester PA,et al.Early enteral Feeding versus nilby mouth after gastrointestinal surgery:systematic review and meta analysis of controlled trial[J].BMJ,2001,323(7316):773 - 775.
10 吴旭东,梁继刚,张虹,等.肠内营养对胃癌患者术后肠粘膜屏障功能的影响[J].中国医师进修杂志,2007,30(12):9.
11 新裕,刘寒.肠内营养与胃肠动力[J].中国实用外科杂志,2003,23(2):81-82.
