Taqman探针实时荧光定量PCR检测肝脏疾病患者血清中miR-122的表达水平及其临床意义*
2013-11-07吴瑞珊苏运钦余广超林晓丹陈文璟温旺荣
吴瑞珊, 苏运钦, 余广超, 林晓丹, 李 莉, 陈文璟, 温旺荣
微小RNA(microRNA,miRNA)是一类广泛存在于真核生物的长约22个核苷酸的非编码RNA分子。miRNA具有调节生长发育、脂肪代谢、细胞增殖与凋亡及影响肿瘤的转移和侵袭等作用,对炎症与肿瘤之间的转变起一定的调节作用[1],现已在人类发现923个miRNA,记录于miRNA数据库(http://microrna.sanger.ac.uk)[2]。近年研究发现 miRNA广泛存在于哺乳类动物血清中,自从2008年Lawrie等[3]首先在弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)病人血清中检测出miR-21升高后,大量研究证明血清miRNA可作为肿瘤及其它疾病诊断、治疗及预后监测的无创性生物指标。miR-122位于人类18号染色体18q21.31上,是一种肝脏特异性miRNA,影响肝脏的生理与病理过程[4]。我国是乙型肝炎的高发区,也有丙型肝炎的报道,这两种肝炎的慢性化和纤维化后可发展为肝癌。目前肝癌病死率在我国恶性肿瘤位居第3位,严重威胁人类健康。现在这些肝脏疾病的相关标志物有相关病毒的抗原、抗体、核酸及甲胎蛋白(alpha fetal protein,AFP)等。AFP对肝癌检测特异性高,但敏感性不够,往往AFP高时已是肝癌晚期,无法早期诊断。为了从miRNA中寻找能特异、敏感的肝癌标志物,我们利用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测了不同肝脏疾病血清中miR-122表达水平,考察miR-122与肝脏不同疾病标志物的关系,试图研究miR-122能否作为肝癌疾病的新指标。
材料和方法
1 标本
选取2011年9月~2012年4月暨南大学附属第一医院住院和门诊病人及健康体检者共93例作为研究对象,见表1。其中以健康体检者15例为正常对照(healthy control,HC)组;经过肝脏影像学、病理学及标志物检测,肝癌指标阴性但血清HBV-DNA含量>1×105U/L及HBsAg阳性的患者15例为乙型肝炎(hepatitis B)组;经过肝脏影像学、病理学及标志物检测,肝癌指标阴性但血清HCV-RNA含量>1×106U/L及抗HCV阳性的患者15例为丙型肝炎(hepatitis C)组;以病理结果为肝细胞癌的患者27例为肝癌术前(preoperative hepatocellular carcinoma,HCC)组;以病理结果为肝细胞癌的肝癌术后患者11例为肝癌术后(postoperative hepatocellular carcinoma,PHCC)组;肝癌术后复发(recurrence)组10例。抽取各试验者2~3 mL静脉血,3 500 r/min离心5 min,取血清于-70℃保存。
2 仪器及试剂
ABI 7000荧光定量PCR仪(ABI);高速冷冻离心机(中国科技大学中佳公司);生物安全柜(ESCO);Biophotometer生物分光光度计(Eppendorf);移液器(Eppendorf);miR-122 Taqman探针荧光定量试剂盒和U6 Taqman探针荧光定量试剂盒(上海吉玛公司);氯仿、异丙醇和无水乙醇(广州达晖生物技术有限公司);Trizol试剂、逆转录所需的dNTP、MMLV-逆转录酶及RNase-free去离子水(Invitrogen)。
3 引物及Taqman探针设计和合成
根据miRBase数据库的miR-122基因序列及根据NCBI中U6 snRNA序列设计和合成逆转录茎环引物、PCR反应引物及探针。miR-122 PCR扩增上游引物5'-CAAGCGTTGGAGTGTGACA-3',下游引物5'-CGTCCTACCATTCTCCAGC-3';Taqman探针序列FAM-CCCACAGACGGCAAACACCATT-BHQ1。内 参照U6 snRNA PCR扩增上游引物5'-ATTGGAACGATACAGAGAAGATT-3',下游引物 5'-GGAACGCTTCACGAATTTG-3';Taqman探针序列FAM-TGCGCAAGGATGACACGCA-BHQ1。以上引物及探针由上海吉玛公司合成。
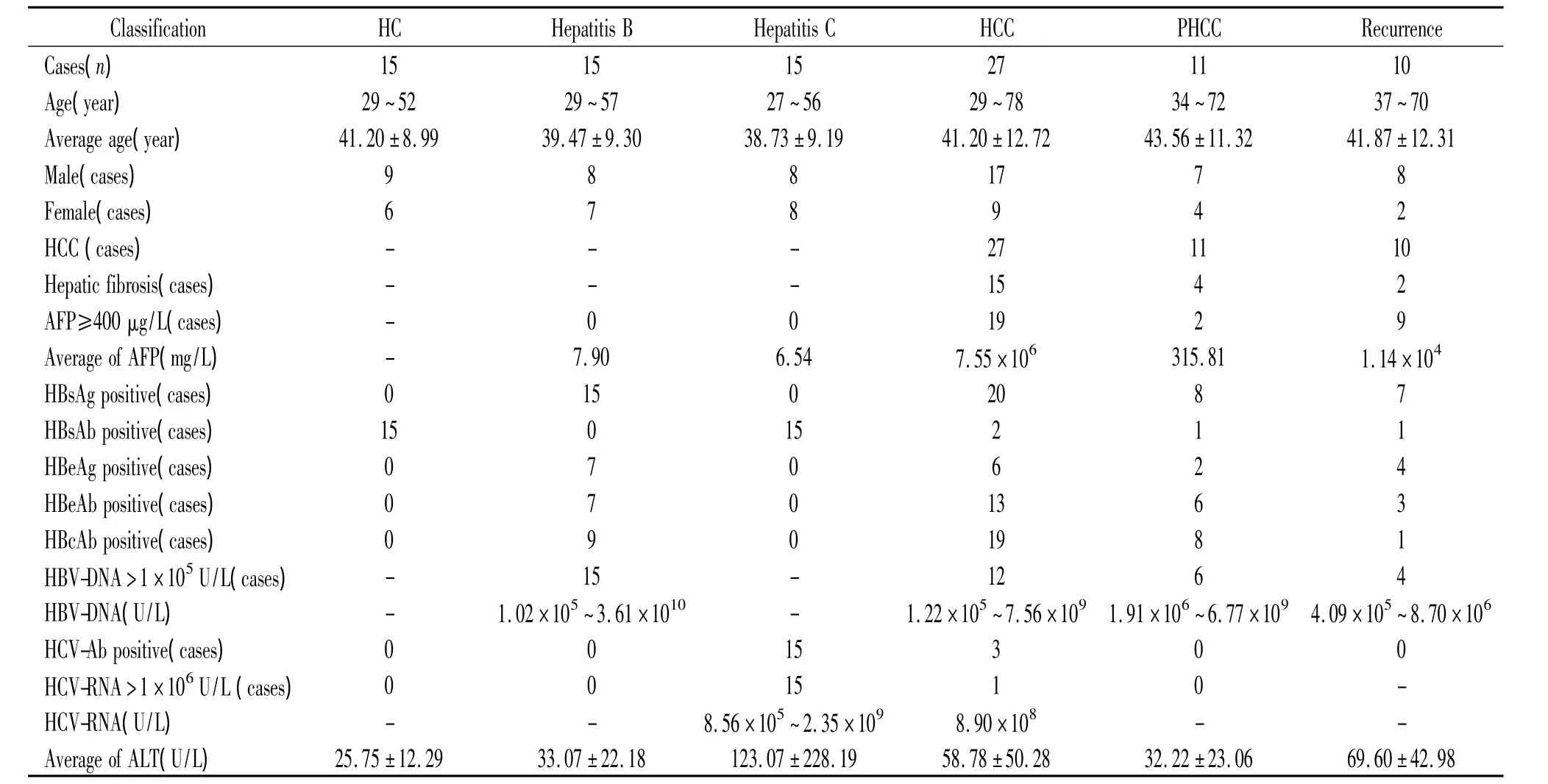
表1 研究对象详细资料Table 1.Detail data of the subjects in the study
4 总RNA提取
取300 μL血清,加入1 mL TRIzol试剂反复吹打后,常温放置20~30 min。12 000 r/min离心 10 min,取上清。加入200 μL氯仿每1 mL TRIzol试剂,盖好样品管,剧烈振荡15 s左右至乳胶状,室温放置15 min。12 000 r/min,4℃离心10 min。取另一EP管加入500 μL异丙醇,将上层水相加入混合均匀,4 ℃放置10 min,12 000 r/min,4 ℃离心10 min。移去上清液,每1 mL TRIzol试剂加入1 mL用0.1%DEPC水配制的预冷75%乙醇,混匀。7 500 r/min,4℃离心15 min。尽量去除上清液,RNA沉淀室温干燥12 ~15 min,加入 25 μL DEPC 水溶解 RNA,65℃烤箱12 min。
5 总RNA纯度和浓度的检测
取2 μL 总 RNA,加 98 μL RNase-free 去离子水稀释,在260 nm和280 nm波长下检测吸光度,若A260/A280为1.8~2.1,取 RNA 浓度为25~50 ng/μL进行下一步实验。
6 miR-122及U6的逆转录反应体系
5 ×逆转录缓冲液4 μL,dNTP(10 mmol/L)0.75 μL,逆转录引物(1 μmol/L)1.20 μL,MMLV 逆转录酶(200 U/μL)0.1 μL,RNasin(40 U/μL)0.15 μL,总 RNA 5 μL,RNase-free 去离子水8.87 μL。反应设一复孔,以5 μL RNase-free去离子水取代总RNA作为阴性对照。反应条件:16℃ 30 min,42℃ 30 min,85℃ 10 min。
7 Taqman荧光定量PCR反应检测血清中miR-122及U6含量
反应体系为20 μL:2×Real-time PCR Mix 10 μL、Primer Set(20 μmol/L)0.40 μL、Taqman 探针(10 μmol/L)0.10 μL、rTaq DNA 聚合酶(5 U/μL)0.25 μL,逆转录产物 2.00 μL、RNase-free 去离子水7.30 μL。反应设一复孔,以2 μL RNase-free 去离子水取代cDNA作为空白对照。反应条件:95℃ 3 min;95℃ 12 s,62℃ 40 s,40个循环。基因表达变化倍数采用 2-ΔΔCt法进行比较,ΔΔCt=(实验组CtmiR-122-实验组CtU6snRNA)-(对照组CtmiR-122-对照组CtU6snRNA)。以miR-122表达量最低的一组作为对照组。
8 统计学处理
采用SPSS 13.0统计软件进行数据处理。将2-ΔΔCt进行对数转换后,经K-S检验检测数据呈正态分布,Levene检验检测数据具有方差齐性(P>0.1),因此选用One-way ANOVA检验作统计分析。用两独立样本t检验和Pearson相关分析检测血清miR-122与其它血清指标的关系。以P<0.05为差异有统计学意义。
结 果
1 实时荧光定量PCR检测结果
阳性曲线和患者血清miR-122及U6 snRNA的反应曲线呈标准S型,阴性和空白对照产生的微弱非特异信号呈不规则曲线。U6 snRNA在所有标本中都有表达,其Ct值波动于26.70±1.08,可作为本实验的内参照,见图1。
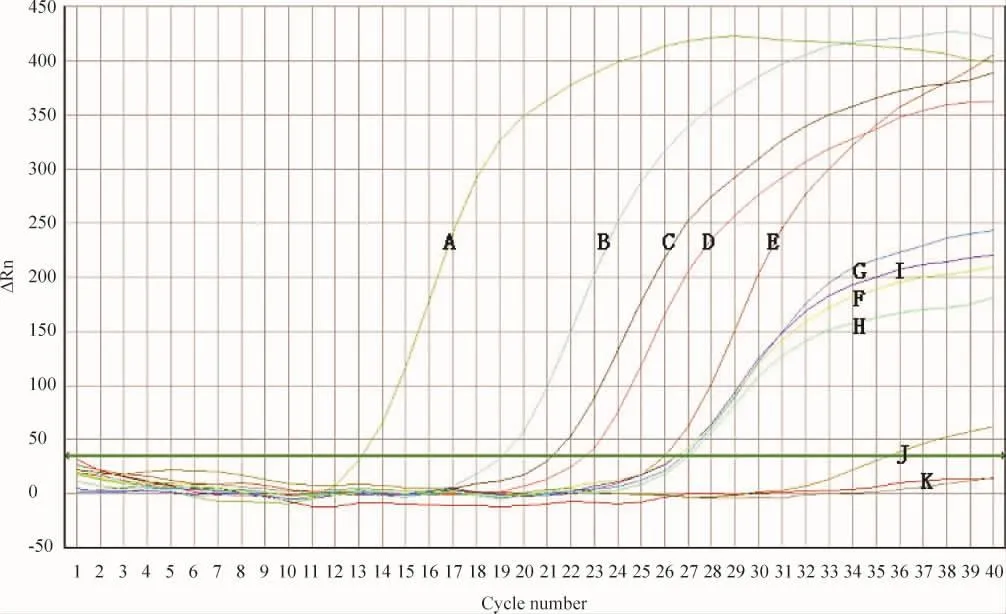
Figure 1.The amplification curves of real-time fluorescence quantitative PCR.A:miR-122 standard positive curve;B:miR-122 curve of hepatitis C patients;C:miR-122 curve of hepatitis B patients;D:miR-122 curve of preoperative hepatocellular carcinoma patients;E:miR-122 curve of healthy controls;F:U6 snRNA curve of hepatitis C patients;G:U6 snRNA curve of hepatitis B patients;H:U6 snRNA curve of preoperative hepatocellular carcinoma patients;I:U6 snRNA curve of healthy controls;J:U6 snRNA curve of negative control;K:U6 snRNA curve of blank control.图1 实时荧光定量PCR扩增曲线
2 血清miR-122与肝脏疾病的关系
经One-way ANOVA 检验,F=20.01,P<0.05,可认为5组被检测者血清中miR-122的表达水平不同。经多个样本均数间两两比较的SNK-q检验,HCC组、hepatitis B组、hepatitis C组和recurrence组患者血清中miR-122表达水平均高于HC组及PHCC组(P<0.05),HCC组、hepatitis B组和recurrence组患者血清中miR-122表达水平低于hepatitis C组(P<0.05),HCC组、hepatitis B组和 recurrence组患者血清miR-122的表达没有明显差异(P>0.05),HC组和PHCC组血清miR-122的表达没有明显差异(P >0.05),见表2。
3 血清miR-122与其它血清指标的关系
3.1 与血清HBsAg的关系 经两独立样本t检验检测,HCC组、hepatitis B组、PHCC组和 recurrence组血清HBsAg(+)和HBsAg(-)患者血清miR-122的表达有显著差异(P<0.05),HBsAg(+)组血清miR-122的表达高于HBsAg(-)组,见表2。
3.2 与血清HBeAg的关系 经两独立样本t检验检测,hepatitis B组、HCC组、PHCC组和 recurrence组中血清HBeAg(+)和HBeAg(-)者血清miR-122的表达有显著差异(P<0.05),HBeAg(+)组血清miR-122的表达高于HBeAg(-)组,见表2。
3.3 与血清HCV-Ab的关系 经两独立样本t检验,hepatitis C组和 HCC组血清 HCV-Ab(+)与HCV-Ab(-)者血清 miR-122的表达有差异(P<0.05),血清HCV-Ab(+)组血清miR-122的表达高于HCV-Ab(-)组,见表2。
3.4 与血清ALT的关系 经Pearson相关分析,血清miR-122与血清ALT的相关系数r=0.34(P<0.05),即血清miR-122的表达与血清ALT活性有正相关关系。
3.5 与血清AFP的关系 经两独立样本t检验检测,HCC组、PHCC组和 recurrence组中血清 AFP≥400 μg/L 和AFP <400 μg/L 者血清 miR-122的表达有显著差异(P<0.05),血清 AFP≥400 μg/L组血清miR-122的表达高于AFP<400 μg/L组,见表2。
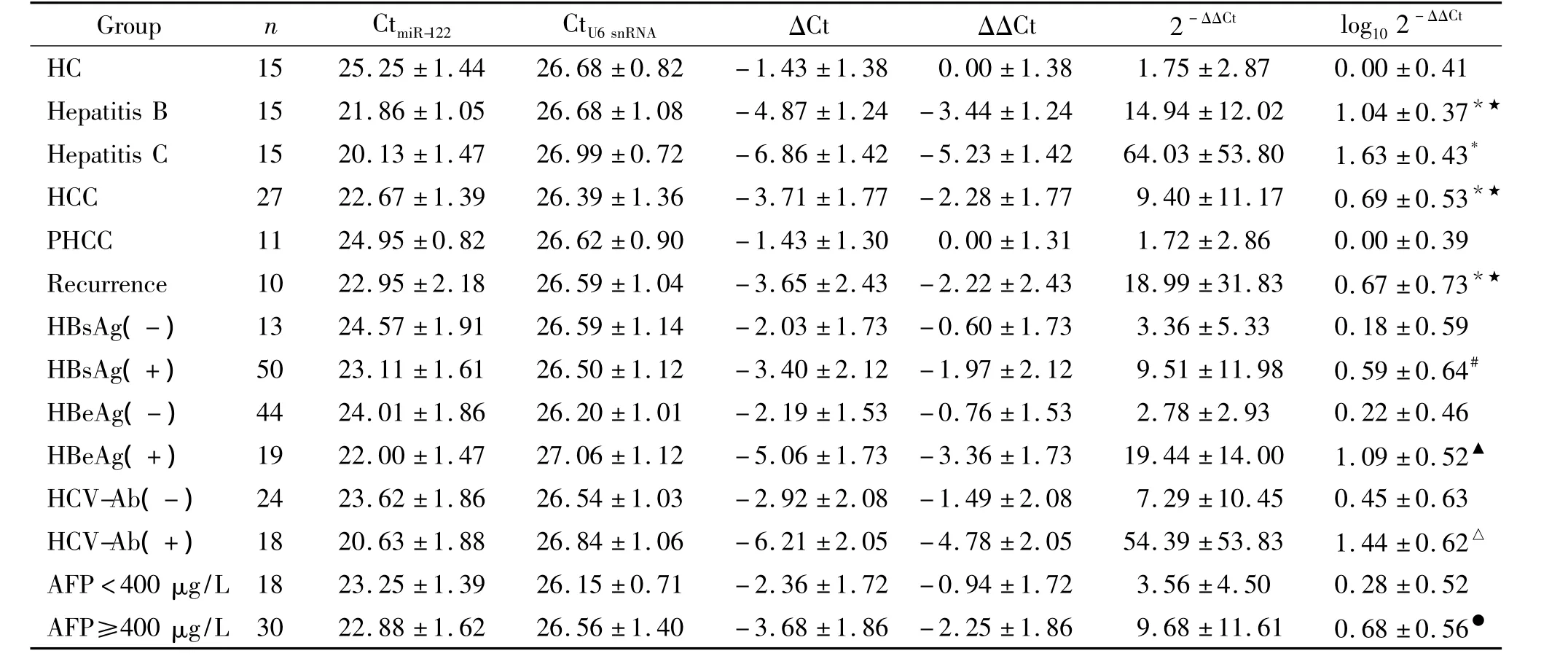
表2 Taqman探针实时荧光定量PCR检测血清miR-122的表达情况Table 2.The level of serum miR-122 detected by Taqman probe real-time fluorescence quantitative PCR(mean±SD)
讨 论
本实验设计了茎环引物及Taqman探针,利用实时荧光定量PCR发现肝癌术前组血清miR-122的表达水平高于正常对照组,肝癌术后组血清miR-122的表达比术前明显降低,与Peng等[5]研究基本相符。Xu等[6]认为乙型肝炎患者血清 miR-122的表达高于肝癌患者,而Peng等[5]则认为两者的差异处于边界(P=0.043),但本实验认为肝癌术前组血清miR-122的表达与乙型肝炎组没有明显差异。其中原因可能是由于研究对象、实验方法、内参照的选择以及数据的处理存在差异,Xu等采用的是SYBR Green染料法、以miR-181为内参照;Peng等其研究对象血清ALT有明显差异(P<0.01)、以miR-16为内参照。众所周知,血清ALT是肝脏损害的生物指标之一,本研究证实miR-122与ALT存在正相关关系,实验中肝癌术前组血清ALT与乙型肝炎组有差异(P<0.05),推测血清ALT的水平和肝脏损害程度影响着miR-122的表达。另外,探针法的特异性及重复性高于染料法,茎环引物也有利于提高本实验检测的特异性。目前检测循环miRNA时内参照的选择没有得到统一,本研究以U6 snRNA为内参照,实验结果表明U6 snRNA在血清中表达稳定。同时,有学者认为U6 snRNA在同一个体血清和血浆中丰度相对稳定,可适用于循环miRNA的检测[7]。
丙型肝炎患者血清miR-122含量高于乙型肝炎属于首次发现,其临床意义有待研究。导致这2种肝炎患者血清miR-122表达差异的原因可能是miR-122在这2种肝炎的作用机制不同和选择的标本中肝炎病毒的高表达。在乙型肝炎肝脏细胞中,miR-122通过方向调节cyclin G1,阻断 cyclin G1与 P53途径,间接抑制乙型肝炎病毒的复制[8];在丙型肝炎中,miR-122高表达能增强丙肝病毒的复制[9]。本实验2种肝炎病毒含量较高:乙型肝炎组HBV-DNA含量于1.02×105~3.61×1010U/L之间,均数6.81×109U/L;丙型肝炎组HCV-RNA含量于8.56×105~2.35×109U/L之间,均数6.32×109U/L。推测乙型肝炎组HBV-DNA的高含量可能由于乙型肝炎病毒被miR-122抑制作用减弱,即miR-122的表达相对不足导致的;而丙型肝炎组中HCV-RNA的高含量则是由于miR-122的高表达。另外,本实验肝癌患者大部分为乙型肝炎病毒相关的肝癌,同样,估计由于上述的原因导致肝癌组患者血清miR-122低于丙型肝炎组。
乙型肝炎病毒抗原性与血清miR-122的表达有关,Zhu[10]等认为miR-122对乙型肝炎病毒抗原蛋白有调节作用,HBsAg阳性是乙型肝炎病毒感染的标志之一,HBsAg阳性患者血清miR-122高于HBsAg阴性患者(P <0.05),Novellino等[11]研究表明循环血中HBsAg参与肝癌相关miRNAs的运载,有9种miRNAs与HBsAg免疫复合物有关,同样发现miR-122在HBsAg阳性患者血清中升高。与本实验结果相符,Ji等[12]检测到慢性乙型肝炎患者HBeAg阳性患者血清miR-122的表达高于HBeAg阴性者。本实验认为在乙型肝炎病毒相关肝癌中上述结论同样成立。
AFP作为肝癌的检测指标,AFP≥400 μg/L,能排除妊娠、生殖系胚胎源性肿瘤、活动性肝病及转移性肝癌,并能触及肿大、坚硬及有大结节状肿块的肝脏或影像学检查有肝癌特征的占位性病变,作为肝癌诊断标准之一。本研究证实肝癌术前和术后患者血清AFP≥400 μg/L者血清miR-122的表达水平高于AFP <400 μg/L 者(P <0.05)。Kojima等[13]认为miR-122/CUX1/miR-214/ZBTB20通路调节 AFP的表达,miR-122/CUX1/RhoA通路影响肝癌的恶性程度,AFP水平可能是肝癌组织miR-122低表达的反映,肝癌组织中miR-122呈现低表达[14],与血清标本截然相反。有学者认为细胞内外miRNA表达图谱是不一样的,miRNA从组织释放到血清具有选择性[15],这种选择性可能是肝癌血清与肝癌组织miR-122表达不同和肝脏疾病患者血清miR-122产生差异的原因。
总之,miR-122作为一种肝脏特异性miRNA,在肝癌术前、乙型病毒肝炎及丙型病毒肝炎等肝脏疾病患者血清中升高,在肝癌术后患者血清中表达水平明显降低,达到正常对照组水平,肝癌术后复发者升高,而且丙型肝炎含量高于乙型肝炎患者。这对肝脏疾病,尤其是肝癌的诊断、治疗及手术预后判断有重要意义。
[1] 吴瑞珊,温旺荣.外周血 miRNA的诊断意义[J].分子诊断与治疗杂志,2012,4(2):131-136.
[2] 李育敏,费 嘉.MicroRNA与血液系统肿瘤发生、诊断和治疗[J].中国病理生理杂志,2009,25(11):2225-2229.
[3] Lawrie CH,Gal S,Dunlop HM,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J].Br J Haematol,2008,141(5):672-675.
[4] Wu X,Wu S,Tong L,et al.miR-122 affects the viability and apoptosis of hepatocellular carcinoma cells[J].Scand J Gastroenterol,2009,44(11):1332-1339.
[5] Peng Q,Shu QC,Hao W,et al.Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection[J].PLoS One,2011,6(12):e28486.
[6] Xu J,Wu C,Che X,et al.Circulating microRNAs,miR-21,miR-122,and miR-223,in patients with hepatocellular carcinoma or chronic hepatitis[J].Mol Carcinog,2011,50(2):136-142.
[7] 王丹妮,黄世峰,府伟灵,等.肝损伤相关循环miRNAs检测方法的建立与初步应用[J].中华医院感染学杂志,2011,21(10):1985-1987.
[8] Wang S,Qiu L,Yan X,et al.Loss of microRNA 122 expression in patients with hepatitis B enhances hepatitis B virus replication through cyclin G1-modulated P53 activity[J].Hepatology,2012,55(3):730-741.
[9] Kambara H,Fukuhara T,Shiokawa M,et al.Establishment of a novel permissive cell line for the propagation of hepatitis C virus by expression of microRNA miR122[J].J Virol,2012,86(3):1382-1393.
[10] Zhu L,Chen Z,Chen JZ,et al.Effects of miR-122 on expression of hepatitis B virus proteins[J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2011,40(6):593-597.
[11] Novellino L,Rossi RL,Bonino F,et al.Circulating hepatitis B surface antigen particles carry hepatocellular microRNAs[J].PLoS One,2012,7(3):e31952.
[12] Ji F,Yang B,Peng X,et al.Circulating microRNAs in hepatitis B virus-infected patients[J].J Viral Hepat,2011,18(7):e242-e251.
[13] Kojima K,Takata A,Vadnais C,et al.MicroRNA122 is a key regulator of α-fetoprotein expression and influences the aggressiveness of hepatocellular carcinoma[J].Nat Commun,2011,2:338.
[14] Liu ZR,Chen XW,Qiao XH,et al.Detection of miR-122a and miR-224 expression in hepatocellular carcinoma by real-time fluorescence quantitative RT-PCR[J].Nan Fang Yi Ke Da Xue Xue Bao,2009,29(4):751-753.
[15] Pigati L,Yaddanapudi SC,Iyengar R,et al.Selective release of microRNA species from normal and malignant mammary epithelial cells[J].PLoS One,2010,5(10):e13515.
