高原鼠兔血红素氧合酶1的基因克隆及序列分析*
2013-11-07杨应忠曹雪峰格日力
杜 杨, 杨应忠, 马 燕, 曹雪峰, 格日力
近年来,血红素氧合酶(heme oxygenase,HO)在氧化应激损伤中的细胞保护作用越来越多地受到国内外学者的广泛关注。HO是血红素代谢的起始酶和限速酶,几乎分布于所有的组织和器官,主要存在于滑面内质网中。已证实在人类和哺乳动物体内,共发现3种 HO的同工酶,分别为 HO-1、HO-2和HO-3[1]。它们在胆红素形成过程中能降解血红素,产生等摩尔的胆绿素、一氧化碳(carbon monoxide,CO)和铁(Fe2+)。胆绿素在胆绿素还原酶作用下迅速生成胆红素。近年来研究发现,许多因素可引起诱导型HO(HO-1)的表达增加[2],HO-1及血红素降解产物胆绿素、胆红素、CO和铁离子参与机体许多生理和病理过程,发挥着积极重要的调节作用。HO-1在氧化应激状态下,通过抑制炎性因子的产生、直接的抗氧化应激、衰减炎症应答,从而达到对细胞的保护[3-5]。CO作为HO-1降解血红素产生的重要产物之一,与细胞内另一重要信息调节分子一氧化氮(nitric oxide,NO)具有类似的生物学功能,二者具有相似的信号转导途径,NO的一些生物效应参与了HO-1的诱导和CO生成,在某些情况下HO-1的活性也调节着NO的产生。
高原鼠兔(plateau pika/Ochotona curzoniae)是青藏高原特有的小型哺乳动物,为兔形目、鼠兔科、鼠兔属[6],世代生活在海拔3 200~4 700 m的低氧、极寒草原,在其数代的自然选择、进化过程中已形成自己独特的高效率的能量代谢和氧传递利用机制,使其可以耐受低氧、低温的高原环境。
本中心以往的研究表明,对于复杂恶劣的高原环境,高原鼠兔一方面通过对器官、组织、结构以及功能水平的变化调节协助其适应低氧环境,另一方面从分子水平对某些低氧相关基因的特异性突变及其表达水平的调控来适应低氧环境;高原鼠兔血红蛋白、肌红蛋白、低氧诱导因子、Na+,K+-ATP酶与平原地区动物核苷酸和氨基酸序列相比较发现,高原鼠兔与其比较存在多个差异位点,其突变位点与高原鼠兔高原适应的关系值得进一步研究[7-8]。对高原鼠兔的肺、骨骼肌的生理功能的研究表明,高原鼠兔通过维持细胞内正常水平的NO,进而降低肺血管的张力,抑制平滑肌增殖,调节血流量,减少肺血管内皮细胞损伤,保证它在长期低氧暴露下的机体防御功能[9]。以白肌纤维为主的高效储氧的骨骼肌,对其适应高原的生存环境也具有重大意义[10]。因此,为了对高原鼠兔低氧适应的分子机制进行深入研究,本研究克隆并分析高原鼠兔HO-1基因cDNA序列。
材料和方法
1 动物
2011年7月于青海省天俊县木里镇(海拔约4 062 m,东经96°49'~99°41',北纬 36°53'~ 48°39')捕捉高原鼠兔13只,平均体重200 g,25%乌拉坦腹腔注射麻醉,解剖后取肝组织并置于液氮中,低温保存备用。
2 主要试剂
动物组织总RNA提取试剂盒、cDNA第1链合成试剂盒、DNA分子量标准、普通DNA产物纯化试剂盒、2×Taq PCR MasterMix聚合酶购自天根公司;TaKaRa 3’Full RACE试剂盒、RNase H、T4 RNA连接酶购自大连宝生物公司。其它试剂均为国产或进口产品。
3 主要方法
3.1 引物设计与合成 通过GenBank中公布的兔(Oryctolagus cuniculus XM_002711415)、人(Homo sapiens NM_002133.2)、牛(Bos taurus M_002133.2)、小鼠(Mus musculus NM_010442.2)、大鼠(Rattus norvegicus NM_012580.2)等哺乳动物物种的HO-1的cDNA序列,根据其同源性,利用Primer 5.0软件和DNAMAN 6.0软件结合鼠兔与以上各物种间HO-1比对得到的相对保守区来设计扩增引物,引物名称及序列见表1。引物由上海英潍捷基有限公司合成,引物子液工作浓度10 μm。

表1 HO-1引物序列Table 1.The primer sequences of HO-1
3.2 总RNA的提取及鉴定 采用RNA提取试剂盒提取高原鼠兔肝组织中的总RNA,并用分光光度计和1%琼脂糖凝胶电泳检测RNA的纯度及浓度,RNA检测符合标准后置于-80℃冰箱保存备用。
3.3 RT-PCR扩增 根据cDNA第1链合成试剂盒,5 μg 总 RNA,2 μL Oligo(dT)或 2 μL Random 或2 μL 基因特异性引物,2 μL dNTP,补 RNase-free 水至14.5 μL,70 ℃加热5 min后迅速冰上冷却2 min,简短离心后加入 4 μL 5 × First-Strand Buffer,0.5 μL RNasin,最后加入1 μL M-MLV,用移液器混匀,将上体系25℃温浴10 min,42℃温浴50 min,95℃加热5 min终止反应,冷冻保存。PCR的反应体系:2×Taq PCR MasterMix聚合酶25 μL,上、下游引物各1 μL(10 μmol/L)及 cDNA 模板 2 μL,加双蒸水补足到50 μL。PCR反应条件为:95℃预变性2 min,96℃ 10 s,退火30 s,72 ℃ 30 s,共35个循环(各引物退火温度和循环次数见表1),72℃ 10 min,4℃保存。
3.4 3’末端的PCR扩增 根据简并引物2F-2R扩增测序结果设计内、外侧特异性引物(PK-HO1-3INNER和PK-HO1-3OUTER,见表1),与大连宝生物的TaKaRa 3’-Full RACE试剂盒提供的通用接头引物进行PCR扩增,即采用套式PCR技术:使用上游外侧特异性引物和3’RACE outer primer进行第1步PCR反应。如果第1步PCR反应未能得到目的产物,在使用上游内侧特异性引物(PK-HO1-3INNER,见表1)和3’RACE inner primer进行第2步PCR反应。
3.5 5’末端的PCR扩增 以cDNA为模板,根据3’末端测序结果,另设计2对基因特异性引物S1、A1、S2、A2以及末端磷酸化的反转录产物 PK-5’RT。首先合成cDNA第1链,即用末端磷酸化的反转录引物在反转录酶(reverse transcriptase,RT)催化作用下对总RNA进行反转录,再使用水解酶RNase H将Hybrid DNA-RNA中的RNA链分解,然后采用连接酶T4 RNA Ligase将单链cDNA进行环化形成首尾连接物。进行套式PCR扩增时,第1步扩增采用基因特异性引物A1和S1,第2步PCR扩增以第1轮PCR产物为模板,采用基因特异性引物A2和S2扩增出未知mRNA的5’端,套式PCR扩增方法、体系、条件等与普通PCR扩增一致。
3.6 PCR产物的回收及序列测定 PCR扩增产物根据预测片段大小的差异,采用1.5%和2.0%琼脂糖凝胶电泳分离出特异性目的片段。用普通DNA产物纯化试剂盒按说明纯化DNA片段,回收纯化的DNA片段采用正、反向测序,测序由上海英潍捷基贸易有限公司完成。
4 数据处理与分析
将各序列测序结果进行拼接,在NCBI数据库的BLAST工具栏中对测序结果进行比对分析;NCBI数据库的ORF Finder工具及Sequencher软件对开放阅读框架进行预测,DNAMAN 6.0软件可进行序列的相似性分析,Bioedi软件将核苷酸序列翻译成相对应的氨基酸序列,MEGA 5.0构建系统进化树。
结 果
1 总RNA的提取
RNA提取试剂盒提取的高原鼠兔肝脏组织总RNA,测定A260/A280为1.83;琼脂糖凝胶电泳结果可见清晰完整的18S和28S条带和较淡的5S条带,提示所提取总RNA纯度较高且未降解,可用作逆转录模板,用于下一步RT-PCR反应。
2 PCR扩增结果
合成的高原鼠兔HO-1基因cDNA在PCR仪里进行扩增,扩增产物经琼脂糖凝胶电泳,然后在凝胶电泳成像仪紫外灯下观察,得到的特异目的条带与预期片段大小一致,见图1。回收纯化PCR产物后送测序。

Figure 1.Agarose gel electrophoresis of RT-PCR-amplified Ochotona curzoniae HO-1 gene fragments.A:primer 2F-2R-amplified gene fragment;B:primer 3’RACE-amplified gene fragment;C:primer S2-A2-amplified gene fragment;D:primer F2-R2-amplified gene fragment;M1:5 000 bp marker;M2:2 000 bp marker.图1 高原鼠兔HO-1基因RT-PCR扩增产物片段凝胶电泳
3 测序结果及序列分析
3.1 cDNA序列拼接和开放阅读框的预测 对测序结果进行拼接,所测序列得到cDNA全长序列,长度1 466 bp(GenBank登录号为JX035934)。软件预测得出高原鼠兔HO-1基因编码区的核苷酸长度为873 bp,可编码290个氨基酸,见图2。

Figure 2.Nucleotide and deduced amino acid sequences of coding region of Ochotona curzoniae HO-1 gene.图2 高原鼠兔HO-1基因编码区的核苷酸序列及推导的氨基酸序列
3.2 序列相似性比较 将高原鼠兔与其它物种HO-1基因编码区及氨基酸序列进行相似性比较,结果表明HO-1基因在不同物种间显示出高度的保守性,这也证明了HO-1基因在各物种进化过程中仍然存在着重要的生物学联系,见表2、3。

表2 高原鼠兔与其它物种HO-1基因编码区及氨基酸序列相似性比较Table 2.Similarity comparison of HO-1 gene nucleotide and amino acid sequences between Ochotona curzoniae and other species
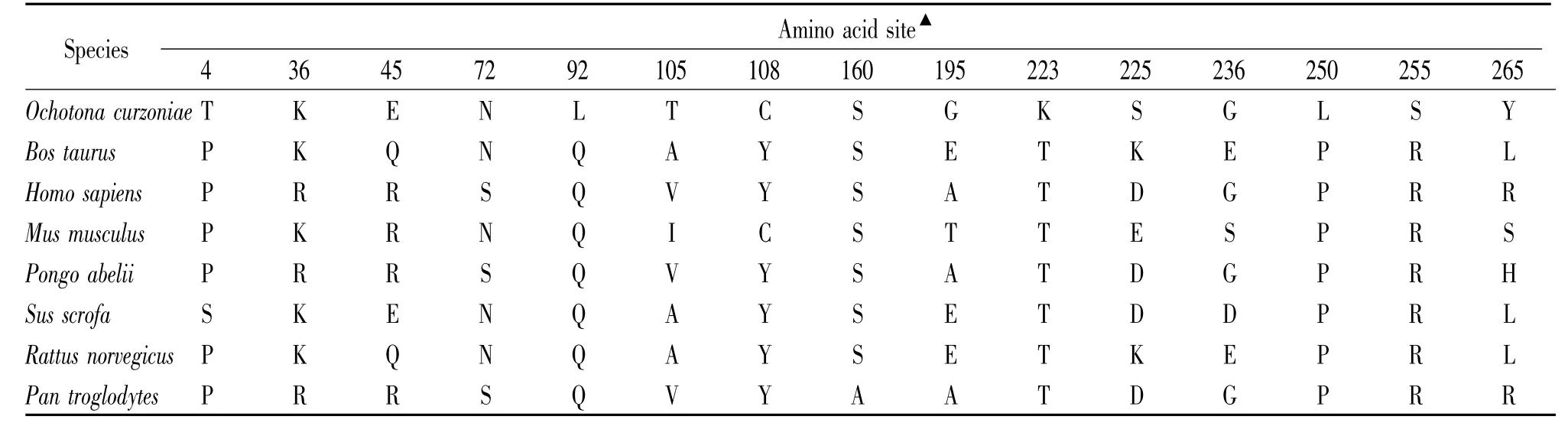
表3 高原鼠兔与其它物种间HO-1氨基酸位点的差异性分析Table 3.Difference analysis of the amino acid sites of HO-1 between Ochotona curzoniae and other species
3.3 系统进化树构建 进一步通过用MEGA 5.0建立的系统进化树可以看出,高原鼠兔与兔的遗传距离最近,见图3。

Figure 3.Phylongenetic tree based on amino sequence of HO-1 from Ochotona curzoniae and other species.The numbers above the branches are phylogenetic branch distance of HO-1 among different species.图3 以氨基酸序列为基础的高原鼠兔及其它物种的系统进化树
讨 论
近年来大量研究表明,HO-1及其降解血红素产生的代谢产物具有抗炎、抗凋亡、抗增殖、调节细胞周期、维持正常微循环血流、血管重构等效应[11],同时毕建立等[12]指出,HO-1能够抑制细胞毒性ROS,避免DNA的损伤,脂质过氧化提示HO-1能够产生对细胞的保护效应。而一些有限的HO-1缺陷的相关报道和HO-1缺陷的动物模型表现也证实了这一观点(HO-1缺陷出现了发育迟缓、组织铁沉积、贫血、淋巴结肿大、白细胞增多以及多氧化应激敏感性增强等特征表现)。HO-1提供细胞保护作用的机制尚未完全阐明,但目前可以肯定的是相关促炎因子的表达下调和抗炎因子的表达上调共同发挥着重要作用。
大量研究[13-15]发现,HO-1与许多肺疾病、心血管疾病和肝疾病有关,HO-1表达增加,缺氧性肺动脉高压、血管重建和炎症都将减弱;对于氧化损伤参与的疾病,HO-1在疾病的进程中对维持内环境的稳态发挥着主要作用。Yet等[16]指出,HO-1的高度表达能够对心肌组织缺血/再灌注损伤起积极的保护作用。HO-1产生的代谢产物胆红素与缺血性心肌功能损害的改善密切相关,产生的CO能够降低缺血损伤造成的死亡率。一些人类学研究进一步发现,提前诱导HO-1在一定程度上能够阻止氧化损伤,HO-1的抑制却能加重损伤。
本实验首次成功地获得高原鼠兔HO-1基因编码区的cDNA序列全长,基因序列分析结果显示,克隆得到由873 bp组成的开放阅读框可编码290个氨基酸。将该序列登录于 GenBank,登录号为JX035934。高原鼠兔HO-1基因的编码区序列与兔、人、牛、小鼠、大鼠、猪和马HO-1核苷酸序列的同源性分别为89%、87%、85%、79%、84%、85%和85%,氨基酸序列相似性分别达到89%、85%、84%、80%、79%、82%和67%,显示出高度保守性。在本研究进行的氨基酸差异性位点分析中,所比较物种的15个氨基酸差异性位点中有5个位点(第4、92、223、250和255位)可能导致各物种在调节HO-1与低氧相关因子相互作用方面产生差异,进而对高原低氧适应的调控造成重要影响。对比高原鼠兔与兔HO-1基因编码区的序列时,我们分析发现高原鼠兔HO-1基因中第9位密码子 TTG→ATG,第 67位密码子CAC→CGC,第87位密码子CCT→GCC,第194位密码子AGC→GGG,第285位密码子CTT→GTA;推导的氨基酸的序列也发生突变,即第9位的亮氨酸(Leu)突变为蛋氨酸(Met),第67位的组氨酸(His)突变为精氨酸(Arg),第87位的脯氨酸(Pro)突变为丙氨酸(Ala),第194位的丝氨酸(Ser)突变为甘氨酸(Gly),第285位的亮氨酸(Leu)突变为缬氨酸(Val)。从这一层面也反映出,与移居高原的同科物种比较,世居高原的鼠兔仍与其存在着结构、功能上的显著差异,这或许是高原鼠兔对高原遗传性适应的一种表现,也可能是其抗缺氧能力更强的原因之一,但是突变位点与高原适应相关联的具体机制仍有待于进一步研究。系统进化方面,进化树分析结果表明,高原鼠兔HO-1与其它动物的HO-1汇成一支,它们与高等动物的HO-1源自一个共同的根,拥有共同的祖先,但分别处于不同层次的进化分支上。高原鼠兔HO-1与兔子HO-1的上一级同属一个进化分支,亲缘关系最近,而与人、猪、牛等的遗传距离较远,这一结果与通常所认识的鼠兔属于兔形目(Lagomorpha)是一致的。
高原土生动物在长期的生存中无时无刻不在对抗着低氧损伤,同时经过连续的进化,逐渐形成自己独特的低氧适应及抗氧化应激损伤的机制,其本质就是在低氧高寒等条件下机体能够最大限度地从器官、组织直至分子、细胞、基因各个层面上发挥细胞保护功能,保证机体完成正常的生理功能和能量代谢。近年来,HO-1应激性细胞保护效应研究成为热点,因此,其结构和功能已成为高原低氧高寒等适应研究的重要内容[17]。
由于HO-1与细胞保护密切相关,为了更进一步地了解高原鼠兔保护细胞免受氧化应激损伤的机制,通过进一步对高原鼠兔适应高原低氧高寒相关基因的研究,对于今后更好地及早干预氧化损伤疾病的发展进程,治愈氧化损伤等引起的疾病具有重大的意义。
[1] 陈 琰,刘素刚,关 崧.血红素氧合酶1的结构和基因调控的研究进展[J].中国老年学杂志,2004,24(1):75-76.
[2] 黄晓颖,王良兴,陈绍先,等.血红素氧合酶1基因表达与慢性低氧高二氧化碳性肺动脉高压的关系[J].中国病理生理杂志,2001,17(9):870-874.
[3] 张宏伟,李元红.血红素氧合酶-1与心血管炎症的相关性研究[J].中国心脏起搏与心电生理杂志,2009,23(4):360-362.
[4] 姚海木.血红素氧合酶研究进展[J].河南医学研究,2003,12(2):183-185.
[5] Vulapalli SR,Chen Z,Chua BH,et al.Cardioselective over expression of HO-1 prevents I/R-induced cardiac dysfunction and apoptosis[J].Am J Physiol Heart Circ Physiol,2002,283(2):H688-H694.
[6] 李富忠,蒋和柱,陈 虹,等.野生种高原鼠兔的捕捉与饲养[J].现代预防医学,2005,32(12):1694-1695.
[7] 陈婷方,白振忠,侯 冰,等.青藏高原高原鼠兔肌红蛋白(MGB)基因编码区的克隆与分析[J].高原医学杂志,2005,15(4):4-7.
[8] 尚爱加,陈婷方,周定标,等.青藏高原高原鼠兔Na+,K+-ATP酶 β2亚基基因编码区的克隆与分析[J].生物技术通讯,2007,18(4):553-556.
[9] 王晓勤,王占刚,陈秋红,等.慢性缺氧大鼠肺血管结构与一氧化氮的变化[J].高原医学杂志,2001,11(2):5-8.
[10]朱世海,齐新章,王小军,等.高原鼢鼠和高原鼠兔骨骼肌摄氧功能差异研究[J].生理学报,2009,61(4):373-378.
[11]许小志,何 平.血红素加氧酶-1与氧化应激[J].中国当代儿科杂志,2009,11(8):706-709.
[12]毕建立,江朝光,周乃康.血红素氧合酶的抗损伤机制[J].中国体外循环杂志,2005,3(2):123-124.
[13]Yamada N,Yamaya M,Okingaga S,et al.Microsatellite polymorphism in the heme oxygenase-1 gene promoter is associated with susceptibility to emphysema[J].Am J Hum Genet,2000,66(1):187-195.
[14]汪红霞,黄维义,魏宗德.血红素氧合酶-1与心血管疾病的研究[J].国际内科学杂志,2007,34(1):6-9.
[15]李 伟,陆晓华,赵 雪,等.核黄素预处理减轻大鼠肝缺血再灌注损伤[J].中国病理生理杂志,2012,28(7):1314-1318.
[16] Yet SF,Tian R,Layne MD,et al.Cardiac-specific expression of heme oxygenase-1 protects against ischemia and reperfusion injury in transgenic mice [J].Circ Res,2001,89(2):168-173.
[17]曹学锋,杨应忠,马 兰,等.藏羚羊血红素氧合酶-1基因编码区的克隆及序列分析[J].中国病理生理杂志,2012,28(8):1461-1462.
