诱导人脐带MSCs分化为胰岛样细胞团的促成熟方案及机制*
2013-11-07苏仲春陈家劲陈志明王跃春
苏仲春, 陈家劲, 王 圳, 陈志明, 王跃春
间充质干细胞(mesenchymal stem cells,MSCs)是来源于中胚层的一类多功能干细胞,可以分化成具有外胚层、中胚层或内胚层特征的细胞[1-2]。大量研究表明人脐带间充质干细胞(mesenchymal stem cells derived from human umbilical cord,hUC-MSCs)能分化为成脂肪细胞、软骨细胞、成骨细胞、神经细胞以及心肌细胞等。有文献报道hUC-MSCs在一定条件下可分化为内胚层来源的胰岛素分泌细胞(insulin-producing cells,IPCs)并在一定程度上可缓解糖尿病模型动物的症状[3-5]。目前诱导干细胞向IPCs分化的方法主要有3种:外源生物化学制剂诱导法、转基因法和共培养法。Tang等[6]利用细胞因子诱导骨髓来源的干细胞(bone marrow-derived stem cells,BMDS cells)诱导向IPCs分化,虽然诱导6个月后检测到IPCs可以分泌较高水平胰岛素和C肽,但长期的体外培养导致BMDS自发转化为肿瘤细胞,因此如何在短时间内进行有效的诱导仍然是亟待解决的问题。Chiou等[7]将MafA基因转染到胎盘源性多能干细胞(placenta-derived multipotent stem cells,PDMSCs)中,发现MafA的过表达显著上调了胰岛发育相关基因的表达,同时有助于PDMSCs分化为胰岛素阳性细胞;但目的基因转染的稳定性不高,且转染基因的插入可能会影响细胞基因组的稳定性,从而引起基因突变。Talavera-Adame等[8]将胚胎干细胞(embryonic stem cells,ESCs)与内皮细胞共培养,发现共培养可以上调ESCs胰岛发育相关基因的表达,并检测到ESCs分泌胰岛素原,但该方法存在诱导效率不高且诱导细胞不够成熟等问题。
本实验室在研究中找到了一种用单纯生物化学制剂诱导hUC-MSCs向胰岛样细胞团(islet-like clusters,ILCs)分化的方案,这种方案的优点在于其安全、快速和高效;但液相色谱分析和化学发光检测都提示这种方案诱导的ILCs分泌的主要是胰岛素原(proinsulin,PI)。PI虽然也有降低血糖的作用,但效率不及真胰岛素(true insulin,TI)的 1/10[9]。从 PI向TI转化,是一个内源性蛋白分解和加工的过程,需要激素原转化酶(prohormone convertase,PC)1和PC2的介导[10],无论是缺乏 PC1或 PC2,都会使 TI合成受阻,导致TI分泌减少,所以检测hUC-MSCs诱导前后这两种关键酶的表达情况有助于确定其TI转换障碍的原因并采取相应措施以促进其转换,值得深入研究。因此,我们拟进一步通过生物化学制剂的不同组合寻找诱导hUC-MSCs向功能性ILCs分化的促成熟方案并探讨其机制。
材料和方法
1 材料和试剂
实验所用脐带均来自暨南大学第一附属医院妇产科健康产妇,胎儿无畸形,并征得产妇及家属的同意。主要试剂如下:DMEM/F12培养基、IMDM培养基、澳洲胎牛血清(fetal calf serum,FCS)和胶原酶Ⅱ购自 Gibco,RT-PCR试剂盒购自 TaKaRa,ReverTra Ace qPCR RT Kit购自Toyobo,引物和Trizol购自Invitrogen,PC1与PC2Ⅰ抗和Ⅱ抗购自Santa Cruz,表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自PeproTech,WesternBright ECL检测试剂盒购自Advansta,细胞裂解液购自北京百泰克生物技术有限公司,尼克酰胺、肝细胞生长因子(hepatocyte growth factor,HGF)、琼脂糖、二甲基亚砜、丙烯酰胺和甲叉双丙烯酰胺购自Sigma。
2 主要方法
2.1 hUC-MSCs的分离与纯化 选择足月剖宫产或自然产胎儿的脐带,约4~6 cm长,无菌条件下抽净脐带血,4℃保存,4 h内进行分离。在超净台中将脐带剪成1 cm小段,再纵向剪开,用PBS多次漂洗以去除血液;将脐带剪成肉糜状,移入50 mL离心管,加入10 mL经37℃预热的0.1%胶原酶Ⅱ,于37℃水浴摇床中振荡消化60 min,再加入0.25%胰蛋白酶10 mL继续振荡消化30 min,最后加入30 mL DMEM/F12,用滴管反复吹打,细胞筛过滤,滤液用500×g离心10 min,弃上清,将沉淀下来的细胞用含10%FBS的DMEM/F12按1×109/L的密度接种于T25培养瓶,在饱和湿度、37℃、5%CO2的培养箱中培养。次日首次换液,弃去未贴壁细胞,以后每2~3 d换液1次。当细胞达80%融合后,用0.25%胰酶不完全消化进行传代纯化,传代代数标记为P1、P2、P3等。P3之后用完全消化进行传代。
2.2 流式细胞术检测 将 P3的 hUC-MSCs用0.25%胰蛋白酶消化,PBS洗涤2次,制成1×106的细胞悬液,分为每管0.1 mL,设置阴性对照,加入鼠IgG-FITC,其它管各加入20 μL鼠抗人CD106-FITC、CD40-FITC、CD80-FITC、HLA-DR-FITC、CD45-FITC、CD34-FITC、CD29-FITC和CD44-FITC,在黑暗中孵化15 min。流式细胞仪计数5 000~10 000个细胞,用CellQuest软件分析。
2.3 免疫细胞荧光染色 将P3代的hUC-MSCs接种在已用多聚赖氨酸包被的玻片上生长,3 d后去除培养基再用0.1 mol/L PBS洗涤3次,4%多聚甲醛固定20 min后,用含0.5%Triton X-100的PBS作用15 min,再用含有10%正常山羊血清(normal goat serum,NGS)的PBS封闭1 h。紧接着用兔抗人nestinⅠ抗(1∶200稀释)4℃孵育过夜,再用含有荧光染料568羊抗兔Ⅱ抗(1∶200稀释)37℃孵育1 h,用含有DAPI的封片剂进行封片,最后用荧光显微镜观察和拍照。
2.4 体外诱导hUC-MSCs向ILCs分化 取P3代hUC-MSCs进行诱导。待hUC-MSCs达到80%以上融合时,用0.25%胰酶消化细胞,按1∶2的比例接种于25 cm2低黏附性培养瓶中。通过不同生物化学制剂组合,筛选出以下3种诱导方案进行比较。方案A:每瓶加5 mL诱导液 (IMDM培养液,含10 μg/L bFGF、10 μg/L EGF、10 mg/L 银杏提取液及 2%FCS),持续诱导8 d,每2 d换液1次。方案B:每瓶加5 mL诱导液 (IMDM培养液,含10 μg/L bFGF、10 μg/L EGF、10 mg/L银杏提取液及2%FCS),持续诱导4 d;第4 d在原诱导液加入10 μg/L尼克酰胺,再持续诱导4 d,每2 d换液1次。方案C:每瓶加5 mL诱导液 (IMDM 培养液,含 10 μg/L bFGF,10 μg/L EGF,10 mg/L银杏提取液及2%FCS),持续诱导4 d;第4 d在原诱导液加入10 μg/L尼克酰胺和10 μg/L HGF,再持续诱导4 d,每2 d换液1次。显微镜下观察。
2.5 RT-PCR 按照 Trizol说明书分别提取 P3、P6和P9代hUC-MSCs以及3种方案诱导后的ILCs的总RNA,UV分光光度计测定RNA浓度(g/L)并记录A260/A280正常范围1.8~2.0)。各组均用2.0 μg总RNA,按照 TaKaRa RT-PCR AMV 3.0 Kit说明书操作,合成cDNA,然后进行PCR,参数如下:94℃预变性2 min;94 ℃ 30 s,退火 30 s,72 ℃ 1 min,循环35次;72℃ 5 min。引物序列,退火温度和预期片段大小见表1。PCR产物在1.5%琼脂糖凝胶电泳,用Goldview核酸染料染色和紫外线透射拍摄。

表1 RT-PCR引物序列Table 1.Sequences of the primers for RT-PCR
2.6 qPCR 按上述方法提取3种方案诱导后的ILCs的总RNA,用ReverTra Ace qPCR RT Kit合成cDNA。PC1、PC2和β-actin的引物序列见表2。本实验采用比较Ct法的相对定量策略,首先要证实PC1、PC2和β-actin的扩增效率一致。将逆转录成的cDNA 进行倍比稀释:1、0.1、0.01、0.001和 0.0001并以此为模板,经KAPA SYBR FAST qPCR试剂盒来检测两者的扩增效率。以cDNA的log值作为横坐标,ΔCt(Ct目的基因-Ct管家基因)作为纵坐标,以得到直线的斜率是否接近于0来说明目的基因与管家基因的扩增效率是否一致。为了减少组间差异,每一标本均设3个复孔,在95℃变性1 min后,共进行45个循环扩增,每一循环包括95℃ 15 s,63℃ 25 s,72℃50 s,读板。随后,以0.17℃/s变化速度,从65~95℃每隔2 s记录1次荧光值,获得熔解曲线。观察扩增动力学曲线和熔解曲线,应用相对定量公式:2-ΔΔCt×100%,计算得出 PC1 和 PC2相对于 β-actin的量。
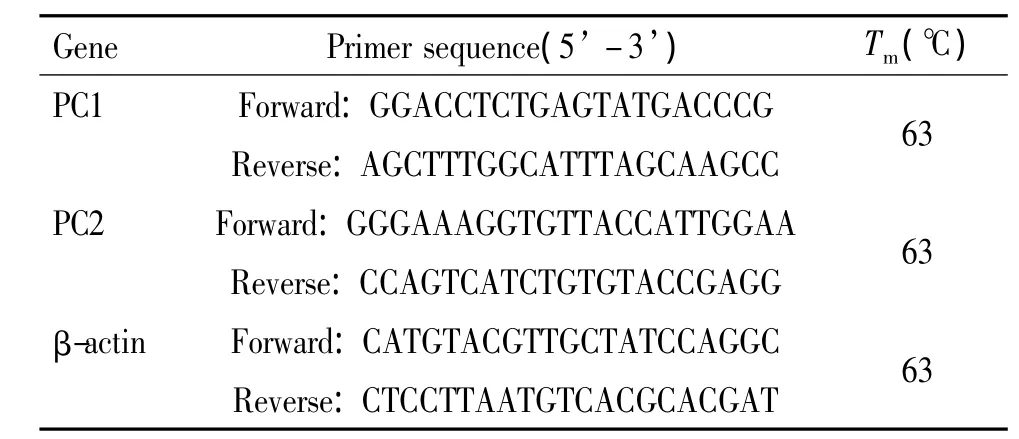
表2 qPCR引物序列Table 2.Sequences of the primers for qPCR
2.7 Western blotting 收集 3种方案诱导后的ILCs,用细胞裂解液进行裂解,提取细胞总蛋白,定量后用10%分离胶SDS-PAGE电泳,湿转参数为:恒流110 mA,转膜180 min;5%脱脂奶粉室温封闭1 h,4℃孵育Ⅰ抗封闭过夜,再室温孵育Ⅱ抗1 h。Ⅰ抗分别为兔抗人 β-actin(1∶2 000)、兔抗人 PC1(1∶2 000)和鼠抗人PC2(1∶2 000)。TBST洗涤,ECL显色,化学发光拍照,对图像进行灰度值分析。
3 统计学处理
应用SPSS 13.0软件对各组数据统计分析,数据用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 hUC-MSCs的分离和纯化
镜下观察原代接种24 h后可见大量细胞贴壁,细胞不均一,呈圆形、纤维样或内皮细胞样,有少数细胞形成漩涡状生长的集落,见图1A;经过不完全消化法逐渐纯化的P3 hUC-MSCs外观上比较均一,呈长梭型,排列规则,呈漩涡状生长,见图1B。
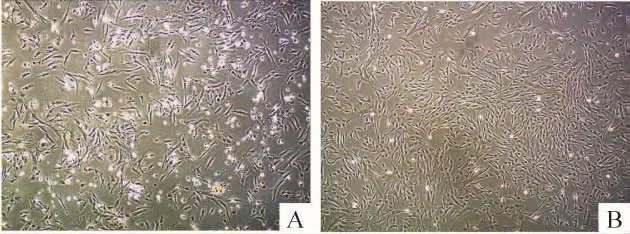
Figure 1.Morphology of hUC-MSCs(×40).A:primary hUCMSCs;B:passage 3.图1hUC-MSCs的形态
2 hUC-MSCs的鉴定
流式细胞术检测结果显示P3 hUC-MSCs强表达CD29和CD44,低表达内皮细胞的标志CD106,不表达造血细胞标志 CD34、CO40、CD45和 CD80,见图2A。RT-PCR结果表明P3、P6和P9的hUC-MSCs均可有干细胞标志物Oct4、Nanog和 nestin mRNA表达,见图2B。细胞免疫荧光染色则显示 P3 hUCMSCs中的nestin蛋白在胞浆中有普遍表达,见图2C。
3 hUC-MSCs诱导后的形态变化
P3 hUC-MSCs经过3种方案诱导后都有逐渐变圆并聚集成团的趋势,方案A中hUC-MSCs发生聚集,但成团现象不明显,有较多细胞悬浮,见图3A;方案B中则有ILCs出现,细胞悬浮的情况较轻,见图3B;方案C可诱导出更多的ILCs,见图3C。
4 hUC-MSCs诱导后胰岛发育相关基因的表达
4.1 RT-PCR结果 检测多种参与胰岛β细胞的发育相关基因在3种诱导方案的表达情况,发现方案A有葡萄糖转运子2(glucose transporter 2,Glut-2)和v-maf肌腱膜纤维肉瘤癌基因同源物A(v-maf musculoaponeuroticfibrosarcoma oncogene homologue A,MafA)mRNA表达;方案 B有 Glut-2、MafA、NK6转录因子相关基因座1(NK6 transcription factor-related,locus 1,Nkx6.1)和PC2 mRNA表达;方案C有Glut-2、MafA、Nkx6.1、PC2、神经元素 3(neurogenin 3,Ngn3)、胰腺十二指肠同源框蛋白1(pancreatic and duodenal homeobox protein 1,Pdx1)、PC1 和 insulin mRNA表达,可见A、B和C 3种方案诱导的ILCs呈逐渐成熟的趋势,见图4。
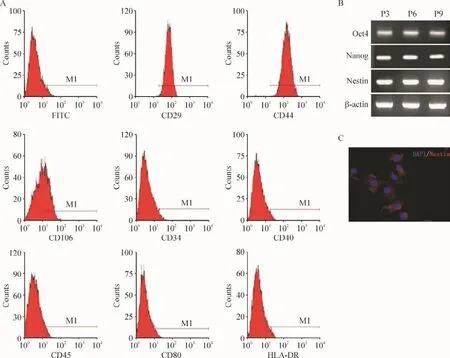
Figure 2.Identification of hUC-MSCs.A:cell surface markers tested by flow cytometry;B:stem cell-specific mRNA expression detected by RT-PCR;C:cytoplasmic expression of nestin detected by immunocytofluorescent staining(×400).图2hUC-MSCs的鉴定
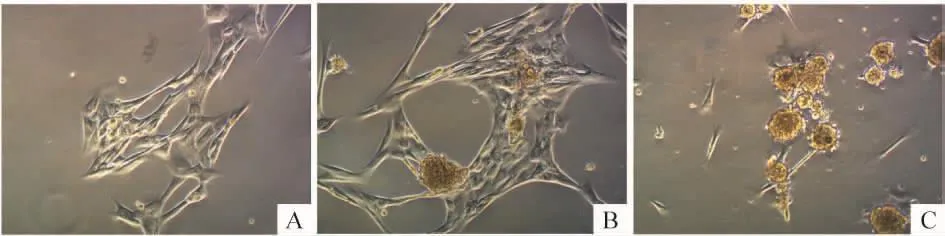
Figure 3.The morphological changes of hUC-MSCs after the induction by different protocols(×200).A:protocol A;B:protocol B;C:protocol C.图3 hUC-MSCs在3种方案诱导后的形态变化

Figure 4.RT-PCR results.1:pancreas;2:hUC-MSCs;3:protocol A;4:protocol B;5:protocol C.图4RT-PCR结果
4.2 qPCR结果 PC1和PC2 mRNA得到的直线斜率分别为0.068和0.082,都接近于0,说明PC1和PC2与 β-actin 的扩增效率一致,可用公式 2-ΔΔCt×100%进行结果分析。结果显示:PC1 mRNA在hUCMSCs、方案A与方案B诱导的ILCs中均无表达,方案C的2-ΔΔCt×100%=0.050 ±0.030;PC2 mRNA 在hUC-MSCs和方案A诱导的ILCs中无表达,在方案B和方案C的2-ΔΔCt×100%分别为1.000±0.113和1.944±0.355,且方案C诱导的细胞PC2 mRNA的表达量显著高于方案B(P<0.01),见图5。
5 hUC-MSCs诱导前后PC1、ProPC2和PC2蛋白的表达
PC1蛋白只在方案C中有表达(PC1/β-actin=0.126±0.011),ProPC2与PC2蛋白在方案 B和方案C中有表达(方案 B:ProPC2/β-actin=0.557±0.012,PC2/β-actin =0.427 ± 0.044;方 案 C:ProPC2/β-actin=0.894 ± 0.028, PC2/β-actin=0.704±0.028),且ProPC2与PC2蛋白在方案C中的表达均显著高于方案B(P<0.01),见图6。
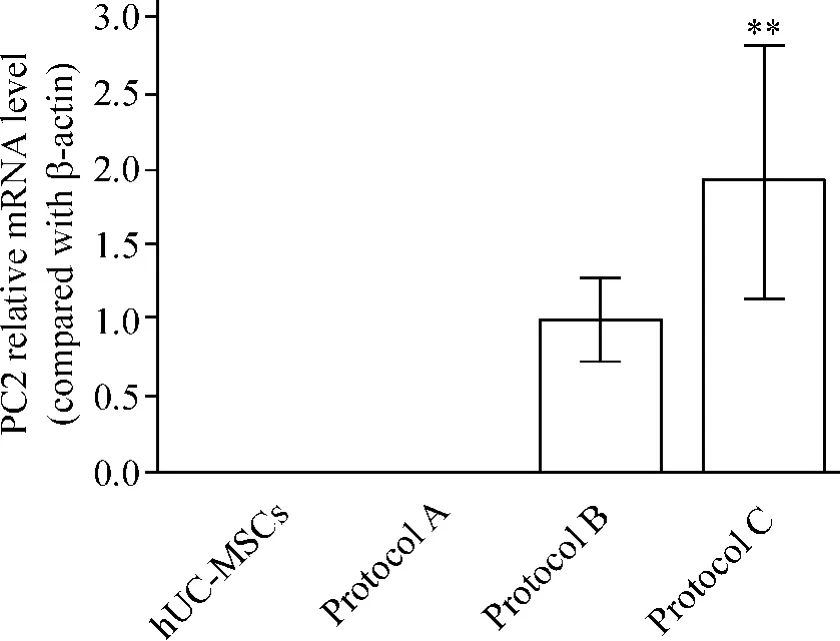
Figure 5.qPCR results of PC2 mRNA expression.Mean±SD.n=3.**P <0.01 vs protocol B.图5 qPCR结果
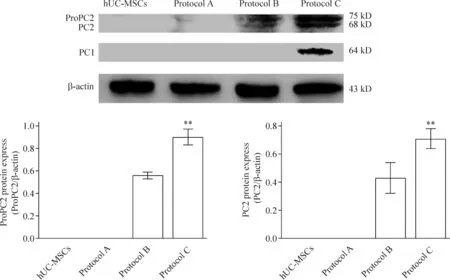
Figure 6.Western blotting results.Mean ± SD.n=3.**P <0.01 vs protocol B.图6 Western blotting结果
讨 论
已有大量文献报道了hUC-MSCs在来源广泛、操作简便、无伦理学争论、有免疫调节特性和可多向分化等方面的优势,本研究发现hUC-MSCs在诱导前能稳定表达干细胞特异标志物Oct4、Nanog和nestin,同时也微弱表达Isl1。Oct4和Nanog已被证明是维持干细胞的多能性和自我更新的转录因子[11]。Nestin属于第6类中间丝蛋白,主要表达于神经系统发育中的神经干细胞和祖细胞,可作为神经干细胞和祖细胞的特异性标记物;但从成人胰岛中分离出的胰岛前体细胞也表达nestin,这种nestin+细胞可分化为内分泌部与外分泌部的胰腺细胞[12];Zhang等[13]的实验证实了人胎儿胰腺nestin+前体细胞诱导分化来的胰腺内分泌细胞可下调糖尿病小鼠的血糖。Joanette等[14]的研究还表明胰腺内分泌细胞的发育与胰腺内的前体细胞nestin阳性率呈正相关关系,进一步强调了胰腺nestin+前体细胞在胰岛新生中的重要性。此外,ESCs本身不表达nestin,但在诱导ESCs向IPCs分化的研究中,多数诱导方法是将ESCs先诱导成nestin+细胞,再将nestin+细胞进一步诱导成IPCs。本实验中分离、纯化的hUC-MSCs本身就表达nestin,提示hUC-MSCs可越过先诱导成nestin+细胞的中间步骤而直接向IPCs分化。Isl1是一种胰岛发育早期表达的、能结合胰岛素基因上特异性增强子元件基因的转录因子[15],本实验中hUC-MSCs能轻微表达Isl1,可推测hUC-MSCs具有向胰腺干细胞或胰腺细胞分化的潜能。
体外研究表明,单纯生物化学制剂诱导干细胞向ILCs分化普遍存在分化效率低,ILCs不够成熟等问题,主要表现在ILCs分泌的PI异常升高,PI向TI转化存在障碍;由于PI的生理作用仅为胰岛素的1/10,因而ILCs能否分化成熟以分泌TI决定了干细胞能否有效治疗糖尿病。体内由PI转化为TI,必须有PC1、PC2等酶的参与,而这些酶又必须在严格的内环境条件下才能发挥其正常作用。本研究基于现有的研究条件,通过多次组合和不断筛选,发现无论在基因水平还是蛋白质水平,方案A基础上增加尼克酰胺(方案B)能诱导hUC-MSCs表达PC2,而在方案B基础上增加HGF(方案C)能够诱导hUC-MSCs表达PC1和上调PC2,表明了方案C更具有诱导hUCMSCs向功能性胰岛素分泌细胞分化的能力。尼克酰胺作为诱导剂已被应用于促进干细胞向胰岛β细胞分化,体内实验也证实了尼克酰胺的抗糖尿病作用,但具体机制尚不清楚[16]。在方案B中,加入尼克酰胺诱导,有PC2 mRNA表达,且具有促进不成熟的PC2蛋白向成熟转化的能力。PC2蛋白起初是以分子量为75 kD的ProPC2酶原形式存在,必须与一种专门的伴侣蛋白7B2结合才能成熟;故推测尼克酰胺可能具有促进 ProPC2与7B2结合的能力。HGF来源于肝细胞间质,可促进肝损伤后肝细胞的再生。研究发现HGF对体外培养的胎胰及成年胰岛均有很强的促有丝分裂及促胰岛素分泌作用[17];为了探讨局部HGF过度表达能否引起胰岛数量和功能的提高,研究人员构建了一种在RIP调控下过度表达HGF的小鼠模型,结果发现该小鼠的胰岛增大,β细胞数量增多,原因主要是由于HGF促进了细胞分化[18]。本实验中方案C与其它两种方案比较,在诱导PC1和PC2表达的优势上可见HGF在促进hUC-MSCs向ILCs分化成熟起一定作用。
本实验通过添加尼克酰胺和HGF等促进ILCs表达PC1和PC2,在一定程度上促进了ILCs的成熟,虽然在ILCs的培养上清液中检测到较高水平的免疫反应活性胰岛素,但C肽水平却很低。C肽为胰岛素原转化为胰岛素过程中的一个片段,生理情况下C肽与胰岛素以等物质的量从β细胞中分泌,所以各方案诱导的PC1和PC2尚不能满足PI向TI转化的要求。在体胰岛β细胞中胰岛素原的生物合成是由血糖刺激的,并且高血糖加速了PI向TI的转化[19];机体可以提供细胞进一步分化和成熟的三维空间和复杂的内环境,而诱导的细胞最终要移植到体内发挥作用,因此,下一步我们准备将经方案C诱导的初步成熟的ILCs移植到糖尿病模型体内作进一步研究。
[1] 李杏肖,李晓红,林秋雄,等.转染isl1基因促进骨髓间充质干细胞向心肌样细胞分化[J].中国病理生理杂志,2012,28(1):131-135.
[2] 王舒阳,韩 瑞,张广宇,等.Oct3/4在体外诱导大鼠骨髓间质干细胞神经分化中的作用[J].中国病理生理杂志,2012,28(3):385-392.
[3] Conconi MT,Burra P,Di Liddo R,et al.CD105(+)cells from Wharton’s jelly show in vitro and in vivo myogenic differentiative potential[J].Int J Mol Med,2006,18(6):1089-1096.
[4] Nishiyama N,Miyoshi S,Hida N,et al.The significant cardiomyogenic potential of human umbilical cord bloodderived mesenchymal stem cells in vitro[J].Stem Cells,2007,25(8):2017-2024.
[5] Karahuseyinoglu S,Cinar O,Kilic E,et al.Biology of stem cells in human umbilical cord stroma:in situ and in vitro surveys[J].Stem Cells,2007,25(2):319-331.
[6] Tang DQ,Wang Q,Burkhardt BR,et al.In vitro generation of functional insulin-producing cells from human bone marrow-derived stem cells,but long-term culture running risk of malignant transformation[J].Am J Stem Cells,2012,1(2):114-127.
[7] Chiou SH,Chen SJ,Chang YL,et al.MafA promotes the reprogramming of placenta-derived multipotent stem cells into pancreatic islets-like and insulin+cells[J].J Cell Mol Med,2011,15(3):612-624.
[8] Talavera-Adame D,Wu G,He Y,et al.Endothelial cells in co-culture enhance embryonic stem cell differentiation to pancreatic progenitors and insulin-producing cells through BMP signaling[J].Stem Cell Rev,2011,7(3):532-543.
[9] Malaguarnera R,Sacco A,Voci C,et al.Proinsulin binds with high affinity the insulin receptor isoform A and predominantly activates the mitogenic pathway[J].Endocrinology,2012,153(5):2152-2163.
[10] Borjesson A,Carlsson C.Altered proinsulin conversion in rat pancreatic islets exposed long-term to various glucose concentrations or interleukin-1beta[J].J Endocrinol,2007,192(2):381-387.
[11] LohYH,Wu Q,Chew JL,et al.The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells[J].Nat Genet,2006,38(4):431-440.
[12] Zulewski H,Abraham EJ,Gerlach MJ,et al.Multipotential nestin-positive stem cells isolated from adult pancreatic islets differentiate ex vivo into pancreatic endocrine,exocrine and hepatic phenotypes[J].Diabetes,2001,50(3):521-533.
[13] Zhang L,Hong TP,Hu J,et al.Nestin-positive progenitor cells isolated from human fetal pancreas have phenotypic markers identical to mesenchymal stem cells[J].World J Gastroenterol,2005,11(19):2906-2911.
[14] Joanette EA,Reusens B,Arany E,et al.Low-protein diet during early life causes a reduction in the frequency of cells immunopositive for nestin and CD34 in both pancreatic ducts and islets in the rat[J].Endocrinology,2004,145(6):3004-3013.
[15] Granata R,Settanni F,Gallo D,et al.Obestatin promotes survival of pancreatic beta-cells and human islets and induces expression of genes involved in the regulation of beta-cell mass and function [J].Diabetes,2008,57(4):967-979.
[16]Segev H,Fishman B,Ziskind A,et al.Differentiation of human embryonic stem cells into insulin-producing clusters[J].Stem Cells,2004,22(3):265-274.
[17] Wang R,Yashpal N,Bacchus F,et al.Hepatocyte growth factor regulates proliferation and differentiation of epithelial monolayers derived from islets of postnatal rat pancreas[J].J Endocrinol,2004,183(1):163-171.
[18] Garcia-Ocana A,Takane KK,Syed MA,et al.Hepatocyte growth factor overexpression in the islet of transgenic mice increases beta cell proliferation,enhances islet mass,and induces mild hypoglycemia[J].J Biol Chem,2000,275(2):1226-1232.
[19] Derosa G,Ragonesi PD,Carbone A,et al.Vildagliptin added to metformin on β-cell function after a euglycemic hyperinsulinemic and hyperglycemic clamp in type 2 diabetes patients[J].Diabetes Technol Ther,2012,14(6):475-484.
