SFRP5基因甲基化通过激活Wnt/β-catenin通路调节白血病细胞MDR1/P-gp的表达*
2013-11-07王慧涵李迎春赵成海廖爱军刘卓刚
王慧涵, 胡 荣, 李迎春, 赵成海, 杨 威, 廖爱军, 刘卓刚
分泌型卷曲相关蛋白5(secreted frizzled-related protein 5,SFRP5)是分泌型糖蛋白家族成员之一,结构上与Wnt信号通路的特异性受体卷曲蛋白(Fz)受体极为相似,具有同源的配体抑制区,通过竞争性抑制Fz受体从而抑制 Wnt的活动[1]。有研究显示在白血病细胞中存在SFRP5基因启动子区域甲基化,导致SFRP5蛋白表达缺失或下调[2],但这种SFRP5基因甲基化在白血病发生发展中的作用尚不明确。本文从白血病多药耐药的角度,研究SFRP5基因甲基化对白血病细胞多药耐药1(multidrug resistance 1,MDR1)基因及其编码的P-糖蛋白(P-glycoprotein,P-gp)表达的调节作用并探索其可能的信号通路。
材料和方法
1 材料
2011年6月至2011年12月,中国医科大学附属盛京医院血液科诊断(WHO诊断标准)的12例急性白血病患者(L1~L12)骨髓单个核细胞作为标本。12例患者的疾病类型为:急性淋巴细胞白血病2例(L1和 L9);急性髓系白血病 7 例(L3、L4、L6、L8、L10、L11和L12);慢性髓系白血病2例(L2和L5)。人白血病细胞系HL-60来自中国医科大学附属盛京医院血液科留存;人白血病细胞系KG1a来自中国医学科学院血液病研究所;人淋巴瘤白血病细胞系Raji和人白血病细胞系U937细胞来自上海复旦大学贾立军教授惠赠。
2 主要试剂
AxyPrep基因组DNA小量试剂盒及MethylCodeTMBisulfite Conversion Kit购自Invitrogen;Zymo-TagTMDNA Polymerase及EZ DNA Methylation-Gold Kit购自 Zymo Research;5-氮杂-2'-脱氧胞嘧啶(5-aza-2'-deoxycytidine,DAC)购自 Sigma;SYBR®Premix Ex TaqTM试剂盒、Tag DNA聚合酶和M-MLV逆转录酶均购自TaKaRa;非磷酸化β-catenin(nonphosphorylated β-catenin,NP-β-catenin)单抗、β-actin单抗和P-gp单抗购自Santa Cruz;引物由Invitrogen公司设计及合成,见表1。
3 主要方法
3.1 甲基化特异性PCR(methylation-specific PCR,MSP) 用AxyPrep基因组DNA小量试剂盒提取基因组 DNA。用 MethylCodeTMBisulfite Conversion Kit试剂盒对基因组DNA进行亚硫酸氢钠处理。以处理后的DNA为模板,MSP检测SFRP5基因甲基化。PCR扩增体系20 μL:其中修饰后的 DNA 20 ng,10 μmol/L 上、下游引物各 0.4 μL,2 × Reaction Buffer 10 μL,dNTP Mix 0.2 μL,ZymoTagTMDNA Polymerase(5 ×106U/L)0.16 μL,灭菌 ddH2O 加至总体积20 μL。PCR扩增条件:95℃ 10 min;94℃ 30 s,55℃ 30 s,72℃ 40 s,40个循环;72℃ 10 min。用2%琼脂糖凝胶电泳检测扩增产物。

表1 引物序列Table 1.Sequences of the primers
3.2 Western blotting 检测非磷酸 化 β-catenin、SFRP5及P-gp蛋白的表达 收集细胞,PBS洗2遍,每107个细胞加1 mL预冷的RIPA裂解液,混匀,冰上振荡30 min,4 ℃、12 000 r/min离心 30 min,收上清,BCA方法测蛋白浓度。取50 μg蛋白样品加入上样缓冲液,100℃煮沸5 min,用SDS-PAGE分离,将蛋白转移到硝酸纤维素滤膜上。将硝酸纤维素滤膜加入含有5%脱脂奶粉的封闭液中,4℃摇床孵育过夜,加入兔抗人非磷酸化β-catenin、兔抗人SFRP5及兔抗人P-gpⅠ抗,4℃摇床孵育过夜。除去Ⅰ抗,加入鼠抗兔Ⅱ抗,室温下摇床孵育2 h,除去Ⅱ抗。加显色剂,在X射线胶片曝光成像并分析。
3.3 RT-PCR检测MDR1 mRNA的表达 用Trizol提取细胞RNA,逆转录为cDNA。RT-PCR扩增体系25 μL:10 × Buffer 2.5 μL,dNTP(10 mmol/L)0.5 μL,cDNA 1 μL,上、下游引物(10 mmol/L)各 0.5 μL,Tag DNA 聚合酶 (5 × 106U/L)0.5 μL,灭菌ddH2O 19.5 μL。PCR 扩增条件:94 ℃ 5 min;94 ℃1 min,55℃ 30 s,72℃ 50 s,共30个循环;72℃ 10 min。扩增产物用1%琼脂糖凝胶电泳,分离目的条带和内参照。
3.4 Real-time PCR定量检测DAC处理前后MDR1 mRNA的表达 应用SYBR® Premix Ex TaqTM试剂盒。PCR扩增体系20 μL:SYBR® Premix Ex TaqTM(2 × )10.0 μL,上、下游引物(10 μmol/L)各 0.4 μL,ROX Reference Dye II(50 × )0.4 μL,cDNA 2.0 μL,灭菌 ddH2O 6.8 μL。PCR 扩增条件:95 ℃ 30 s,95℃ 5 s,60℃ 35 s,共40个循环。各组设立3个平行孔,反应结束后,设定阈值,软件输出CT值。
4 统计学处理
使用SPSS 13.0统计软件进行统计学处理,数据用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(ANOVA),两组之间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 SFRP5基因在白血病患者及白血病细胞系中的甲基化状态
在12例白血病患者(L1~L12)标本中有7例(L2、L4、L5、L6、L7、L8 和 L11)发生了 SFRP5 基因甲基化,其中L5和L6发生了SFRP5基因部分甲基化。4种白血病细胞系 HL-60、Raji、U937和 KG1a中SFRP5基因均发生甲基化,见图1。

Figure 1.SFRP5 gene promoter region methylation status detected by MSP.A:12 cases of leukemic patients;B:4 cell lines of leukemia.M:methylated;U:unmethylated.图1 MSP方法检测12例白血病患者标本及4种白血病细胞系中SFRP5基因甲基化状态
2 非磷酸化β-catenin在SFRP5基因甲基化白血病患者及细胞系中的表达
由于SFRP5表达下调可能导致 Wnt/β-catenin激活,我们检测存在SFRP5基因完全甲基化的患者标本(L2、L4、L7、L8和L11)及4种白血病细胞系中NP-β-catenin的表达状态。检测结果显示在5例SFRP5完全甲基化的患者标本中,有3例(L2、L7和L8)NP-β-catenin水平高于其它2例(P<0.05)。在4种白血病细胞系中,KG1a细胞中NP-β-catenin水平明显高于其它3种细胞(P<0.01),见图2。

Figure 2. Non-phosphorylated β-catenin(NP-β-catenin)expression in leukemic patients(A)and cell lines(B)with methylated SFRP5 gene was detected by Western blotting.Mean±SD.n=3.△△P <0.01 vs L4;#P <0.01 vs L11;**P <0.01 vs KG1a.图2 Western blotting检测非磷酸化β-catenin在白血病患者标本及细胞系中的表达
3 MDR1 mRNA在白血病患者及细胞系中的表达
采用RT-PCR检测MDR1 mRNA的表达情况,结果显示在白血病患者标本中,存在NP-β-catenin高水平表达的3例患者(L2、L7和L8)检出MDR1 mRNA表达。在4种细胞系中,KG1a细胞存在MDR1 mRNA表达,见图3。

Figure 3.MDR1 mRNA expression of leukemic patients and cell lines was detected by RT-PCR.A:12 cases of leukemic patients;B:4 cell lines of leukemia.图3 RT-PCR检测MDR1 mRNA在白血病患者和细胞系中的表达
4 P-gp在白血病患者及细胞系中的表达
Western blotting检测P-gp结果与MDR1 mRNA一致,即只在NP-β-catenin高水平表达的3例患者(L2、L7和L8)中检出P-gp表达。在4种细胞系中,KG1a细胞检出P-gp表达,见图4。

Figure 4.P-gp expression of leukemic patients and cell lines was detected by Western blotting.A:12 cases of leukemic patients;B:4 cell lines of leukemia.图4 Western blotting检测P-gp在白血病患者和细胞系中的表达
5 去甲基化试剂处理后标本和细胞系中MDR1/P-gp表达的变化
使用去甲基化试剂DAC 5 μmol/L处理P-gp阳性标本 L2、L7、L8 和 KG1a,处理时间 72 h,恢复SFRP5表达。Western blotting结果显示P-gp表达水平在SFRP5表达恢复后被下调。进一步使用realtime PCR检测MDR1 mRNA表达,结果显示DAC处理后MDR1 mRNA水平均显著下降(P<0.01),见图5。
讨 论
SFRP5是SFRPs家族的一个分泌型蛋白,大量的研究显示在多种肿瘤细胞中存在SFRP5基因启动子区甲基化,并导致蛋白表达的下降[3-4]。但是SFRP5基因启动子区甲基化及所引起的SFRP5蛋白表达缺失或下调在肿瘤中的作用尚不明确。
SFRP5作为 Wnt的抑制因子,主要通过抑制Wnt信号通路发挥作用。Wnt家族也属于分泌型糖蛋白,是重要的细胞外信号分子家族。大量研究揭示Wnt的异常激活与多种肿瘤的发生有关[5-7]。经典的Wnt信号通路通过转录激活因子β-catenin激活下游靶基因发挥作用,相关的靶基因有c-myc、CCND1、MMP-7和WISPI等,这些基因参与肿瘤的形成及发展[8-10]。Lim等[11]应用大鼠脑内皮细胞及人大脑内皮细胞系hCMEC/D3作为研究对象,发现应用GSK-3抑制剂激活β-catenin通路能够促进MDR1基因转录及P-gp蛋白表达,并伴随药物外排的增加。Flahaut等[12]报道了21例神经母细胞瘤的患者化疗后存在FZD1及MDR1的过表达。应用specific micro-adaptedshorthairpinRNA(shRNAmir)介导的FZD1基因沉默后,MDR1表达明显减少。这两项研究将Wnt/β-catenin信号通路与肿瘤的多药耐药联系在了一起,证明MDR1是β-catenin的又一个下游靶基因。但是关于Wnt的抑制因子SFRPs家族成员与MDR的关系尚无研究。
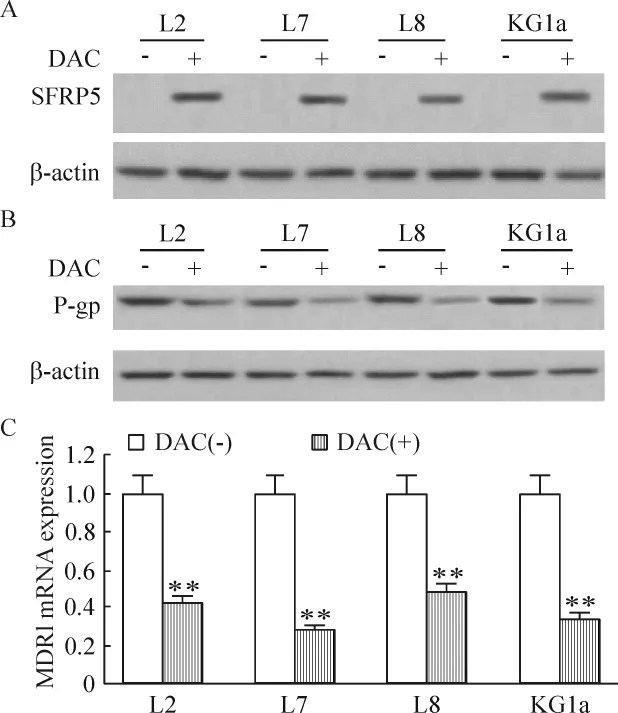
Figure 5.Effects of SFRP5 expression recovery by demethylation reagent DAC(5 μmol/L,72 h)on MDR1 mRNA and P-gp protein expression in P-gp positive specimens.A:SFRP5 expression detected by Western blotting;B:P-gp expression detected by Western blotting;C:MDR1 mRNA expression detected by real-time PCR.Mean±SD.n=3.**P <0.01 vs DAC(-).图5 DAC对P-gp阳性标本和细胞系中MDR1/P-gp表达的影响
Griffiths等[2]的研究提示SFRP5甲基化导致的SFRP5蛋白表达下降可能增加急性髓系白血病复发的风险。Su等[13]研究卵巢癌发现SFRP5甲基化状态与卵巢癌对顺铂的耐药有关,通过基因转染恢复SFRP5表达后减弱Wnt信号通路,能够抑制小鼠卵巢癌细胞生长、浸润及肿瘤形成。同时SFRP5恢复表达还能够抑制上皮-间充质转化(epithelial-mesenchymal transition,EMT),恢复 SFRP5表达能够下调Akt2,增加卵巢癌细胞对化疗的敏感性。这些研究提示了SFRP5在肿瘤复发及耐药中可能发挥作用。
为了验证SFRP5基因甲基化是否参与形成白血病MDR及其可能的信号通路,我们首先检测了SFRP5甲基化的5例患者标本及4种白血病细胞系中β-catenin的活化形式——NP-β-catenin的表达状态,结果显示有3例患者标本的NP-β-catenin水平高于其他2例。在4种白血病细胞系中,KG1a细胞中NP-β-catenin水平明显高于其它3种细胞系。接着发现存在NP-β-catenin高水平表达的3例患者检出MDR1 mRNA表达。在4种细胞系中,KG1a细胞存在MDR1 mRNA表达。蛋白水平的检测结果与mRNA水平一致,即只在NP-β-catenin高水平表达的标本中检出P-gp表达。这个结果初步验证了MDR1是β-catenin的下游靶基因,随着β-catenin的激活而转录增加。为了进一步验证这个结果,我们使用去甲基化试剂 DAC处理 P-gp阳性标本 L2、L7、L8和KG1a,以恢复SFRP5表达。结果显示在SFRP5表达恢复后P-gp表达水平被下调,MDR1 mRNA水平均亦显著下降(P<0.01)。
因此我们认为,SFRP5基因甲基化导致蛋白表达缺失对Wnt的抑制作用减弱,引起Wnt/β-catenin信号通路被激活,β-catenin下游靶基因MDR1转录增加,编码的药物外排泵P-gp表达增加,参与肿瘤多药耐药的形成。当然,SFRP5基因在某些白血病细胞中存在非甲基化状态,这些细胞的耐药性是否有所不同尚需进一步研究。本文的结论进一步完善了白血病细胞中SFRP5基因甲基化参与肿瘤形成发展的机制,并使SFRP5及其信号通路可能作为评估白血病预后的新指标及治疗多药耐药白血病的新靶点。
[1] Mii Y,Taira M.Secreted Wnt“inhibitors”are not just inhibitors:regulation of extracellular Wnt by secreted Frizzled-related proteins[J].Dev Growth Differ,2011,53(8):911-923.
[2] Griffiths EA,Gore SD,Hooker C,et al.Acute myeloid leukemia is characterized by Wnt pathway inhibitor promoter hypermethylation[J].Leuk Lymphoma,2010,51(9):1711-1719.
[3] Shin H,Kim JH,Lee YS,et al.Change in gene expression profiles of secreted frizzled-related proteins(SFRPs)by sodium butyrate in gastric cancers:Induction of promoter demethylation and histone modification causing inhibition of Wnt signaling[J].Int J Oncol,2012,40(5):1533-1542.
[4] 郭艳丽,郭 炜,邝 钢,等.食管鳞状细胞癌中SFRP基因家族启动子区甲基化状态的检测[J].中国病理生理杂志,2011,27(2):278-283.
[5] Yao H,Ashihara E,Maekawa T.Targeting the Wnt/βcatenin signaling pathway in human cancers[J].Expert Opin Ther Targets,2011,15(7):873-887.
[6] Wang Y,van der Zee M,Fodde R,et al.Wnt/β-catenin and sex hormone signaling in endometrial homeostasis and cancer[J].Oncotarget,2010,1(7):674-684.
[7] Verkaar F,Zaman GJ.New avenues to target Wnt/β-catenin signaling[J].Drug Discov Today,2011,16(1-2):35-41.
[8] Amado NG,Fonseca BF,Cerqueira DM,et al.Flavonoids:potential Wnt/β-catenin signaling modulators in cancer[J].Life Sci,2011,89(15-16):545-554.
[9] El Wakil A,Lalli E.The Wnt/β-catenin pathway in adrenocortical development and cancer[J].Mol Cell Endocrinol,2011,332(1-2):32-37.
[10] 李海英,张 力,潘欢乐,等.Wnt信号通路在食管癌细胞放射抗拒性形成中的作用[J].中国病理生理杂志,2012,28(9):1623-1326.
[11] Lim JC,Kania KD,Wijesuriya H,et al.Activation of βcatenin signalling by GSK-3 inhibition increases P-glycoprotein expression in brain endothelial cells[J].J Neurochem,2008,106(4):1855-1865.
[12] Flahaut M,Meier R,Coulon A,et al.The Wnt receptor FZD1 mediates chemoresistance in neuroblastoma through activation of the Wnt/β-catenin pathway[J].Oncogene,2009,28(23):2245-2256.
[13] Su HY,Lai HC,Lin YW,et al.Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway[J].Int J Cancer,2010,127(3):555-567.
