肺炎衣原体感染通过PI3K激活Rac1而诱导血管平滑肌细胞迁移*
2013-11-07张俊霞张腾腾张利军王蓓蓓魏俊燕王海伟沈炳玲张丽莙
张俊霞, 张腾腾, 张利军, 王蓓蓓, 魏俊燕, 王海伟, 沈炳玲, 张丽莙
动脉粥样硬化(atherosclerosis,AS)引发的心脑血管疾病是目前人类死亡的首要原因,严重威胁人类健康。自Ross提出“AS是一种慢性炎症性疾病”[1]以来,感染性因素,尤其是肺炎衣原体(Chlamydia pneumoniae,C.pn)感染与AS的关系倍受关注[2-3]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)由动脉壁中膜向内膜迁移是AS发病过程中的关键环节之一。研究表明,C.pn感染可以通过多种途径诱导细胞迁移[4-5]。Rac1是小G蛋白Rho家族成员,其通过GTP结合的有活性形式和GDP结合的无活性形式循环调节多种信号转导途径,在肌动蛋白细胞骨架重组、细胞迁移中发挥重要作用[6-7]。磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)是具有催化活性的胞内信号蛋白,在细胞迁移等多种信号转导中发挥重要作用[8-9],且与Rac1关系密切[10]。我们前期研究发现C.pn感染通过激活PI3K及其信号途径促进内皮细胞、VSMCs迁移[11-12]。C.pn感染是否能诱导VSMCs内Rac1活化并通过其调控VSMCs迁移,以及在此过程中PI3K是否对Rac1的活化发挥调节作用,目前尚不清楚。本研究以Rac1为着眼点,采用GST-pull down实验观察C.pn感染VSMCs后Rac1活性的变化,并使用PI3K特异性抑制剂进一步探讨PI3K对C.pn感染诱导VSMCs内Rac1活化的调节作用,为阐明C.pn感染诱导VSMCs迁移的相关分子机制及有效防治AS提供新思路。
材料和方法
1 材料
SD大鼠主动脉原代VSMCs为本课题组分离、培养并鉴定[13];C.pn AR-39 株 (美国标准菌库,ATCC53592);DMEM细胞培养基(Gibco);胎牛血清(fetal bovine serum,FBS;Gibco);DEAE(Sigma);Glutathione Sepharose 4B(GE Heathcare);GST-PBD重组质粒为本实验室保存;感受态细菌E.coli BL21(北京全式金生物技术有限公司);异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)(Prommega);小鼠抗大鼠 Rac1抗体(BD);小鼠抗大鼠βactin抗体(北京中杉金桥生物技术有限公司);辣根过氧化物酶标记的羊抗小鼠IgG(Jackson);Rac1抑制剂NSC23766(Merck);PI3K抑制剂LY294002(Prommega);BCA蛋白定量试剂盒(江苏碧云天生物技术研究所);ECL发光液(江苏碧云天生物技术研究所);蛋白酶抑制剂(Thermo);羟基脲(Sigma);Transwell小室(Corning)。
2 方法
2.1 VSMCs的培养和实验分组 VSMCs用含10%FBS的DMEM在37℃、5%CO2恒温孵箱中培养,细胞生长至90%单层融合后,0.25%胰蛋白酶消化液消化传代,选择生长良好的3~8代细胞用于实验。实验分组如下:正常对照组、C.pn感染组、NSC23766组、NSC23766 +C.pn感染组、LY294002组和LY294002 + C.pn感染组。NSC23766组和NSC23766 + C.pn感染组、LY294002组 和LY294002+C.pn感染组的 VSMCs分别用 50 μmol/L NSC23766、25 μmol/L LY294002 37 ℃孵育1 h进行预处理。同时,迁移实验中使用羟基脲0.8 mmol/L预处理细胞12 h,消除细胞增殖对迁移实验结果的影响。
2.2 GST-PBD融合蛋白的表达及纯化 用成功构建的GST-PBD质粒转化感受态细菌E.coli BL21,按1∶1 000的比例接种于5 mL LB培养基中,37℃、150 r/min振荡培养至对数期(600 nm吸光度值为0.4~0.6)。挑取对数期细菌,按照1∶5 000的比例接种入100 mL LB培养基中培养过夜。次日加入IPTG(0.1 mmol/L),28℃、130 r/min诱导蛋白表达3 h。4℃2 800 r/min离心30 min收集菌体,细菌裂解液(1%Triton X-100,1×PBS)重悬菌体沉淀,超声裂解。4℃、13 000 r/min离心10 min,取上清,每1 mL上清液加入50 μL Glutathione Sepharose 4B,4℃ 孵育过夜,1×PBS洗涤4次,置4℃备用。
2.3 GST-pull down实验检测VSMCs Rac1的活性
按照王蓓蓓等[13]的方法,在HEp-2细胞中增殖培养C.pn并感染VSMCs。感染24 h后,用含蛋白酶抑制剂的裂解液于冰上裂解细胞30 min,细胞刮刀刮取细胞,4℃ 12 000 r/min离心10 min,取上清,用BCA蛋白定量试剂盒进行蛋白定量。取1.0 mg相应体积的蛋白样品与孵育后的Glutathione Sepharose 4B混合,4℃过夜。次日4℃、1 000 r/min离心5 min,同样条件洗涤4次,微量加样器吸干EP管内剩余液体,加入40 μL 1×上样缓冲液,煮沸10 min。随后,行12%SDS-PAGE并转印于PVDF膜。特异性抗体孵育检测目标蛋白,ECL发光液显影、定影后拍照,并用ImageJ软件进行条带灰度分析。
2.4 Wound-healing实验 将VSMCs接种至6孔板,90%融合后,同步化处理12 h,加入0.8 mmol/L羟基脲作用12 h,用无菌移液管尖在培养板单层细胞的相同位置划直线,造成“伤口”,PBS洗去脱落细胞。NSC23766预处理VSMCs 1 h后,接种感染复数(multiplicity of infection,MOI)为0.5 的 C.pn 并孵育24 h,显微镜下观察VSMCs从划痕处向中央爬行的面积,其面积大小表示VSMCs迁移能力强弱,每孔随机取6个视野进行观察并拍摄,应用图像分析软件ImageJ测量细胞迁移面积,计算平均值,行3次独立实验。
2.5 Transwell实验 将 VSMCs接种至6孔板,90%融合后,同步化处理12 h,加入0.8 mmol/L羟基脲作用12 h,NSC23766预处理VSMCs 1 h后,将MOI为0.5的C.pn悬液接种于VSMCs,感染16 h后制备细胞浓度为1.5×108/L的VSMCs悬液,取100 μL细胞悬液加入 Transwell上室中,下室加入含50%FBS的DMEM,8 h后室温下甲醇固定,结晶紫染色。倒置相差显微镜下每个小室随机选取6个视野进行拍摄,记录每个视野的穿膜细胞数,取平均值,行3次独立实验。
3 统计学处理
采用SPSS 16.0统计软件进行分析,数据以均数±标准差(mean±SD)表示,3组以上样本均数比较采用单因素方差分析,均数间两两比较采用q检验,以P<0.05为差异有统计学意义。
结 果
1 GST-PBD融合蛋白的诱导与纯化
使用GST-PBD重组质粒转化感受态细菌E.coli BL21,LB培养基中扩增,并通过IPTG诱导GST-PBD融合蛋白的表达,随后用Glutathione Sepharose 4B富集纯化。为了保证GST-PBD与GTP-Rac1的特异性结合,纯化表达GST-PBD蛋白的同时表达GST空载体。为鉴定并检测纯化蛋白的质量及浓度,将纯化得到的GST和GST-PBD蛋白经SDS-PAGE后考马斯亮蓝染色,见图1,纯化得到的融合蛋白分子量正确,且浓度达到实验要求。

Figure 1.The purification of glutathione S-transferase(GST)-p21-binding domain of p21-activated kinase 1(PBD)(GST-PBD)fusion protein.M:protein marker;1:GST vector;2:GST-PBD fusion protein图1 纯化的GST-PBD融合蛋白
2 C.pn感染VSMCs前后Rac1活性的变化
VSMCs经C.pn感染24 h后提取总蛋白,并与经过鉴定达到实验要求的纯化融合蛋白孵育,GST-pull down实验检测C.pn感染前后GTP-Rac1变化;同时以GST空载体作为阴性对照。结果显示,C.pn感染组GTP-Rac1表达水平显著上调(P<0.05),且GST-PBD融合蛋白与GTP-Rac1特异性结合,此结果可真实反映细胞内Rac1的活化水平,见图2。

Figure 2.The C.pn infection-induced Rac1 activation detected by GST-pull down assay.1:control group;2:C.pn infection group;3:GST incubation with cell lyses.Mean ± SD.n=4.*P <0.05 vs control group.图2 C.pn感染诱导VSMCs Rac1的活化
3 C.pn感染诱导PI3K依赖的Rac1活性上调
我们前期研究结果显示PI3K/Akt在C.pn感染诱导的VSMCs迁移中发挥重要作用[11]。为证实PI3K在C.pn感染诱导的VSMCs Rac1活化中的作用,我们使用LY294002预处理VSMCs,进而采用GST-pull down实验检测GTP-Rac1的表达水平。结果显示,LY294002+C.pn感染组GTP-Rac1表达明显低于 C.pn感染组,差异有统计学意义(P<0.05)。各组之间总Rac1的表达量无明显差别,见图3。
4 Rac1活化在C.pn感染诱导的VSMCs迁移中的作用
C.pn感染 VSMCs 24 h后,wound-healing实验中,C.pn感染组VSMCs向划痕中央迁移的面积明显大于正常对照组(P<0.05),NSC23766预处理后VSMCs的Rac1活性被抑制,NSC23766+C.pn感染组VSMCs向划痕中央迁移的面积显著小于C.pn感染组(P <0.05),见图 4;Transwell实验中,C.pn感染组穿膜的VSMCs数明显高于正常对照组(P<0.05),而 NSC23766+C.pn 感染组 VSMCs的穿膜数明显低于 C.pn感染组(P <0.05),见图5。

Figure 3.The role of PI3K in Rac1 activation in C.pn-infected VSMCs detected by GST-pull down assay.1:control group;2:C.pn infection group;3:LY294002 group;4:LY294002+C.pn infection group.Mean ±SD.n=4.*P <0.05 vs control group;#P <0.05 vs C.pn infection group.图3 PI3K在C.pn感染诱导的VSMCs Rac1活化中的作用

Figure 4.The role of Rac1 activation in C.pn infection-induced migration of VSMCs detected by wound-healing assay.1:control group;2:C.pn infection group;3:NSC23766 group;4:NSC23766+C.pn infection group.Mean ± SD.n=6.*P <0.05 vs control group;#P <0.05 vs C.pn infection group.图4 Wound-healing实验检测Rac1在C.pn感染诱导VSMCs迁移中的作用
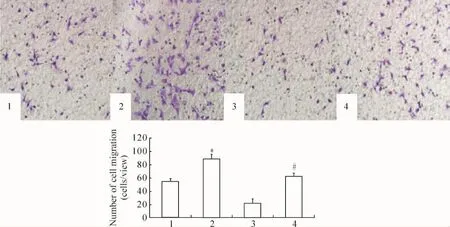
Figure 5.The role of Rac1 activation in C.pn infection-induced migration of VSMCs detected by Transwell assay.1:control group;2:C.pn infection group;3:NSC23766 group;4:NSC23766+C.pn infection group.Mean ± SD.n=6.*P <0.05 vs control group;#P <0.05 vs C.pn infection group.图5 Transwell实验检测Rac1在C.pn感染诱导VSMCs迁移中的作用
讨 论
近年来,C.pn感染作为AS新的危险因素日益受到关注。C.pn是一种严格细胞内寄生菌,经呼吸道侵入机体后感染其寄居部位(肺泡)的单核细胞[14]并以单核-巨噬细胞为载体经血行迁移至动脉壁,可感染内皮细胞、VSMCs及巨噬细胞等AS相关细胞[15],参与AS的发生发展。本课题组前期已成功建立C.pn感染内皮细胞、VSMCs的模型,为进一步研究其致病机制奠定了基础。VSMCs由血管壁中膜迁向内膜在AS形成及进展中发挥重要作用。研究表明,C.pn感染可通过炎症介质及细胞因子的释放影响细胞迁移[4-5]。但是,C.pn感染 VSMCs后是否能通过增强VSMCs的内在动力系统来促进其迁移,目前鲜有报道。
细胞迁移与免疫监视、伤口愈合、AS、炎症反应、肿瘤转移等多种生理、病理过程相关,是一个紧密协调的过程。其中,“leading edge”处的质膜突起或片状伪足的延伸是细胞迁移的主要驱动力。研究表明,片状伪足的形成是由Rac1介导的[6-7]。C.pn感染又与Rac1关系密切,C.pn感染的单核细胞GTPRac1表达增加[16]。那么,C.pn感染 VSMCs后能否引起Rac1的活性变化,目前尚不清楚。为此,我们使用成功构建的GST-PBD质粒转化感受态细菌,扩增并诱导表达GST-PBD融合蛋白,特异性地与GTPRac1结合以检测细胞内Rac1的活性。实验结果显示C.pn感染后VSMCs Rac1的活性明显高于正常对照组。Gouëffic等[17]研究显示透明质酸可通过激活Rac1诱导VSMCs片状伪足形成进而促使细胞迁移。为了明确Rac1的活化在C.pn感染诱导的VSMCs迁移中的作用,我们使用 Rac1特异性抑制剂NSC23766(50 μmol/L)预处理 VSMCs,采用 woundhealing实验和Transwell实验观察VSMCs迁移能力的变化。实验结果显示,预处理组C.pn感染诱导的细胞迁移能力明显低于单纯C.pn感染组。Rac1抑制剂NSC23766通过与Rac1的鸟嘌呤核苷酸交换因子Trio和Tiom相互作用干扰Rac1的磷酸化,并不影响Rac1的表达水平。相关文献[18]及我们的预实验结果显示NSC23766(50 μmol/L)预处理可有效抑制Rac1的活化。这提示C.pn感染可能通过激活Rac1促进VSMCs迁移。
Rac1作为细胞信号转导中的分子开关,通过与GTP/GDP结合形式之间的转换,接受外部刺激并作用于细胞骨架或其靶蛋白,发挥生物学效应[7]。PI3K作为具有催化活性的胞内信号蛋白,在多种类型细胞迁移过程中发挥调控作用[8-9]。文献[16]报道,透明质酸诱导的Rac1活化依赖PI3K的活性。PI3K-Rac1信号通路在IL-8引起的内皮细胞迁移中也发挥重要作用[19]。我们前期研究发现PI3K/Akt在C.pn感染诱导的 VSMCs迁移中发挥重要作用[11],PI3K 抑制剂 LY294002(25 μmol/L)可有效抑制C.pn感染诱导的细胞迁移。为进一步探讨C.pn感染的VSMCs中PI3K对Rac1活化的影响,我们使用LY294002预处理VSMCs,GST-pull down实验检测Rac1活性的变化。实验结果显示,与C.pn感染组相比,预处理组VSMCs GTP-Rac1表达明显降低,这提示在C.pn感染诱导的VSMCs迁移中Rac1的活化是PI3K依赖性的。有文献也报道,PI3K抑制条件下,胰岛素诱导的Rac1上调及质膜突起的形成受到抑制[20]。PI3K对Rac1活性的影响可能通过其与Rac1的鸟嘌呤核苷酸交换因子相互作用来实现[21]。
研究表明,活化的Rac1可以与IQGAP1相互作用并激活Arp2/3复合物、APC促进肌动蛋白聚合及细胞迁移[22]。Tang 等[23]报道胸腺素 β4通过增强IQGAP1/Rac1信号通路诱导结肠癌细胞迁移及临床转移。我们研究也发现IQGAP1可调控C.pn感染诱导的VSMCs黏附和迁移[24]。然而,在 C.pn感染诱导的VSMCs迁移过程中,Rac1与IQGAP1之间的相互关系目前尚不明确,有待于进一步研究。
综上所述,PI3K依赖的Rac1活化在C.pn感染诱导的VSMCs迁移中发挥重要作用,这一结果将为进一步阐明C.pn感染诱导VSMCs迁移的分子机制以及寻找抑制VSMCs迁移和有效治疗AS的途径提供新思路。
[1] Ross R.Atherosclerosis:an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[2] Campbell LA,Yaraei K,Van Lenten B,et al.The acute phase reactantresponse to respiratory infection with Chlamydia pneumoniae:implications for the pathogenesis of atherosclerosis[J].Microbes Infect,2010,12(8-9):598-606.
[3] Zhao X,Bu DX,Hayfron K,et al.A combination of secondhand cigarette smoke and Chlamydia pneumoniae accelerates atherosclerosis[J].Atherosclerosis,2012,222(1):59-66.
[4] Högdahl M,Söderlund G,Kihlström E,et al.Expression of chemokines and adhesion molecules in human coronary artery endothelial cells infected with Chlamydia(Chlamydophila)pneumoniae[J].APMIS,2008,116(12):1082-1088.
[5] MacIntyre A, Abramov R, Hammond CJ, etal.Chlamydia pneumoniae infection promotes the transmigration of monocytes through human brain endothelial cells[J].J Neurosci Res,2003,71(5):740-750.
[6] Ridley AJ.Rho GTPases and actin dynamics in membrane protrusions and vesicle trafficking[J].Trends Cell Biol,2006,16(10):522-529.
[7] Sit ST,Manser E.Rho GTPases and their role in organizing the actin cytoskeleton[J].J Cell Sci,2011,124(5):679-683.
[8] Cain RJ,Ridley AJ.Phosphoinositide 3-kinases in cell migration[J].Biol Cell,2009,101(1):13-29.
[9] Welf ES,Ahmed S,Johnson HE,et al.Migrating fibroblasts reorient directionality by a metastable,PI3K-dependent mechanism[J].J Cell Biol,2012,197(1):105-114.
[10] Dawes AT,Edelstein-Keshet L.Phosphoinositides and Rho proteins spatially regulate actin polymerization to initiate and maintain directed movement in a one-dimensional model of a motile cell[J].Biophys J,2007,92(3):744-768.
[11]张腾腾,张利军,王蓓蓓,等.PI3K/Akt在肺炎衣原体感染诱导的血管平滑肌细胞迁移中的作用[J].中国动脉硬化杂志,2012,20(3):207-211.
[12]权 伟,张利军,陈 宁,等.肺炎衣原体感染通过PI3K通路诱导人血管内皮细胞迁移[J].中国病理生理杂志,2010,26(7):1290-1294.
[13]王蓓蓓,张利军,权 伟,等.肺炎衣原体感染对血管平滑肌细胞黏附和迁移的影响[J].中国病理生理杂志,2010,26(12):2289-2294.
[14] Gieffers J,Van Zandbergen G,Rupp J,et al.Phagocytes transmit Chlamydia pneumoniae from the lungs to the vasculature[J].Eur Respir J,2004,23(4):506-510.
[15] Gaydos CA,Summersgill JT,Sahney NN,et al.Replication of Chlamydia pneumoniae in vitro in human macrophages,endothelial cells,and aortic artery smooth muscle cells[J].Infect Immun,1996,64(5):1614-1620.
[16] Eitel J,Meixenberger K,van Laak C,et al.Rac1 regulates the NLRP3 inflammasome which mediates IL-1beta production in Chlamydophila pneumoniae infected human mononuclear cells[J].Plos One,2012,7(1):e30379.
[17] Gouëffic Y,Guilluy C,Guérin P,et al.Hyaluronan induces vascular smooth muscle cell migration through RHAMM-mediated PI3K-dependent Rac activation[J].Cardiovasc Res,2006,72(2):339-348.
[18] Akunuru S,Palumbo J,Zhai QJ,et al.Rac1 targeting suppresses human non-small cell lung adenocarcinoma cancer stem cell activity[J].PLoS One,2011,6(2):e16951.
[19]Lai Y,Shen Y,Liu XH,et al.Interleukin-8 induces the endothelial cell migration through the activation of phosphoinositide 3-kinase-Rac1/RhoA pathway[J].Int J Biol Sci,2011,7(6):782-791.
[20] Kotani K,Hara K,Kotani K,et al.Phosphoinositide 3-kinase as an upstream regulator of the small GTP-binding protein Rac in the insulin signaling of membrane ruffling[J].Biochem Biophys Res Commun,1995,208(3):985-990.
[21] Innocenti M, Frittoli E, Ponzanelli I, etal. Phosphoinositide 3-kinase activates Rac by entering in a complex with Eps8,Abi1,and Sos-1[J].J Cell Biol,2003,160(1):17-23.
[22] Watanabe T,Wang S,Noritake J,et al.Interaction with IQGAPI links APC to Racl,Cdc42,and actin filaments during cell polarization and migration[J].Dev Cell,2004,7(6):871-883.
[23] Tang MC,Chan LC,Yeh YC,et al.Thymosin beta 4 induces colon cancer cell migration and clinical metastasis viaenhancingILK/IQGAP1/Rac1 signaltransduction pathway[J].Cancer Lett,2011,308(2):162-171.
[24] Zhang L, LiX, Zhang L, etal. Chlamydophila(Chlamydia)pneumoniae infection promotes vascular smooth muscle cell adhesion and migration through IQ domain GTPase-activating protein 1[J].Microb Pathog,2012,53(5-6):207-213.
