类风湿关节炎滑膜血管内皮细胞中Smoothened的表达及其意义*
2013-11-07朱尚玲彭蔚湘罗敏琪王明霞林灼锋黄建林
朱尚玲, 彭蔚湘, 罗敏琪, 王明霞, 林灼锋, 黄建林,
类风湿关节炎(rheumatoid arthritis,RA)是以累及周围关节为主要临床表现的多系统慢性炎症性自身免疫性疾病。其发病机制尚未完全明了,主要病理改变为慢性滑膜炎。新生的微血管形成在滑膜炎症发展过程中具有非常重要的作用[1]。目前的研究认为微血管内皮细胞的凋亡受抑可能加速滑膜微血管的增生[2]。
在人类,Hedgehog(Hh)信号通路配体包括Shh(Sonic Hedgehog)、Ihh(Indian Hedgehog)和 Dhh(Desert Hedgehog),其中Shh表达最为广泛。Shh与12次跨膜蛋白Patched(Ptch)结合,激活7次跨膜蛋白Smoothened(Smo),导致核转录因子Glioblastoma(Gli)蛋白水解被抑制,从而激活目标基因的转录[3]。其中,Smo的激活可导致下游基因的稳定和活化[4]。
近期的研究表明Shh可抑制血清饥饿诱导的内皮细胞的凋亡,但其是否依赖Smo起作用仍存在争议。Polizio等[5]通过血清饥饿的方法诱导脐静脉内皮细胞凋亡,认为Shh参与的内皮细胞抗凋亡机制是依赖 Ptch,而不依赖于 Smo的非经典途径。Walshe等[6]发现Shh对无血清诱导的牛视网膜微血管周细胞和内皮细胞凋亡有保护作用,Smo特异性抑制剂cyclopamine可促进细胞凋亡。我们前期的研究表明[7],RA患者外周血单个核细胞和滑膜组织(包含内皮细胞)中存在Shh信号通路的激活。作为Shh信号通路的关键分子,Smo是否参与了肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)作用于内皮细胞后的抗凋亡调控机制,从而参与RA滑膜血管过度增生,尚未见相关报道。本文对此问题进行初步探讨,现报道如下。
材料和方法
1 试剂与材料
人脐静脉内皮细胞系EA.hy926购自中国科学院上海细胞库。胎牛血清和DMEM培养液购自Hyclone。SmoⅠ抗购自Abcam,Ⅱ抗购自 Dako。重组人TNF-α购自 Prospec-Tany,放线菌素 D(actinomycin D,ActD)为Sigma进口分装产品。细胞计数试剂盒(Cell Counting Kit-8,CCK-8)为日本同仁化学研究所产品。凋亡检测试剂盒(Annexin V/Dead Cell Apoptosis Kit)购自Invitrogen。人Smo-siRNA、荧光标记siRNA及阴性对照siRNA双链由上海吉玛公司合成,X-tremeGENE siRNA转染试剂购自Roche。
2 方法
2.1 免疫组织化学检测关节滑膜组织Smo蛋白表达 收集4例我院关节外科病情中度活动(DAS28≥3.2)行关节置换术RA患者的滑膜组织,同时收集4例外伤或半月板损伤(无关节炎)者滑膜组织作为对照。滑膜组织用4%多聚甲醛固定,石蜡包埋。包埋的组织切为4 μm厚度,经脱蜡,0.3%H2O2阻断内源性过氧化酶活性10 min,微波炉抗原热修复处理。10%山羊血清室温封闭。滴加SmoⅠ抗,4℃过夜,PBS洗3次。滴加Ⅱ抗,室温湿盒孵育40 min。PBS洗3次。DAB显色后,苏木素复染,脱水,透明,中性树胶封片。胞膜出现棕黄色颗粒为阳性表达。
2.2 EA.hy926 细胞培养 EA.hy926 细胞接种于25 cm2培养瓶中,培养液为含10%胎牛血清的DMEM,置于37℃、含5%CO2的细胞培养箱中培养,细胞生长到80%融合时用于实验。
2.3 Western blotting检测 EA.hy926细胞 Smo蛋白表达 EA.hy926细胞以7×107/L密度接种于6孔板,每孔 2 mL。24 h后,予不同浓度 TNF-α(12.5 μg/L、25 μg/L、50 μg/L 和 100 μg/L)处理,同时设去离子水溶剂对照组。24 h后收集细胞并进行蛋白定量,各组取等量蛋白质加入上样缓冲液,混匀后100℃水浴变性5 min。8%SDS-PAGE电泳,湿法转膜。TBST缓冲液洗膜,5%脱脂奶粉封闭。加入兔抗人Smo多克隆抗体,4℃孵育过夜,TBST洗膜后,置于Ⅱ抗中室温缓摇1 h。TBST洗膜,暗室操作曝光底片。采用Quantity One软件进行扫描定量,取目的蛋白条带吸光度值(A/mm2)与GAPDH蛋白吸光度值(A/mm2)的比值来表示蛋白的相对定量。
2.4 EA.hy926细胞转染体外合成的特异性SmosiRNA EA.hy926细胞以7×107/L密度接种于6孔板。24 h后转染荧光标记siRNA、Smo-siRNA或阴性对照siRNA,对照组只加转染试剂。siRNA终浓度为20 nmol/L。6 h后荧光显微镜观察siRNA转染效率。或培养至48 h收集细胞并提取总蛋白。按上述方法进行Western blotting操作,检测Smo蛋白的表达。
2.5 CCK-8法检测细胞存活率 待EA.hy926细胞进入对数增长期,以3.5×107/L密度接种于96孔板。按以上方法进行转染。转染24 h后,按以下分组进行处理:(1)空白对照组;(2)TNF-α/ActD组;(3)处理组:TNF-α/ActD+转染 Smo-siRNA;(4)阴性对照组:TNF-α/ActD+转染阴性对照siRNA(NC-siRNA);(5)转染试剂对照组:TNF-α/ActD+转染试剂;(6)siRNA 对照组:TNF-α/ActD+siRNA。TNF-α终浓度为 12.5 μg/L,ActD 终浓度为 62.5 μg/L。培养24 h后,加入CCK-8液10 μL,避光孵育2 h,使用分光光度计在450 nm波长处检测吸光度值(absorbance,A),根据公式:细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%,计算细胞存活率。
2.6 流式细胞术检测细胞凋亡 EA.hy926细胞以5×107/L密度接种于6孔板。按以上方法进行转染和处理。转染24 h后,加入TNF-α(终浓度为12.5 μg/L)和 ActD(终浓度为62.5 μg/L)。分组同 2.5。48 h后收集细胞,预冷PBS洗涤2次,细胞重悬至100 mL 1×结合缓冲液中,分别加入AlexaFluorR 488 Annexin V 5 μL 和 PI工作液(100 mg/L)1 μL,室温避光染色15 min后,加入400 μL 1×结合缓冲液,轻柔混匀后置于冰上。使用FACScan Flow Cytometer检测细胞的凋亡情况。
3 统计学处理
数据统计分析使用SPSS 17.0统计软件。细胞存活率和凋亡率采用均数±标准差(mean±SD)表示。数据服从正态分布,根据方差齐性检验,多个样本均数比较采用One-way ANOVA分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 免疫组化检测滑膜组织Smo蛋白表达
滑膜组织Smo蛋白表达结果见图1,与对照组相比,RA组滑膜组织Smo表达强度明显增加,且在血管内皮细胞中表达差异尤为显著。
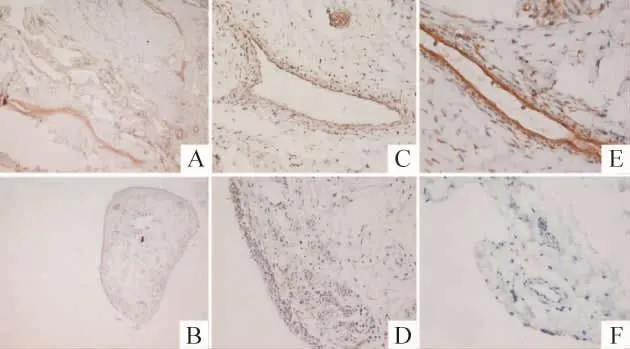
Figure 1.Expression of Smo protein in synovial tissue from RA patients detected by immunohistochemical staining.A,B:×40;C,D:×200;E,F:×400.A,C,E:RA group;B,D,F:control group.图1 免疫组织化学检测RA患者滑膜组织Smo的表达
2 Western blotting检测TNF-α作用后Smo蛋白表达
TNF-α作用于EA.hy926细胞24 h后Smo蛋白表达条带和灰度值分析结果见图2。不同浓度TNF-α作用后,Smo蛋白表达增加,差异有统计学意义(P <0.05)。
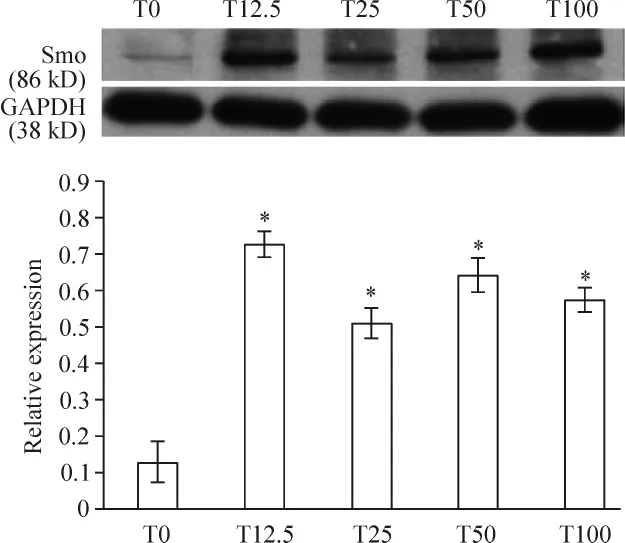
Figure 2.Effects of different concentrations of TNF-α on expression of Smo protein in EA.hy926 cells.T0:TNF-α 0 μg/L;T12.5:TNF-α 12.5 μg/L;T25:TNF-α 25 μg/L;T50:TNF-α 50 μg/L;T100:TNF-α 100 μg/L.Mean±SD.n=3.*P <0.05 vs T0 group.图2 不同浓度TNF-α对Smo蛋白表达的影响
3 siRNA转染EA.hy926细胞的转染效率及基因沉默效果
转染效率的检测结果见图3。转染荧光标记的siRNA 6 h,转染效率达95%以上。正常情况下EA.hy926细胞呈梭形或多角形贴壁生长,见图3A。转染siRNA后细胞形态发生变化,部分细胞变圆并脱落,见图3B、C。转染外源性siRNA对细胞的形态和活力有一定影响。蛋白表达见图4,与对照组相比,转染Smo-siRNA 48 h后蛋白表达明显降低,NC-siRNA对Smo蛋白表达无明显影响。

Figure 3.Transfection efficiency of siRNA in EA.hy926 cells detected by fluorescence microscopy(×100).A:control;B:transfected with FITC-conjugated control siRNA for 6 h,under fluorescence microscope;C:transfected with FITC-conjugated control siRNA for 6 h,under normal microscope.图3 荧光显微镜观察EA.hy926细胞转染效率
4 CCK-8法检测细胞存活率
TNF-α/ActD组细胞存活率低于空白组(P<0.05)。TNF-α/ActD+转染Smo-siRNA组细胞存活率低于TNF-α/ActD+转染NC-siRNA组,差异有统计学意义(P<0.05)。TNF-α/ActD+转染试剂和TNF-α/ActD+siRNA组细胞存活率与 TNF-α/ActD组相比,差异无统计学意义(P>0.05),见表1。

Figure 4.Expression of Smo protein in EA.hy926 cells after siRNA transfection.Smo-siRNA:transfected with Smo-siRNA for 48 h;NC-siRNA:transfected with negative control siRNA for 48 h.图4 EA.hy926细胞转染siRNA后Smo蛋白的表达
5 流式细胞术检测细胞凋亡率
TNF-α/ActD组细胞凋亡率高于空白组(P<0.05)。TNF-α/ActD+转染Smo-siRNA组细胞凋亡率高于TNF-α/ActD+转染NC-siRNA组凋亡率(P<0.05)。TNF-α/ActD+转染试剂和 TNF-α/ActD+siRNA组细胞凋亡率与TNF-α/ActD组相比,差异无统计学意义(P>0.05),见图5和表2。
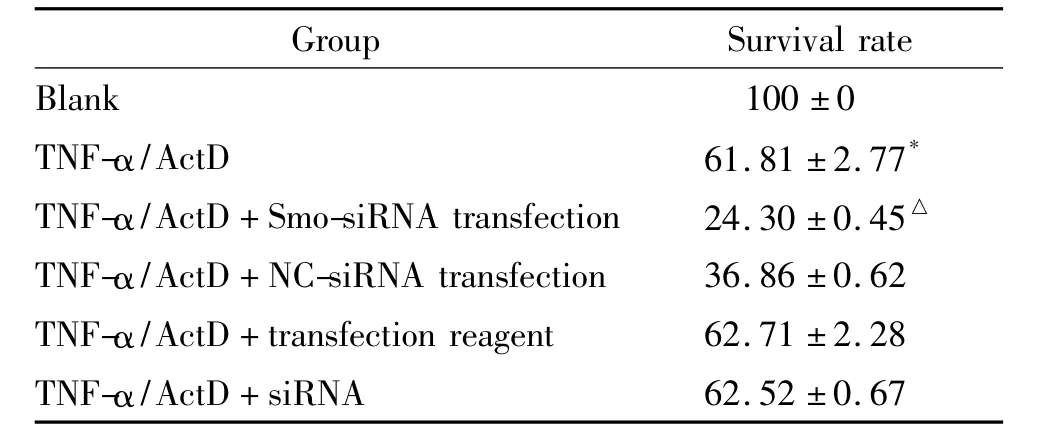
表1 EA.hy926转染siRNA后的细胞存活率Table 1.Survival rates of EA.hy926 cells after siRNA transfection(%.Mean±SD.n=3)
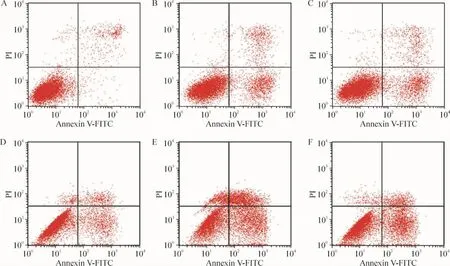
Figure 5.Apoptotic rates of EA.hy926 cells examined by flow cytometry.A:blank;B:TNF-α/ActD;C:TNF-α/ActD+Smo-siRNA;D:TNF-α /ActD+transfection reagent;E:TNF-α /ActD+Smo-siRNA transfection;F:TNF-α /ActD+negative control(NC)siRNA transfection.图5 流式细胞术检测细胞凋亡率
讨 论
在正常情况下,Shh信号通路在成人中的表达大为减少[8]。Hh信号通路的异常激活不仅为多种肿瘤的生长所必需,也与肿瘤的复发和侵袭有关[9]。Hh信号通路的激活存在配体依存性和非配体依存性[10],配体依存性激活是指配体如Shh与受体Ptch1结合,从而引起Shh信号通路的异常激活;非配体依存性激活时指Hh信号通路的成员,如Ptch或Smo突变而触发Hh信号通路异常的激活。研究表明Smo的过度表达可激活Shh信号通路,从而促进肿瘤的生长[11]。此外,Smo基因突变可导致基底细胞癌的发生[12]。而 Smo的特异性抑制剂 vismodegib(GDC-0449)在治疗晚期基底细胞癌患者的1期临床试验中达到58%的应答率[13]。近期在基底细胞母斑综合征患者中进行的随机双盲多中心安慰剂对照的临床试验结果表明,vismodegib可减轻肿瘤负荷,并减少新发肿瘤,阻止肿瘤的进展[14]。因此,Smo在肿瘤的发病中发挥重要的作用,并且是肿瘤的一个新的治疗靶点。但Shh信号通路是否在类风湿关节炎发病中起作用仍不清楚。
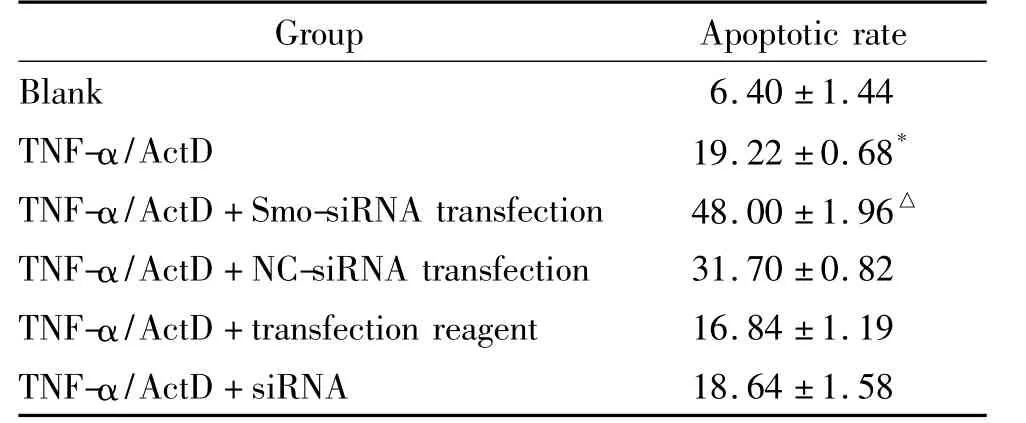
表2 EA.hy926转染siRNA后的细胞凋亡率Table 2.Apoptotic rates of EA.hy926 cells after siRNA transfection(%.Mean±SD.n=3)
本研究通过免疫组化的方法检测RA患者滑膜组织血管内皮细胞中Smo的表达情况,结果显示与对照组相比,RA组存在Smo的高表达,提示Smo可能参与RA的发病。因滑膜组织中主要为新生的微血管,相互交织成网状,较难获得内皮细胞并进行体外培养,故本研究采用人脐静脉内皮细胞系EA.hy926作为此血管内皮细胞模型,初步探讨Smo的表达情况及其意义。
多种炎症细胞和炎症因子参与RA慢性滑膜炎的产生。TNF-α在促炎细胞因子中占据主导地位[15]。Kasperczyk 等[16]对肿瘤细胞的研究证实,TNF-α可通过激活核转录因子(NF-κB)刺激Shh启动子的活性。NF-κB激活可增加Shh mRNA和蛋白表达,由此促进细胞增殖和抵抗TRAIL诱导的细胞凋亡,从而促进肿瘤的生长。Ramirez等[17]的研究也提示Hh信号通路与磷酸肌醇3激酶(PI3K)和NF-κB通路存在交叉,且认为这些通路可能促进Hh在弥漫性大B细胞淋巴瘤中的异常激活。因此,本实验采用TNF-α单独作用于 EA.hy926细胞,并观察TNF-α对细胞Smo蛋白表达的影响。本实验结果提示正常情况下,EA.hy926细胞存在Smo的表达。经不同浓度 TNF-α刺激后,Smo蛋白表达上调。但TNF-α是否通过激活NF-κB通路,进而激活Shh信号通路并上调Smo蛋白的表达,有待进一步研究。
以往的研究认为TNF-α对内皮细胞凋亡并无明显影响[18],可能与TNF-α可同时激活凋亡和抗凋亡途径有关。一般认为,TNF-α诱导细胞凋亡通过激活已经存在于胞内的蛋白,不需要新基因的表达。抗凋亡途径则需要新的抗凋亡基因表达和蛋白的合成。因此,采用TNF-α与抑制RNA合成的ActD共同作用可诱导内皮细胞凋亡[18]。故本实验采用TNF-α联合ActD诱导EA.hy926细胞凋亡,并进一步观察特异性抑制Smo表达对细胞存活和凋亡的影响。本研究采用 ActD的浓度为62.5 μg/L,预实验发现其单独作用24 h并不明显诱导内皮细胞凋亡。TNF-α和ActD共同作用于内皮细胞,细胞存活率低于溶剂对照组,细胞凋亡率高于溶剂对照组,说明TNF-α和ActD共同作用可诱导细胞凋亡。本实验采用RNAi技术干扰细胞Smo表达,结果提示转染人Smo-siRNA双链后,细胞表达Smo明显降低,沉默效果较好。并应用CCK-8法和流式细胞术分别观察此处理因素对经 TNF-α/ActD诱导的EA.hy926细胞存活和凋亡的影响。CCK-8结果显示,沉默Smo的表达可明显降低细胞存活率。流式细胞术结果也表明,转染人Smo-siRNA后细胞凋亡率明显高于转染阴性对照siRNA。而转染试剂或siRNA单独作用对细胞的存活和凋亡无明显影响。因此,我们的结果提示沉默 EA.hy926细胞Smo表达可促进 TNF-α/ActD诱导的细胞凋亡。
目前认为内皮细胞存在2条凋亡途径,外源性途径通过与细胞表面特异性死亡受体结合而启动,内源性途径起始于线粒体[18]。TNF-α可通过与TNF-α受体1结合和激活caspase-8诱导外源性凋亡途径的发生。而血清饥饿可激活线粒体的凋亡途径[19]。朱萍等[20]认为血清中存在的细胞因子,通过细胞中表达水平不同的代谢型谷氨酸受体,调节受体介导的胞外信号调节激酶(ERK)、蛋白激酶B(PKB/Akt)等信号通路,从而调控细胞生长与凋亡。Polizio等[5]的研究提示对于血清饥饿诱导的内皮细胞凋亡,Shh参与的抗凋亡调控机制是依赖Ptch,而不依赖于Smo的途径。而本实验研究发现Smo可能参与TNF-α作用于内皮细胞后的抗凋亡调控机制,我们推测Shh信号参与的抗凋亡调控机制可能与不同的刺激有关,不同刺激可能通过不同途径诱导凋亡。
总之,本研究发现RA患者滑膜组织血管内皮细胞高表达Smo,Smo可能对TNF-α诱导的内皮细胞外源性凋亡有保护作用,从而促使滑膜血管新生,但其具体机制仍有待进一步研究。同时,本实验也表明,从Smo阻断Shh信号通路,可能成为RA治疗的新靶点。
[1] Szekanecz Z,Koch AE.Angiogenesis and its targeting in rheumatoid arthritis[J].Vasc Pharmacol,2009,51(1):1-7.
[2] Hida A,Kawakami A,Miyashita T,et al.Nitric oxide acts on the mitochondria and protects human endothelial cells from apoptosis[J].J Lab Clin Med,2004,144(3):148-155.
[3] Chari NS,McDonnell TJ.The sonic hedgehog signaling network in development and neoplasia[J].Adv Anat Pathol,2007,14(5):344-352.
[4] Jiang J,Hui CC.Hedgehog signaling in development and cancer[J].Dev Cell,2008,15(6):801-812.
[5] Polizio AH,Chinchilla P,Chen X,et al.Sonic Hedgehog activates the GTPases Rac1 and RhoA in a Gli-independent manner through coupling of smoothened to Giproteins[J].Sci Signal,2011,4(200):pt7.
[6] Walshe TE,Connell P,Cryan L,et al.Microvascular retinal endothelial and pericyte cell apoptosis in vitro:role of hedgehog and Notch signaling[J].Invest Ophthalmol Vis Sci,2011,52(7):4472-4483.
[7] 王明霞,黄建林,朱尚玲,等.类风湿关节炎患者外周血单个核细胞Sonic Hedgehog信号通路表达的初步研究[J].中国病理生理杂志,2012,28(3):483-487.
[8] Rominger CM,Bee WL,Copeland RA,et al.Evidence for allosteric interactions of antagonist binding to the smoothened receptor[J].J Pharmacol Exp Ther,2009,329(3):995-1005.
[9] Stecca B,Ruiz I Altaba A.Context-dependent regulation of the GLI code in cancer by HEDGEHOG and non-HEDGEHOG signals[J].J Mol Cell Biol,2010,2(2):84-95.
[10] Berman DM,Karhadkar SS,Maitra A,et al.Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours[J].Nature,2003,425(6960):846-851.
[11]Walter K,Omura N,Hong SM,et al.Overexpression of Smoothened activates the Sonic Hedgehog signaling pathway in pancreatic cancer-associated fibroblasts[J].Clin Cancer Res,2010,16(6):1781-1789.
[12] Xie J,Murone M,Luoh SM,et al.Activating Smoothened mutations in sporadic basal-cell carcinoma[J].Nature,1998,391(6662):90-92.
[13] Sekulic A,Migden MR,Oro AE,et al.Efficacy and safety of vismodegib in advanced basal-cell carcinoma[J].N Engl J Med,2012,366(23):2171-2179.
[14]Tang JY,Mackay-Wiggan JM,Aszterbaum M,et al.Inhibiting the hedgehog pathway in patients with the basalcell nevus syndrome[J].N Engl J Med,2012,366(23):2180-2188.
[15]Taylor PC,Feldmann M.Anti-TNF biologic agents:still the therapy of choice for rheumatoid arthritis[J].Nat Rev Rheumatol,2009,5(10):578-582.
[16]Kasperczyk H,Baumann B,Debatin KM,et al.Characterization of sonic hedgehog as a novel NF-κB target gene that promotes NF-κB-mediated apoptosis resistance and tumor growth in vivo[J].FASEB J,2009,23(1):21-33.
[17] Ramirez E,Singh RR,Kunkalla K,et al.Defining causative factors contributing in the activation of hedgehog signaling in diffuse large B-cell lymphoma[J].Leuk Res,2012,36(10):1267-1273.
[18] Duriez PJ,Wong F,Dorovini-Zis K,et al.A1 functions at the mitochondria to delay endothelial apoptosis in response to tumor necrosis factor[J].J Biol Chem,2000,275(24):18099-18107.
[19] Lu Q.Transforming growth factor-β1 protects against pulmonary artery endothelial cell apoptosis via ALK5[J].Am J Physiol Lung Cell Mol Physiol,2008,295(1):L123-L133.
[20]朱 萍,冯 吉,杨荟敏,等.血清通过调节mGluR1介导的信号通路调控细胞的生长与凋亡[J].中国生物化学与分子生物学报,2010,26(4):332-340.
