SNS-032诱导弥漫性大B淋巴瘤OCI-LY-19细胞株凋亡及其作用机制的研究*
2013-11-07师宪平蓝晓莹温创宇刘焕亮黄美近
师宪平, 蓝晓莹, 温创宇, 陈 鑫, 刘焕亮, 黄美近
非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是目前发病率增长最快的恶性肿瘤,其中弥漫性大B淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常见的NHL。DLBCL是大B型淋巴细胞弥漫性恶性增生性疾病,在最近的10~20年间发病率逐渐增加。DLBCL在西方国家占成人非霍奇金淋巴瘤30%~40%,在发展中国家高达60%。按照肿瘤细胞来源和临床表现DLBCL分为生发中心B细胞样弥漫性大B细胞淋巴瘤(germinal center B cell-like diffuse large B-cell lymphoma,GCB-DLBCL)、活化性B细胞样弥漫性大B细胞淋巴瘤(activated B celllike diffuse large B-cell lymphoma,ABC-DLBCL)和原发性纵膈B细胞淋巴瘤(primary mediastinal B-cell lymphoma,PMBL)3型。迄今,利妥昔单抗联合CHOP方案(rituximab plus CHOP,R-CHOP;利妥昔单抗联合环磷酰胺、阿霉素、长春新碱和强的松)被国际上公认为治疗侵袭性NHL的经典疗法,在治疗低度恶性NHL特别是GCB型DLBCL取得了良好的效果。然而在用药过程中产生了极大的耐药复发问题及并发症(支气管痉挛、心律失常、肝功能衰竭、呼吸困难等),严重影响了治疗效果[1],迫切需要筛选出作用机制各异的有效化合物治疗DLBCL。
SNS-032(BMS-387032)是一种新型的氨噻唑化合物,因其对细胞周期蛋白依赖性蛋白激酶(cyclindependent kinase,CDK)的活性具有抑制作用,最初被定义为 CDK2、7、9 的抑制剂[2]。已有报道证明SNS-032可用于多种肿瘤,如急性粒细胞性白血病(acute myelogenous leukemia,AML)[3]、慢性淋巴性白血病(chronic lymphocytic leukemia,CLL)[4]、多发性骨髓瘤(multiple myeloma,MM)、结肠癌、非小细胞肺癌(non-small cell lung cancer,NSCLC)等[5-6]的治疗,目前该化合物已处于CLL、MM及其转移性难治性实体瘤的I期临床试验阶段。本研究以GCB-DLBCL细胞株OCI-LY-19为研究对象,观察SNS-032对OCI-LY-19细胞的抗肿瘤活性,并分析其可能的作用机制,以期探讨该化合物在弥漫性大B淋巴瘤治疗中的潜在应用价值。
材料和方法
1 材料
OCI-LY-19细胞株购自中国医学科学院血液学研究所。胎牛血清购自HyClone。RPMI-1640培养基购自Gibco。MTS购自Promega。碘化丙啶(propidium iodide,PI)和Annexin V细胞凋亡检测试剂盒购自Sigma-Aldrich。抗聚腺苷二磷酸-核糖聚合酶[poly(ADP-ribose)polymerase,PRAP]、含半胱氨酸天冬氨酸蛋白水解酶3、9前体(procaspase-3和procaspase-9)、含半胱氨酸天冬氨酸蛋白水解酶3、9切割体(cleaved caspase-3和 cleaved caspase-9)、蛋白丝/苏氨酸激酶 (protein serine/threonine kinase,Akt)、p-Akt、细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)和 p-ERK抗体为 Cell Signaling产品。抗髓样细胞白血病1(myeloid cell leukemia-1,Mcl-1)、X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、3-磷酸甘油醛脱氢酶(glyceraldehyde3-phosphatedehydrogenase,GAPDH)、信号转导子及转录激活子5(signal transductor and activator of transcription 5,STAT5)和p-STAT5抗体购自Upstate Technology。HRP-抗鼠/兔 Ig抗体为Pierce Biotechnology产品。
2 主要方法
2.1 细胞培养与加药 OCI-LY-19细胞用含10%胎牛血清的RPMI-1640培养液(含1×105U/L青霉素和100 mg/L链霉素),于37℃、5%CO2、饱和湿度条件下培养,实验所用的细胞均处于对数生长期。实验所用的SNS-032由DMSO溶解,贮存浓度为20 mmol/L。加药时用灭菌的PBS将SNS-032稀释至一定浓度,计算加药的体积,确保每组中DMSO的量一致(DMSO的终浓度控制在0.1%以下)。实验设计中所有的对照组(control,C)均加入与加药组等比例的DMSO和PBS混合液。
2.2 细胞活力检测实验 用MTS法测细胞活力抑制情况,取生长良好的OCI-LY-19细胞,配成单细胞悬液,稀释为2×108cells/L后,加至96孔板,对照组加入RPMI-1640培养基50 μL;实验组每孔加入含SNS-032的培养基50 μL,使 SNS-032终浓度为0、0.08、0.16、0.31、0.63 和 1.25 μmol/L,每组 3 个重复孔。加入不同浓度SNS-032作用68 h后于实验各孔分别加MTS试剂20 μL,37℃继续孵育4 h,酶联免疫检测仪测定各孔的吸光度值(测定波长490 nm),以浓度为横坐标,细胞活力为纵坐标绘制SNS-032对OCI-LY-19细胞生长活力抑制的柱状图,用GraphPad Prism 4.0软件计算半数抑制浓度(50%inhibitory concentration,IC50)。
2.3 PI单染细胞形态学检测 OCI-LY-19细胞经0.5 μmol/L SNS-032 处理,5 h 后加入已过滤的 PI(1∶100)染液,多时点动态观察,显微镜TRITC荧光通道拍照记录PI阳性细胞(红染细胞)。
2.4 Annexin V/PI双标记法流式细胞术测定细胞凋亡 实验按照Sigma-Aldrich公司提供的试剂说明书操作,重复3次,实验设有不同药物浓度组。收集细胞,1×binding buffer洗涤细胞后,Annexin V工作液100 μL室温孵育 15 min,检测前每管加 PI 1 μL上机。该法能区分正常细胞、早期凋亡细胞、晚期凋亡细胞及坏死细胞。在双变量流式细胞仪的散点图上,取右下象限和右上象限的总和(即Annexin V阳性细胞群)计为凋亡细胞。
2.5 Western blotting检测 细胞密度调整至2×108cells/L,不同时点和不同浓度的SNS-032处理后收集细胞,加入蛋白裂解液RIPA(含蛋白酶抑制剂)充分裂解细胞提取蛋白,Bio-Rad蛋白浓度试剂盒紫外分光750 nm波长定量蛋白浓度。100~130 V恒压电泳约90 min,100 V恒压转膜约90 min,5%牛奶室温封闭1 h,I抗4℃过夜次日曝光。
3 统计学处理
用GraphPad Prism 4.0软件对数据进行分析,数据用均数±标准差(mean±SD)表示,用单因素方差分析检验,以P<0.05为差异有统计学意义。
结 果
1 SNS-032抑制OCI-LY-19细胞活力
用不同浓度的SNS-032处理OCI-LY-19细胞72 h后发现,当药物浓度达到0.31 μmol/L时,药物对细胞的生长活力出现了明显的抑制(P<0.05)。随着药物浓度增加,SNS-032对细胞活力的抑制就更加明显,见图1。经计算,SNS-032对OCI-LY-19细胞的IC50是 0.358 μmol/L。
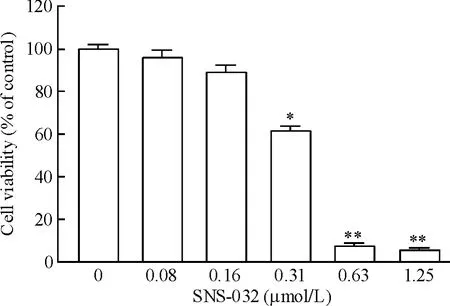
Figure 1.Effect of SNS-032 on cell viability of DLBCL cell line OCI-LY-19.Mean ± SD.n=3.*P < 0.05,**P <0.01 vs control(0 μmol/L).图1 SNS-032对弥漫性大B淋巴瘤细胞株OCI-LY-19活力的影响
2 SNS-032诱导OCI-LY-19细胞凋亡
0.5 μmol/L SNS-032 处理 OCI-LY-19 细胞后取6、12、26和36 h细胞分别进行PI单染并在荧光显微镜下观察,如图2所示,发现12 h后PI染色阳性细胞(红染细胞)明显增多(P<0.05),说明SNS-032明显诱导了细胞死亡。图3结果显示,与空白组比较,0.25 μmol/L 组、0.5 μmol/L 组和 0.75 μmol/L组细胞凋亡比例(右下象限和右上象限的总和数)明显增加,分别是7%、32%和52%,差异有统计学意义(P<0.05),这更进一步说明了SNS-032能明显诱导OCI-LY-19细胞发生凋亡。

Figure 2.SNS-032(0.5 μmol/L)induced death of DLBCL cell line OCI-LY-19(PI staining,×100).图2 SNS-032(0.5 μmol/L)诱导弥漫性大B淋巴瘤细胞株OCI-LY-19死亡
3 SNS-032对凋亡相关蛋白表达的影响
PARP切割呈SNS-032剂量与时间依赖性,procaspase-3、procaspase-9、XIAP与 Mcl-1 的表达随药物浓度和处理时间的增加而减少,cleaved caspase-3和cleaved caspase-9的表达明显增多,Bcl-2没有明显变化,见图4。这说明SNS-032能明显增加 caspase-3与caspase-9前体的降解,诱导OCI-LY-19细胞凋亡,并且诱导细胞凋亡的通路与抑制XIAP和Mcl-1表达密切相关。

Figure 4.Effects of SNS-032 on the expression of apoptosis-related proteins PARP,procaspase-3,procaspase-9,cleaved caspase-3,cleaved caspase-9,XIAP,Mcl-1 and Bcl-2 in DLBCL cell line OCI-LY-19.Mean ± SD.n=3.*P <0.05,** P <0.01 vs control(0 μmol/L or 0 h).图4 SNS-032对弥漫性大B淋巴瘤细胞株OCI-LY-19凋亡相关蛋白PARP、procaspase-3、procasepase-9、cleaved caspase-3、cleaved caspase-9、XIAP、Mcl-1和 Bcl-2表达的影响
4 SNS-032对增殖相关蛋白表达的抑制作用
SNS-032在OCI-LY-19细胞中呈浓度和时间依赖性地下调Akt和STAT5的总蛋白及其磷酸化蛋白表达,下调ERK的磷酸化水平,ERK总蛋白未见明显变化,见图5。
讨 论
DLBCL是成人恶性淋巴瘤中最常见的一型,在形态学和临床表现上都具有显著的异质性,且细胞多药耐药基因显著表达,传统化疗药物治疗后预后很差[1],新型药物的研发迫在眉睫。为此,我们选取了弥漫性大B淋巴瘤细胞株OCI-LY-19为研究对象,观察小分子化合物SNS-032对其增殖与凋亡的影响。实验结果显示,SNS-032可通过切割PARP,下调XIAP和Mcl-1表达及激活caspase-3和caspase-9而诱导OCI-LY-19细胞凋亡,同时抑制了与细胞增殖相关的JAKs/STATs、MEK/ERK和PI3K-Akt信号转导通路的表达与活化。据我们所知,这是首次发现SNS-032可以有效杀伤弥漫性大B淋巴瘤OCILY-19细胞。
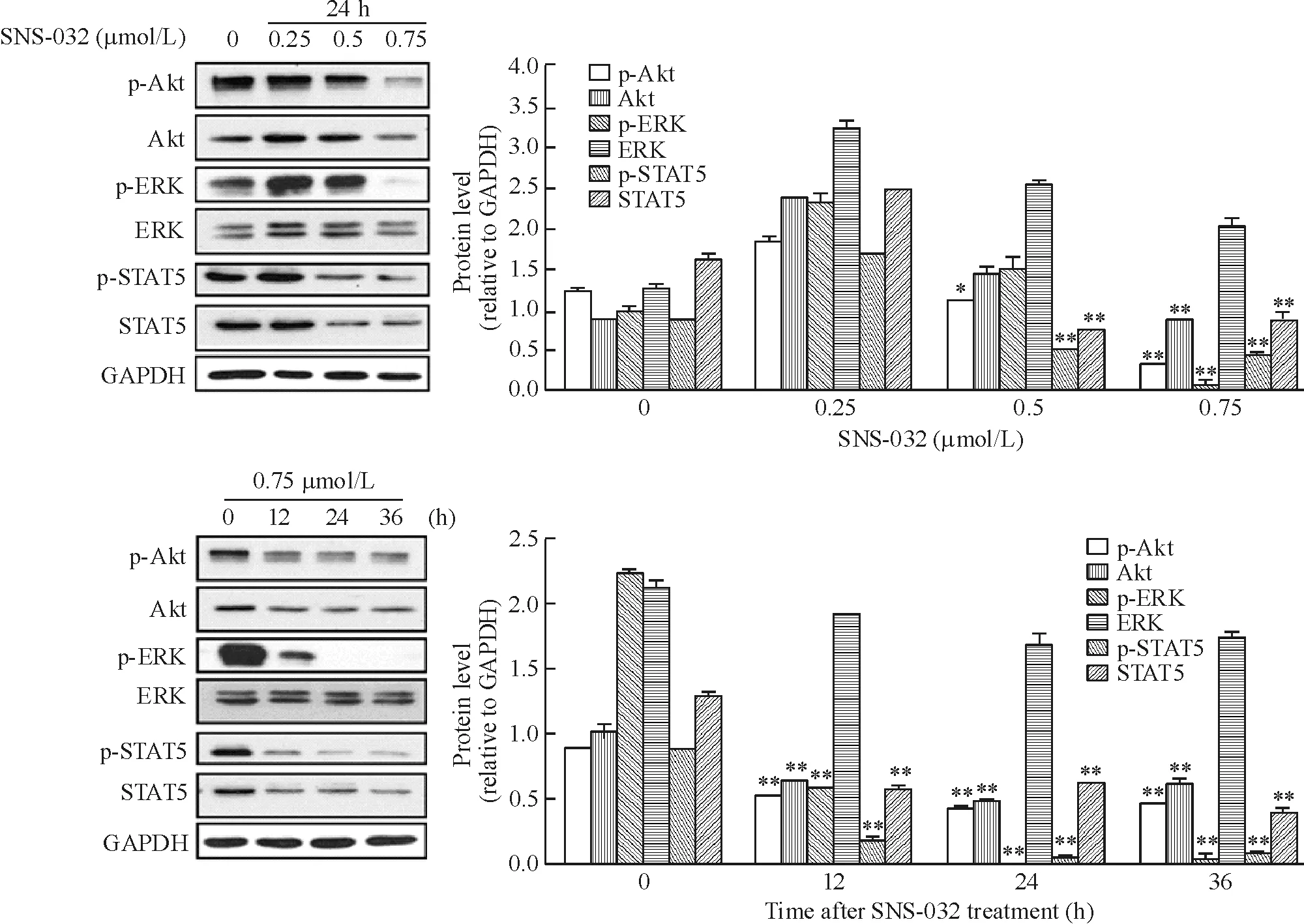
Figure 5.Effects of SNS-032 on the expression of proliferation-related proteins Akt,p-Akt,ERK,p-ERK,STAT5 and p-STAT5 in DLBCL cell line OCI-LY-19.Mean ±SD.n=3.*P <0.05,**P <0.01 vs control(0 μmol/L or 0 h).图5 SNS-032对弥漫性大B淋巴瘤细胞株OCI-LY-19增殖相关蛋白Akt、p-Akt、ERK、p-ERK、STAT5和 p-STAT5表达的影响
已有报道证明小分子化合物SNS-032可用于多种肿瘤,如急性粒细胞性白血病[3]、慢性淋巴性白血病[4]、多发性骨髓瘤、肠癌、非小细胞肺癌等[5-6]的治疗。国内外未见有关SNS-032作用于弥漫性大B淋巴瘤的报道,我们的研究显示了SNS-032具有明显的抗DLBCL作用。
实验过程中我们观察到SNS-032对能明显抑制OCI-LY-19细胞生长并诱导OCI-LY-19细胞凋亡。首先,MTS法显示,随着药物浓度增加,SNS-032对细胞的生长抑制率明显增加;再者,加入0.5 μmol/L SNS-032后,PI染色细胞数目增多,提示死亡细胞增多,而Annexin V/PI双标记流式细胞术检测结果显示用不同浓度SNS-032处理细胞24 h后,随着药物浓度增加,凋亡细胞增多;目前认为细胞凋亡的主要机制为caspase级联反应,而caspase-9与 caspase-3在caspase级联反应中分别在起始与执行上处于核心地位,是细胞凋亡发生的关键步骤。Caspase-9与caspase-3的活化意味着细胞凋亡[7],为此,我们用Western blotting检测了caspase-9与caspase-3前体procaspase-3与procaspase-9的表达情况,结果显示两者前体形式的表达均随SNS-032浓度和时间的增大而减少,而具有DNA损伤修复作用且为caspase-3的底物PARP[8]也呈剂量与时间依赖性的增高而被切割,这都显示了caspase级联通路的活化。文献报道,IAPs家族的XIAP、Bcl-2蛋白家族中的Mcl-1和Bcl-2在细胞中表达增多时,细胞抗凋亡功能增强[9-10],从结果来看,虽然Bcl-2的表达没有明显变化,但XIAP和Mcl-1的表达均随剂量与时间依赖性地增大而减少,细胞抗凋亡功能减弱。以上研究结果表明,SNS-032能诱导弥漫性大B淋巴瘤OCI-LY-19细胞的凋亡,其机制可能是抑制该类抗凋亡相关蛋白的表达,同时活化了caspase级联反应。JAKs/STATs、MEK/ERK和PI3K-Akt信号转导通路与细胞的增殖、分化及凋亡关系密切,这些通路异常活化可导致细胞异常增殖和恶性转化[11-13]。为此,我们检测这些通路中的关键蛋白Akt、STAT5、ERK的磷酸化形式及总蛋白的表达情况。结果显示,该类蛋白的总体蛋白及磷酸化形式p-Akt、p-STAT5、p-ERK的表达随SNS-032浓度和处理时间的增加而抑制,并且Akt与STAT5总蛋白的表达明显下降,这提示SNS-032抑制 JAKs/STATs、MEK/ERK和 PI3K-Akt信号通路中关键蛋白的表达与活化,从而导致OCILY-19细胞增殖受到抑制。而这些通路是否与细胞凋亡相关基因的表达有关,并且通过什么样的方式联系,是我们今后需要进一步探讨的科学问题。SNS-032为 CDK2、7、9的抑制剂,其中 CDK7和CDK9与RNA聚合酶II的磷酸化密切相关,SNS-032是否参与和OCI-LY-19细胞凋亡相关的基因,如XIAP和Mcl-1的转录调控过程,也是我们进一步要研究的关键问题。
总之,SNS-032通过抑制细胞抗凋亡相关蛋白的表达,抑制JAKs/STATs、MEK/ERK和 MEK/ERK信号转导通路的表达与活化,从而明显抑制弥漫性大B淋巴瘤OCI-LY-19细胞生长,诱导细胞凋亡,为临床上弥漫性大B淋巴瘤的药物治疗提供了新的备选小分子化合物与新的思路。
[1] Gutiérrez-García G,Cardesa-Salzmann T,Climent F,et al.Gene-expression profiling and not immunophenotypic algorithms predicts prognosis in patients with diffuse large B-cell lymphoma treated with immunochemotherapy[J].Blood,2011,117(18):4836-4843.
[2] Chen R,Chubb S,Cheng T,et al.Responses in mantle cell lymphoma cells to SNS-032 depend on the biological context of each cell line[J].Cancer Res,2010,70(16):6587-6597.
[3] Walsby E,Lazenby M,Pepper C,et al.The cyclin-dependent kinase inhibitor SNS-032 has single agent activity in AML cells and is highly synergistic with cytarabine[J].Leukemia,2011,25(3):411-419.
[4] Chen R,Wierda WG,Chubb S,et al.Mechanism of action of SNS-032,a novel cyclin-dependent kinase inhibitor,in chronic lymphocytic leukemia[J].Blood,2009,113(19):4637-4645.
[5] Boquoi A,Chen T,Enders GH.Chemoprevention of mouse intestinal tumorigenesis by the cyclin-dependent kinase inhibitor SNS-032[J].Cancer Prev Res(Phila),2009,2(9):800-806.
[6] Dickson MA,Schwartz GK.Development of cell-cycle inhibitors for cancer therapy[J].Curr Oncol,2009,16(2):36-43.
[7] 岳原亦,张 扬,张一奇.Caspase家族与细胞凋亡[J].中国医疗前沿,2011,6(6):25-26.
[8] 贺显君,索爱琴,许予明,等.Aβ1-42诱导小胶质细胞的炎性上清液对大鼠神经细胞凋亡及Caspase-3、PARP蛋白表达的影响[J].郑州大学学报:医学版,2009,44(6):35-38.
[9] Buggins AG,Pepper C,Patten PE,et al.Interaction with vascular endothelium enhances survival in primary chronic lymphocytic leukemia cells via NF-κB activation and de novo gene transcription[J].Cancer Res,2010,70(19):7523-7533.
[10] Gu L,Zhu N,Zhang H,et al.Regulation of XIAP translation and induction by MDM2 following irradiation[J].Cancer Cell,2009,15(5):363-375.
[11] Rauch J,Moran-Jones K,Albrecht V,et al.c-Myc regulates RNA splicing of the A-Raf kinase and its activation of the ERK pathway[J].Cancer Res,2011,71(13):4664-4674.
[12] Cerliani JP,Guillardoy T,Giulianelli S,et al.Interaction between FGFR-2,STAT5,and progesterone receptors in breast cancer[J].Cancer Res,2011,71(10):3720-3731.
[13]谢 捷,龚兴国,曾冬云.Src蛋白研究进展[J].中国病理生理杂志,2003,19(8):1119-1124.
